基于轉(zhuǎn)錄組測(cè)序的木薯性別決定相關(guān)基因挖掘
韋麗君 俞奔馳 宋恩亮 鄭華 盧賽清 付海天

摘要:【目的】明確木薯不同性型花的轉(zhuǎn)錄組差異,為深入研究木薯多開(kāi)雌花和兩性花及協(xié)調(diào)木薯性別比例提供理論參考。【方法】以木薯雄蕾、雌蕾和兩性蕾為供試材料,采用Illumina HiSeqTM 4000測(cè)序平臺(tái)對(duì)其進(jìn)行轉(zhuǎn)錄組測(cè)序,通過(guò)生物信息學(xué)對(duì)轉(zhuǎn)錄本進(jìn)行比較分析,預(yù)測(cè)和篩選出木薯性別決定相關(guān)基因。【結(jié)果】通過(guò)轉(zhuǎn)錄組分析獲得高質(zhì)量序列(Clean reads)64189053個(gè),高質(zhì)量堿基19.29 Gb。3種花蕾的GC含量均在43.00%左右、Q30均在95.00%左右。木薯雄蕾、雌蕾和兩性蕾的Clean reads總數(shù)分別為42642272、42172402和43563432條,其中,參考基因組和單端的比對(duì)率均在77.00%左右、多位置比對(duì)率均小于0.80%,正、負(fù)鏈比對(duì)率均在39.00%左右;約有90.00%的序列定位于外顯子,僅有5.00%的序列定位于內(nèi)含子或基因間區(qū)。在雄蕾—雌蕾(前者是對(duì)照,后者是處理,下同)、雄蕾—兩性蕾和雌蕾—兩性蕾3個(gè)對(duì)比組中分別篩選到3629、2499和2492個(gè)差異表達(dá)基因(DEGs),注釋到GO功能數(shù)據(jù)庫(kù)中的DEGs分別為2544、1749和1807個(gè),其中,雄蕾—雌蕾對(duì)比組的上調(diào)表達(dá)基因和下調(diào)表達(dá)基因數(shù)量均最多。以富集于生物學(xué)過(guò)程(主要為代謝過(guò)程和細(xì)胞過(guò)程)的DEGs最多,其次是分子功能(主要為結(jié)合和催化)和細(xì)胞組分(主要為細(xì)胞和細(xì)胞部分);無(wú)論是注釋到GO功能數(shù)據(jù)庫(kù)的DEGs,還是注釋到生物學(xué)過(guò)程、細(xì)胞部分和分子功能等主要次級(jí)分類(lèi)中的DEGs,均以雄蕾—雌蕾對(duì)比組最多。3個(gè)對(duì)比組中均以參與激素信號(hào)傳導(dǎo)的DEGs最多;且又以富集于一般功能預(yù)測(cè)的DEGs最多,其次是富集于轉(zhuǎn)錄的DEGs,富集于復(fù)制、重組和修復(fù)及信號(hào)傳導(dǎo)機(jī)制的DEGs也較多,但雄蕾—雌蕾對(duì)比組大部分GOG功能類(lèi)別的DEGs明顯多于雄蕾—兩性蕾和雌蕾—兩性蕾對(duì)比組,而雄蕾—兩性蕾與雌蕾—兩性蕾對(duì)比組間差異不明顯。3個(gè)對(duì)比組的DEGs富集于50條KEGG信號(hào)通路,其中以富集于植物激素信號(hào)傳導(dǎo)的DEGs最多,共篩選獲得88個(gè)與激素信號(hào)轉(zhuǎn)導(dǎo)相關(guān)的DEGs,其中l(wèi)og2FC>3的基因有26個(gè),且大多數(shù)為生長(zhǎng)素相關(guān)的基因。木薯雄蕾、雌蕾和兩性蕾間差異表達(dá)的轉(zhuǎn)錄因子基因有196個(gè),log2FC>3的轉(zhuǎn)錄因子基因有87個(gè),主要為ERF、bHLH、WRKY和MYB四大類(lèi)轉(zhuǎn)錄因子基因。【結(jié)論】木薯不同性型花存在較多的DEGs,其中與生長(zhǎng)素及ERF、bHLH、WRKY和MYB轉(zhuǎn)錄因子相關(guān)的基因均與木薯性別決定密切相關(guān),可能是木薯性別分化的關(guān)鍵調(diào)控基因。
關(guān)鍵詞: 木薯;性別決定;基因挖掘;差異表達(dá)基因(DEGs);激素信號(hào)傳導(dǎo);轉(zhuǎn)錄組測(cè)序
中圖分類(lèi)號(hào): S533.035.3? ? ? ? ? ? ? ? ? ? ? ? ? 文獻(xiàn)標(biāo)志碼: A 文章編號(hào):2095-1191(2020)08-1785-12
Gene mining for sex determination in cassava(Manihot esculenta Crantz) based on transcriptome sequencing
WEI Li-jun, YU Ben-chi*, SONG En-liang, ZHENG Hua, LU Sai-qing, FU Hai-tian
(Guangxi Subtropical Crops Research Institute, Nanning? 530001, China)
Abstract:【Objective】Transcriptome difference of cassava flowers with different sex-types were studied to provide theoretical basis for cassava developing more female flowers and bisexual flowers, and further for controlling the proportion of cassava flowers sex. 【Method】The transcriptome of male buds,female buds and bisexual buds from cassava were sequenced with Illumina HiSeqTM 4000 platform. Comparative analysis of transcription through bioinformatics was performed to predict and screen for the genes involved in cassava sex determination. 【Result】The results showed that a total of 64189053 clean reads and 19.20 Gb clean bases were obtained,the GC content of the three buds were about 43.00% and the Q30 were about 95.00%. For male buds, female buds and bisexual buds, total clean reads were 42642272, 42172402 and 43563432, respectively. The proportion of reference genome, unique mapped reads, multiple mapped reads, reads Map to “+”, and reads Map to “-” were 77.00%, 77.00%, less than 0.80%, 39.00% and 39.00%, respectively. About 90.00% of the reads were identified in exon, and about 5.00% were identified in intron or gene interval. Differential expression analysis showed that 3629,2499 and 2492 differentially expressed genes(DEGs) were successively found in male buds-female buds(M-F), male buds-bisexual buds(M-B) and female buds-bisexual buds(F-B)(the former one was control, the latter was treatment), in which, 2544, 1749 and 1807 DEGs were annotated to GO function database, respectively. The down-regulated and up-regulated genes were the most in the M-F group among the three comparisons. The DEGs were mainly involved in biological processes(mainly metabolic process and cell process), and secondly involved in molecular functions (mainly binding and catalysis) and cellular component(cell and cell part). The quantities of DEGs annotated to GO database, or annotated to the biological process, cellular component or molecular function in the M-F were higher than those in the other comparisons. For all comparisons, the quantities of DEGs involved in hormone sig-naling transduction were always the most among all KEGG pathway. The main functions involved in DEGs were generally functional prediction,followed by transcription, replication, recombination and repair, and signaling transduction mechanisms, in which, the quantities for M-F exceeded those for the M-B and the F-B. And the DEGs were not significantly different between the latter two treatments. In all treatments, a signal transduction mechanisms. DEGs were enriched in 50 KEGG signaling pathways,including the largest number of plant hormone signal transduction. Through further screening, a total of 88 hormone-related genes were obtained, including 26 genes with log2FC>3, and the most involved in auxin. A total of 196 transcription factors were obtained,including 87 genes with log2FC>3,and mainly involved in ERF, WRKY, bHLH and MYB. 【Conclusion】There are many differentially expressed genes in different sex-types flowers in cassava. Auxin, ERF,WRKY,bHLH and MYB transcription factor related genes are closely related to sex determination of ca-ssava, they may be the key regulatory factors of cassava sex determination.
1. 4 數(shù)據(jù)分析
原始測(cè)序數(shù)據(jù)(Raw data)以FASTQ格式保存,經(jīng)匹配及過(guò)濾低質(zhì)量堿基后得到高質(zhì)量序列(Clean reads),再與參考基因組比對(duì)得到比對(duì)序列(Mapped reads)。從NCBI數(shù)據(jù)庫(kù)搜索下載參考基因組。然后通過(guò)比對(duì)效率(Mapped ratio)和Clean reads在參考基因組上的分布情況判定比對(duì)結(jié)果是否合格,合格的Clean reads可用于后續(xù)的生物信息學(xué)分析。
1. 5 差異表達(dá)基因(DEGs)篩選
應(yīng)用Cufflinks中的Cuffquant和Cuffnorm組件,結(jié)合Mapped reads在基因組上的位置信息定量轉(zhuǎn)錄本及基因表達(dá)水平。采用FPKM(Fragments per kilobase per million mapped reads)表示轉(zhuǎn)錄本或基因表達(dá)水平,并以Benjamini-Hochberg校正p值(p-value)。以表達(dá)差異倍數(shù)(Fold change,F(xiàn)C)結(jié)合錯(cuò)誤發(fā)生率(False discovery rate,F(xiàn)DR)篩選DEGs,即以FC≥2且FDR≤0.01為標(biāo)準(zhǔn),利用EBseq進(jìn)行差異表達(dá)基因分析(Leng et al.,2013),篩選出log2FC>3的差異表達(dá)顯著基因。
1. 6 統(tǒng)計(jì)分析
采用Excel 2010統(tǒng)計(jì)試驗(yàn)數(shù)據(jù),繪制DEGs數(shù)量柱形圖及其COG分類(lèi)圖;利用topGO繪制DEGs的GO功能富集圖;并以KOBAS繪制DEGs顯著富集的KEGG信號(hào)通路富集圖。
2 結(jié)果與分析
2. 1 木薯花蕾測(cè)序數(shù)據(jù)及質(zhì)量分析結(jié)果
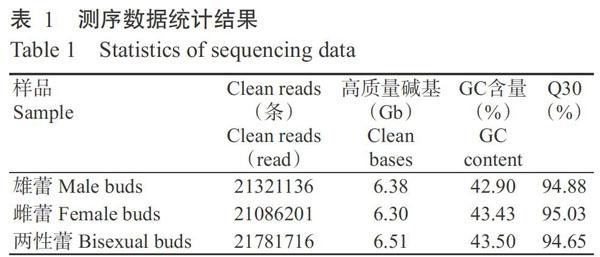
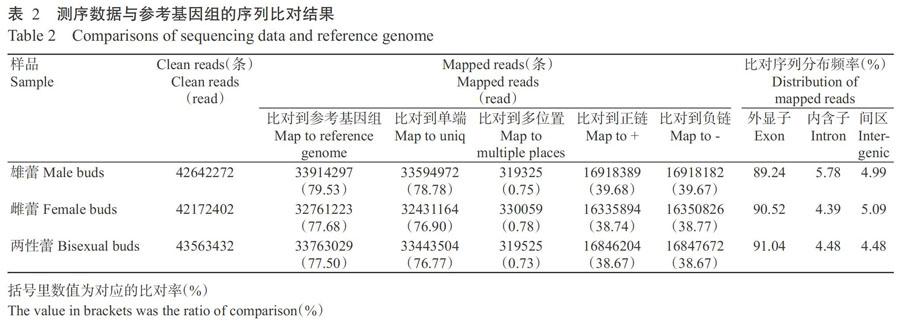
Raw data經(jīng)過(guò)濾去雜后,共得到64189053條Clean reads,高質(zhì)量堿基19.29 Gb,每個(gè)樣品的高質(zhì)量堿基均在6.30 Gb以上。3種花蕾的GC含量均在43.00%左右、Q30均在95.00%左右(表1),表明測(cè)序質(zhì)量良好。將測(cè)序數(shù)據(jù)與參考基因組序列進(jìn)行比對(duì),結(jié)果如表2所示。木薯雄蕾、雌蕾和兩性蕾對(duì)比到參考基因組上的Clean reads分別為42642272、42172402和43563432條,其中,參考基因組和單端的比對(duì)率均在77.00%左右、多位置比對(duì)率均小于0.80%,正、負(fù)鏈比對(duì)率均在39.00%左右,表明試驗(yàn)污染少、測(cè)序數(shù)據(jù)質(zhì)量較好。從比對(duì)序列分布情況看,約有90.00%序列定位于外顯子,僅有5.00%左右的序列定位于內(nèi)含子和基因間區(qū)。序列比對(duì)到內(nèi)含子和基因間區(qū)分別是由于mRNA前體、發(fā)生可變剪切的內(nèi)含子保留或基因組注釋不完善所致。
2. 2 木薯不同花蕾間的DEGs分析結(jié)果
根據(jù)DEGs篩選標(biāo)準(zhǔn),在雄蕾—雌蕾(前者是對(duì)照,后者是處理,下同)、雄蕾—兩性蕾和雌蕾—兩性蕾3個(gè)對(duì)比組中篩選到的DEGs分別為3629、2499和2492個(gè)(圖1),其中上調(diào)表達(dá)基因分別為2290、1718和1340個(gè),下調(diào)表達(dá)基因分別為1339、781和1152個(gè),即雄蕾—雌蕾對(duì)比組中上調(diào)表達(dá)和下調(diào)表達(dá)的基因數(shù)量均最多。雄蕾—兩性蕾對(duì)比組上調(diào)表達(dá)和下調(diào)表達(dá)的基因數(shù)量差異最大,上調(diào)表達(dá)基因數(shù)量是下調(diào)表達(dá)基因數(shù)量的2.20倍,其次為雄蕾—雌蕾對(duì)比組,上調(diào)表達(dá)基因數(shù)量是下調(diào)表達(dá)基因數(shù)量的1.71倍,表明雄蕾—兩性蕾和雄蕾—雌蕾對(duì)比組的DEGs以上調(diào)表達(dá)為主、下調(diào)表達(dá)為輔。
2. 2. 1 DEGs的GO功能富集分析結(jié)果 雄蕾—雌蕾、雄蕾—兩性蕾和雌蕾—兩性蕾3個(gè)對(duì)比組注釋到GO功能數(shù)據(jù)庫(kù)中的DEGs分別為2544、1749和1807個(gè)。對(duì)DEGs的GO功能進(jìn)行富集分析,結(jié)果(圖2)顯示,3個(gè)對(duì)比組均以富集于生物學(xué)過(guò)程的DEGs最多,其次為分子功能,以富集于細(xì)胞組分的DEGs最少。在生物學(xué)過(guò)程方面,雄蕾—雌蕾、雄蕾—兩性蕾和雌蕾—兩性蕾3個(gè)對(duì)比組均以富集于代謝過(guò)程的DEGs最多,分別為1577、1087和1148個(gè),其次為細(xì)胞過(guò)程,分別為1348、932和946個(gè),富集于單細(xì)胞過(guò)程的DEGs數(shù)量也較多,分別為1302、935和946個(gè)。在細(xì)胞組分方面,雄蕾—雌蕾、雄蕾—兩性蕾和雌蕾—兩性蕾3個(gè)對(duì)比組均以富集于細(xì)胞和細(xì)胞部分的DEGs較多,其中,富集于細(xì)胞的DEGs分別為994、716和699個(gè),富集于細(xì)胞部分的DEGs分別為999、720和703個(gè);富集于細(xì)胞器的DEGs也較多,分別為672、485和471個(gè)。在分子功能方面,雄蕾—雌蕾、雄蕾—兩性蕾和雌蕾—兩性蕾3個(gè)對(duì)比組均以富集于催化活性和結(jié)合的DEGs較多,其中富集于催化活性的DEGs分別為1373、954和1002個(gè),富集于結(jié)合的DEGs分別為1369、946和940個(gè)。可見(jiàn),在GO功能富集分析中,無(wú)論是注釋到GO功能數(shù)據(jù)庫(kù)的DEGs,還是注釋到生物學(xué)過(guò)程、細(xì)胞部分和分子功能等主要次級(jí)分類(lèi)中的DEGs,均以雄蕾—雌蕾對(duì)比組最多。
2. 2. 2 DEGs的KEGG信號(hào)通路富集分析結(jié)果
KEGG信號(hào)通路富集分析結(jié)果顯示,3個(gè)對(duì)比組的DEGs均注釋到KEGG數(shù)據(jù)庫(kù)的50條信號(hào)通路上,且這50條信號(hào)通路可劃分為細(xì)胞過(guò)程、環(huán)境信息處理、遺傳信息處理、代謝和有機(jī)系統(tǒng)五大類(lèi)。其中,雄蕾—雌蕾對(duì)比組的DEGs主要參與在植物激素信號(hào)傳導(dǎo)、苯丙素的生物合成、內(nèi)質(zhì)網(wǎng)中的蛋白質(zhì)加工、淀粉和蔗糖代謝、嘌呤代謝及嘧啶代謝等通路(圖3);雄蕾—兩性蕾對(duì)比組的DEGs主要參與植物激素信號(hào)傳導(dǎo)、淀粉和蔗糖代謝、氨基酸的生物合成、苯丙素的生物合成及嘌呤代謝等通路(圖4);雌蕾—兩性蕾對(duì)比組的DEGs主要參與植物激素信號(hào)傳導(dǎo)、苯丙素的生物合成、內(nèi)質(zhì)網(wǎng)中的蛋白質(zhì)加工、淀粉和蔗糖代謝及苯丙氨酸代謝等通路(圖5)。可見(jiàn),3個(gè)對(duì)比組均以參與激素信號(hào)傳導(dǎo)的DEGs最多,表明植物激素在木薯花性分化中發(fā)揮非常重要的作用。
2. 2. 3 DEGs的COG功能注釋分析結(jié)果 COG功能注釋分析結(jié)果(圖6)顯示,3個(gè)對(duì)比組的DEGs在COG功能類(lèi)別中的分布頻率趨勢(shì)基本一致。雄蕾—雌蕾、雄蕾—兩性蕾和雌蕾—兩性蕾3個(gè)對(duì)比組均以富集于一般功能預(yù)測(cè)的DEGs最多,分別為455、285和293個(gè),其次是富集于轉(zhuǎn)錄的DEGs,分別為306、181和190個(gè),富集于復(fù)制、重組和修復(fù)的DEGs也較多,分別為289、183和183個(gè);雄蕾—雌蕾、雄蕾—兩性蕾和雌蕾—兩性蕾3個(gè)對(duì)比組富集于信號(hào)傳導(dǎo)機(jī)制的DEGs分別為269、173和165個(gè)。可見(jiàn),雄蕾—雌蕾對(duì)比組大部分COG功能類(lèi)別的DEGs明顯多于雄蕾—兩性蕾和雌蕾—兩性蕾對(duì)比組,而雄蕾—兩性蕾和雌蕾—兩性蕾對(duì)比組間差異不明顯。
2. 3 木薯性別決定關(guān)鍵基因篩選結(jié)果
2. 3. 1 不同花性型激素相關(guān)且差異表達(dá)顯著基因分析結(jié)果 植物激素是性別分化的重要調(diào)控因子。對(duì)參與木薯雄蕾、雌蕾和兩性蕾激素信號(hào)轉(zhuǎn)導(dǎo)通路的DEGs進(jìn)行篩選,結(jié)果獲得88個(gè)與激素信號(hào)轉(zhuǎn)導(dǎo)相關(guān)的DEGs,其中差異表達(dá)顯著基因(log2FC>3)有26個(gè),包括編碼生長(zhǎng)素運(yùn)輸載體蛋白(AUX1)的LAX5基因(gene19403和gene7567),生長(zhǎng)素/吲哚-3-乙酸(AUX/IAA)的AUX22(gene18980)和ARF9(gene2348)基因;編碼吲哚-乙酸—酰氨基合成酶(CH3)的F24B18.13(gene5960)和OSJNBa0009C 07.16(gene23116)基因;編碼生長(zhǎng)素上調(diào)miRNA(SAUR)的gene1397、gene19365、gene19962、gene 21742、gene23646、gene3612、gene13617、gene5215和gene9869基因;編碼B型反應(yīng)調(diào)節(jié)因子(B-ARR)的ARR18(gene24542)基因;編碼GID1蛋白的T200O 10.110(gene9091)基因;編碼蔗糖非依賴(lài)蛋白激酶2(SnRK2)的OOSJNBa0017N12.8(gene21379)基因;編碼生長(zhǎng)素響應(yīng)因子(ABF)的At2g36270(gene 13760)基因;編碼EIN3互作蛋白(EBF1/2)的F13B15.15(gene10983和gene24462)基因;編碼ERF1/2的K14B15.15(gene6396)基因;編碼D3型細(xì)胞周期蛋白(CYCD3)的F28A23.80(gene12887)、CYCD3-2(gene22828)和F28A23.80(gene29777)基因;編碼茉莉酸氨基酸合成酶(JAR1)的OSJNBa0009C07.16(gene8657)基因。在雄蕾—雌蕾對(duì)比組中,除gene5960、gene1397、gene19365、gene19962、gene21742、gene23646、gene3612、gene9091、gene 21379、gene10983、gene24462、gene6396和gene8657基因顯著下調(diào)表達(dá)外,其余基因均為顯著上調(diào)表達(dá);在雄蕾—兩性蕾對(duì)比組中,差異表達(dá)顯著基因有g(shù)ene19403、gene7567、gene18980、gene2348、gene 12887、gene22828和gene29777,均呈上調(diào)表達(dá);在雌蕾—兩性蕾對(duì)比組中,差異表達(dá)顯著基因僅有g(shù)ene5960、gene1397和gene24462,也均為上調(diào)表達(dá)。
2. 3. 2 不同花性型差異表達(dá)顯著轉(zhuǎn)錄因子基因分析結(jié)果 木薯雄蕾、雌蕾和兩性蕾間差異表達(dá)的轉(zhuǎn)錄因子基因有196個(gè),其中ERF、bHLH、WRKY和MYB 四大類(lèi)轉(zhuǎn)錄因子基因所占比例較高,分別為15.31%、17.86%、15.82%和11.22%,其中,log2FC>3的差異表達(dá)顯著轉(zhuǎn)錄因子基因共87個(gè)。
與ERF轉(zhuǎn)錄因子相關(guān)的差異表達(dá)顯著基因有16個(gè)。其中,在雄蕾—雌蕾對(duì)比組中上調(diào)表達(dá)基因?yàn)門(mén)13E15.15(gene8938)、MQL5_9(gene830)、T13J8.60(gene8664)、ERF017(gene5340和gene5224)、ERF034 (gene811)和ERF109(gene17566),下調(diào)表達(dá)基因?yàn)镵14B15.15(gene6396)、ERF011(gene29765和gene 10121)、ERF112(gene4369)、ERF113(gene17021和gene14536)、ERF114(gene23610和gene11659)和T29J13.210(gene2504);在雄蕾—兩性蕾和雌蕾—兩性蕾對(duì)比組中差異表達(dá)顯著基因各有2個(gè),分別為gene5224和gene17566、gene17021和gene23610,且均呈上調(diào)表達(dá)。
與WRKY轉(zhuǎn)錄因子相關(guān)的差異表達(dá)顯著基因有12個(gè)。其中,在雄蕾—雌蕾對(duì)比組中上調(diào)表達(dá)基因?yàn)閃RKY21(gene9231)和WRKY50(gene5294),下調(diào)表達(dá)基因共8個(gè),分別為WRKY3(gene972)、WRKY47(gene8490)、WRKY71(gene3445)、WRKY72(gene26615)、WRKY75(gene11601、gene20201和gene 29166)和WRKY6(木薯新基因);在雄蕾—兩性蕾對(duì)比組中,差異表達(dá)顯著基因僅有WRKY21(gene9231),為上調(diào)表達(dá);在雌蕾—兩性蕾對(duì)比組中,上調(diào)表達(dá)基因共7個(gè),分別為gene972、gene 26615、gene20201、gene11601、WRKY27(gene2799)、WRKY72(gene1819)和WRKY75(gene21757),下調(diào)表達(dá)基因僅有WRKY13(gene30823)。
與bHLH轉(zhuǎn)錄因子相關(guān)的差異表達(dá)顯著基因有16個(gè)。其中,在雄蕾—雌蕾比對(duì)組中,下調(diào)表達(dá)基因有3個(gè),分別為T(mén)24P15.19(gene13983)、K15N18.2(木薯新基因)和T9N14.4(gene21370),上調(diào)表達(dá)基因共11個(gè),分別為T(mén)28I19.130(gene22708)、MZA15.1(gene27699)、F21F14.120(gene8565)、F2C19.2(gene 27655)、K9D7.15(gene6435)、K21L13.16(gene21284、gene22690和gene29901)和T9N14.4(gene16785、gene 14755和gene26683);在雌蕾—兩性蕾對(duì)比組中,差異表達(dá)顯著基因?yàn)間ene21370、F4F7.28(gene1075)和BHLH84(gene10165),均呈上調(diào)表達(dá);在雄蕾—兩性蕾對(duì)比組中,上調(diào)表達(dá)基因?yàn)間ene27699、gene 8565、gene29901、gene22690、gene26683和gene14755,下調(diào)表達(dá)基因僅有K15N18.2(木薯新基因)。
與MYB轉(zhuǎn)錄因子相關(guān)的差異表達(dá)顯著基因有11個(gè)。其中,在雄蕾—雌蕾對(duì)比組中,上調(diào)表達(dá)基因?yàn)镕5E6.18(gene24177)、dl4925c(gene28472和gene 3091)和F21E10.4(gene11478),下調(diào)表達(dá)基因?yàn)镸YB23(gene3024)、K8K14.2(gene338、gene9413、gene21632和gene16518)和F21E10.4(gene18714和gene8156);在雄蕾—兩性蕾對(duì)比組中,差異表達(dá)顯著基因僅有g(shù)ene16518,為上調(diào)表達(dá);在雌蕾—兩性蕾對(duì)比組中,差異表達(dá)顯著基因有g(shù)ene24177、gene28472和gene11478,也均為上調(diào)表達(dá)。
與GATA、NAC和AP2/ARF等轉(zhuǎn)錄因子相關(guān)的差異表達(dá)顯著基因有32個(gè)。其中,在雄蕾—雌蕾比對(duì)組中,上調(diào)表達(dá)基因有23個(gè),分別為AIL1(gene8193和gene18671)、T28I19.30(gene10192、gene29853和gene21252)、VRN1(gene26272)、T24C20.40(gene 11390)、GATA18(gene1303)、F2G19.8(gene29751)、gene3936、ETC1(gene28492)、At1g69490(gene23213)、MFO20.5(gene10053)、T2E6.2(gene29522)、GTE12(gene15183)、gene23167、At1g32640(gene527)、RF2b(gene17041)、MFH8.15(gene11593、gene23355)、TCP15(gene1803)、TCP5(gene11227)和T10P11.13(gene14873),下調(diào)表達(dá)基因有6個(gè),分別為At1g69490(gene9425)、ONAC010(gene16597和gene14996)、NFYB5(gene9042)、gene31152和T1008.90(gene 16230);在雌蕾—兩性蕾對(duì)比組中,上調(diào)表達(dá)基因有g(shù)ene16597、gene31152、At1g74500(gene23918)和T1008.90(gene16230),下調(diào)表達(dá)基因僅有T8M 16.100(gene29946);在雄蕾—兩性蕾對(duì)比組中,差異表達(dá)顯著基因有g(shù)ene18671、gene21252、gene29751、gene3936、gene23355、gene1803和TAF8(木薯新基因),均呈上調(diào)表達(dá)。
3 討論
近年來(lái),轉(zhuǎn)錄組差異分析技術(shù)已廣泛應(yīng)用于動(dòng)植物有關(guān)基因的發(fā)掘研究。周大顏等(2019)利用RNA-seq技術(shù)構(gòu)建3種白鯽雜交子代轉(zhuǎn)錄組文庫(kù)并進(jìn)行測(cè)序分析,獲得參與抗氧化、免疫和生長(zhǎng)發(fā)育相關(guān)的通路和基因序列等,可用于白鯽的選擇性育種和分子標(biāo)記開(kāi)發(fā)等研究。韋麗君等(2020)應(yīng)用Illumina HiSeqTM 4000測(cè)序平臺(tái)對(duì)木薯花芽與葉芽進(jìn)行轉(zhuǎn)錄組測(cè)序,結(jié)果獲得開(kāi)花相關(guān)基因47個(gè),在一定程度上解析了木薯花芽分化的分子機(jī)制。在轉(zhuǎn)錄組分析研究中,轉(zhuǎn)錄組測(cè)序數(shù)據(jù)組裝質(zhì)量評(píng)估是功能注釋、分類(lèi)和差異基因篩選的前提(張加強(qiáng)等,2018)。本研究單個(gè)樣品的高質(zhì)量堿基數(shù)均在6.30 Gb以上,堿基質(zhì)量值Q30均在95.00%左右,表明堿基識(shí)別可靠,準(zhǔn)確度高。比對(duì)率是轉(zhuǎn)錄組數(shù)據(jù)利用率的最直接體現(xiàn),在本研究獲得的木薯花蕾測(cè)序數(shù)據(jù)中,參考基因組和單端的比對(duì)率均較高(在77.00%左右),說(shuō)明所選參考基因組組裝能滿(mǎn)足后續(xù)信息分析的需求。本研究從木薯雌蕾、雄蕾和兩性蕾中得到Clean reads分別為21321136、21086201和21781716條,高質(zhì)量堿基為6.38、6.30和6.51 Gb,表明這些數(shù)據(jù)質(zhì)量和完整性可滿(mǎn)足后期分析需要。但與木薯花芽和葉芽的轉(zhuǎn)錄組學(xué)分析結(jié)果(韋麗君等,2020)相比,本研究中的Clean reads和高質(zhì)量堿基數(shù)目較少,可能是不同發(fā)育時(shí)期的樣本差異所致,因?yàn)榛ㄑ糠只侵参飶臓I(yíng)養(yǎng)生長(zhǎng)轉(zhuǎn)為生殖生長(zhǎng)的標(biāo)志,此時(shí)芽的外部形態(tài)和內(nèi)在生理生化等均發(fā)生明顯變化,對(duì)應(yīng)的轉(zhuǎn)錄組數(shù)據(jù)也相對(duì)多而復(fù)雜。
當(dāng)前,有關(guān)植物性別分化的分子機(jī)理研究主要涉及DEGs及有關(guān)基因的篩選。閆明科等(2015)對(duì)獼猴桃雌花和雄花的miRNA進(jìn)行測(cè)序,結(jié)果發(fā)現(xiàn)170個(gè)miRNA家族成員在雌花和雄花間顯著差異表達(dá)。閆春冬(2018)研究發(fā)現(xiàn),強(qiáng)雌和強(qiáng)雄材料間的DEGs有可能參與性別分化,進(jìn)而影響雌花或雄花的轉(zhuǎn)化。本研究結(jié)果顯示,雄蕾—雌蕾對(duì)比組的DEGs數(shù)量較雄蕾—兩性蕾和雌蕾—兩性蕾對(duì)比組多,說(shuō)明雌花和雄花是性狀完全不同的兩種花,且兩性花同時(shí)具有雌、雄兩種器官,與任一種單性花均存在相似之處。閆明科等(2015)研究顯示,獼猴桃雌花和雄花間差異表達(dá)顯著基因主要富集于細(xì)胞組分的細(xì)胞和細(xì)胞部分、分子功能的結(jié)合和催化及生物學(xué)過(guò)程的代謝過(guò)程和細(xì)胞過(guò)程,與本研究的GO功能富集分析結(jié)果一致,說(shuō)明在不同植物的性別分化過(guò)程中,分子間結(jié)合和催化反應(yīng)推進(jìn)細(xì)胞部件重塑新細(xì)胞的同時(shí),代謝反應(yīng)和胞間通訊也非常活躍。此外,植物內(nèi)源激素參與調(diào)控花器官分化過(guò)程(Chen et al.,2017;Tao et al.,2018)。盛云燕等(2012)研究證實(shí),甜瓜的性別分化與赤霉素、脫落酸、半胱氨酸、蛋氨酸、油菜素內(nèi)酯及玉米素等多種激素合成、信號(hào)傳導(dǎo)等代謝途徑相關(guān)。本研究中的KEGG信號(hào)通路富集分析和COG功能注釋分析結(jié)果均顯示,3個(gè)對(duì)比組均以參與激素信號(hào)傳導(dǎo)的DEG最多,說(shuō)明激素信號(hào)傳導(dǎo)廣泛參與木薯性別決定的調(diào)控,在木薯花性分化過(guò)程中發(fā)揮關(guān)鍵作用。
生長(zhǎng)素早期響應(yīng)因子如Aux/IAA家族、ABF家族和SAUR等在生長(zhǎng)素的信號(hào)傳導(dǎo)中發(fā)揮重要作用。本研究獲得88個(gè)與激素相關(guān)的DEGs,涉及生長(zhǎng)素早期影響因子的基因約占44.32%,其中l(wèi)og2FC>3的差異表達(dá)顯著基因有15個(gè)(共26個(gè)),表明生長(zhǎng)素早期因子在木薯的性別分化過(guò)程中扮演著重要角色。杜改改等(2017)對(duì)柿雌花和雄花進(jìn)行轉(zhuǎn)錄組測(cè)序分析,共篩選出10個(gè)與激素相關(guān)的典型基因,其中編碼AUX/IAA響應(yīng)蛋白的IAA3和IAA32基因在雌花中上調(diào)表達(dá)。本研究中,表達(dá)差異顯著的生長(zhǎng)素影響因子基因LAX5(gene19403和gene7567)、AUX22(gene18980)和ARF9(gene2348)在雌花和兩性花中上調(diào)表達(dá),且在雌花中的表達(dá)量高于兩性花,編碼SAUR的基因gene1397、gene19365、gene19962、gene 21742、gene23646、gene 3612、gene13617、gene5215、gene9869和編碼CH3的基因F24B18.13(gene5960)在雄花中均上調(diào)表達(dá),推測(cè)木薯中的LAX5、AUX22和ARF9具有促雌或抑雄的調(diào)控功能,編碼SAUR和CH3的基因功能則恰好相反。CYCD3在從細(xì)胞增殖轉(zhuǎn)向分化的最后階段中發(fā)揮關(guān)鍵作用(Dewitte et al.,2007),其基因表達(dá)上調(diào)與花序分生組織的增多密切相關(guān)(Pan et al.,2014 )。本研究中與CYCD3相關(guān)的基因F28A23.80(gene12887)、CYCD3-2(gene 22828)、F28A23.80(gene29777和gene31176)在雌花和兩性花中顯著上調(diào)表達(dá),但在雌花中的表達(dá)量高于兩性花,推測(cè)木薯中編碼CYCD3的基因與雌花和兩性花的性別決定密切相關(guān)。
B類(lèi)ARRs是細(xì)胞分裂素響應(yīng)的正調(diào)節(jié)因子(Mason et al.,2005),A類(lèi)ARRs作為細(xì)胞分裂素的負(fù)調(diào)控因子可抑制B類(lèi)ARRs的活性(To and Kieber.,2008);在脫落酸信號(hào)通路中,SnRK2信號(hào)在蕨類(lèi)植物的性別決定中發(fā)揮重要作用,調(diào)節(jié)生殖周期中雄性與雌雄同體間的性別比例(McAdam et al.,2016)。肖楓(2019)對(duì)膏桐雌花與雄花的轉(zhuǎn)錄組差異分析結(jié)果顯示,A-ARR(gene13354)在雌花中顯著上調(diào)表達(dá),SnRK2(gene20150)、ABF(gene13255和gene14512)和B-ARR(gene20147)在雄花中顯著上調(diào)表達(dá)。本研究中,編碼ABF的基因At2g36270(gene 13760)和編碼B-ARR的基因ARR18(gene24542)在木薯雌花中上調(diào)表達(dá),編碼SnRK2的基因OOSJNBa0017N12.8(gene21379)在雄花中上調(diào)表達(dá),說(shuō)明木薯和膏桐中編碼這些蛋白的基因均參與性別決定調(diào)控,但作用機(jī)制可能存在差異。此外,本研究中編碼GID1的基因T20O10.110(gene9091)、編碼EBF1/2的基因F13B15.15(gene10983和gene24462)、編碼ERF1/2的基因K14B15.15(gene6396)和編碼JAR1的基因OSJNBa0009C07.16(gene8657)在木薯雄花中均顯著上調(diào)表達(dá),說(shuō)明這些基因與木薯雄花的性別決定密切相關(guān)。
轉(zhuǎn)錄因子又稱(chēng)反式作用因子,其作為一類(lèi)重要的調(diào)控基因,主要通過(guò)結(jié)合基因啟動(dòng)子區(qū)域中的順式作用元件而發(fā)揮調(diào)控作用,是近年來(lái)基因挖掘與功能分析領(lǐng)域的研究熱點(diǎn)(賈翠玲和侯和勝,2010)。至今,越來(lái)越多的研究證實(shí)轉(zhuǎn)錄因子在植物花發(fā)育,尤其在花藥和花粉的發(fā)育中發(fā)揮重要的調(diào)控作用。如AP2/ERF與花發(fā)育相關(guān)(Jofuku et al.,1994;Serra et al.,2013);AtMYB103可通過(guò)調(diào)節(jié)植物絨氈層的發(fā)育來(lái)調(diào)控花粉發(fā)育(Higginson et al.,2003);bHLH轉(zhuǎn)錄因子激活并調(diào)控開(kāi)花基因表達(dá)(Shogo et al.,2012)。本研究結(jié)果表明,在木薯雄蕾、雌蕾和兩性蕾中差異表達(dá)的轉(zhuǎn)錄因子基因有196個(gè),其中ERF、bHLH、WRKY和MYB四大類(lèi)轉(zhuǎn)錄因子基因所占比例較大,log2FC>3的轉(zhuǎn)錄因子基因數(shù)量也較多,推測(cè)這此轉(zhuǎn)錄因子參與木薯的性別決定,其相關(guān)基因?qū)δ臼淼男詣e決定起重要調(diào)控作用。Nakata等(2013a,2013b)在擬南芥中鑒定出參與茉莉酸信號(hào)傳導(dǎo)的3個(gè)bHLH轉(zhuǎn)錄因子(JAM1、JAM2和JAM3),并分別對(duì)其基因進(jìn)行過(guò)表達(dá),結(jié)果發(fā)現(xiàn)轉(zhuǎn)基因植株均表現(xiàn)出雄蕊育性降低,暗示這3個(gè)bHLH轉(zhuǎn)錄因子在擬南芥雄蕊發(fā)育中起負(fù)調(diào)控作用。在本研究中,相對(duì)于木薯雄蕾,雌蕾和兩性蕾中的大部分ERF、bHLH和MYB轉(zhuǎn)錄因子均表現(xiàn)上調(diào),尤其是bHLH和MYB類(lèi)轉(zhuǎn)錄因子,上調(diào)表達(dá)基因數(shù)量遠(yuǎn)多于下調(diào)表達(dá)基因數(shù)量;而WRKY轉(zhuǎn)錄因子恰好相反;在雄蕾—雌蕾對(duì)比組中,下調(diào)表達(dá)的轉(zhuǎn)錄因子基因數(shù)量遠(yuǎn)多于上調(diào)表達(dá)的轉(zhuǎn)錄因子基因數(shù)量。由此推測(cè),木薯中的絕大部分ERF、bHLH和MYB轉(zhuǎn)錄因子具有促雌或抑雄功能,而WRKY類(lèi)轉(zhuǎn)錄因子恰好相反,大部分具有抑雌或促雄功能。
4 結(jié)論
木薯不同花性型存在較多的DEGs,其中與生長(zhǎng)素及ERF、bHLH、WRKY和MYB轉(zhuǎn)錄因子相關(guān)的基因均與性別決定密切相關(guān),可能是木薯性別分化的關(guān)鍵調(diào)控基因。
參考文獻(xiàn):
杜改改,孫鵬,索玉靜,韓衛(wèi)娟,刁松鋒,傅建敏,李芳東. 2017. 基于柿雌雄花芽轉(zhuǎn)錄組測(cè)序的SSR和SNP多態(tài)性分析[J]. 中國(guó)農(nóng)業(yè)大學(xué)學(xué)報(bào),22(10):45-55. [Du G G,Sun P,Suo Y J,Han W J,Diao S F,F(xiàn)u J M,Li F D. 2017. SSR and SNP polymorphism analysis based on persimmon (Diospyros kaki) transcriptome[J]. Journal of China Agricultural University,22(10):45-55.]
賈翠玲,侯和勝. 2010. 植物WRKY轉(zhuǎn)錄因子的結(jié)構(gòu)特點(diǎn)及其在植物防衛(wèi)反應(yīng)中的作用[J]. 天津農(nóng)業(yè)科學(xué),16(2):21-26. [Jia C L,Hou H S. 2010. Structure of plant WRKY transcription factors and their roles in plant defense responses[J]. Tianjin Agricultural Scriences,16(2):21-26.]
賈慧敏. 2016. 楊梅全基因組測(cè)序和雌雄性別控制遺傳分析[D]. 杭州:浙江大學(xué). [Jia H M. 2016. The draft genome of Chinese bayberry(M. rubra) and genetic analysis of sex determination between male and female plants[D]. Hangzhou:Zhejiang University.]
焦曉博,羅堯幸,趙偉,劉榕晨,李雪雪,紀(jì)薇. 2018. 葡萄MYB基因家族及其對(duì)花器官性別分化調(diào)控的分析[J]. 山西農(nóng)業(yè)大學(xué)學(xué)報(bào)(自然科學(xué)版),38(5):23-32. [Jiao X B,Luo Y X,Zhao W,Liu R C,Li X X,Ji W. 2018. Analysis of grape MYB gene family and its regulation on sex differentiation of flower organs[J]. Journal of Shanxi Agri-cultural University(Natural Science Edition),38(5):23-32.]
劉孟,乜蘭春,王珊珊,胡淑明. 2016. 蘆筍三種花蕾性別分化相關(guān)差異蛋白表達(dá)分析[J]. 中國(guó)農(nóng)業(yè)科學(xué),49(21):192-4202. [Liu M,Nie L C,Wang S S,Hu S M. 2016. Expression analysis of aifferential proteins in three kinds of flower buds with sex differentiation of asparagus[J]. Scien-tia Agricultura Sinica,49(21):4192-4202.]
毛穎基. 2017. 油桐花發(fā)育及其性別決定機(jī)制研究[D]. 合肥:中國(guó)科學(xué)技術(shù)大學(xué). [Mao Y J. 2017. The floral development and sex determination mechanism of vernicia fordii[D]. Hefei:University of Science and Technology of China.]
彭向永. 2017. 雌、雄蒿柳花芽分化機(jī)制及性別決定基因挖掘[D]. 北京:中國(guó)林業(yè)科學(xué)研究院. [Peng X Y. 2017. Mechanism of floral bud differentiation and discovery of sex determination genes in male and female Salix viminalis[D]. Beijing:Chinese Academy of Forestry.]
秦力. 2016. 蘆筍雌雄花發(fā)育轉(zhuǎn)錄組分析及性別決定相關(guān)miRNA靶基因的鑒定[D]. 杭州:浙江大學(xué). [Qin L. 2016. Comparative transcriptome analysis of male and female flowers and identification of gender-related miRNA targets in Asparagus officinalis L[D]. Hangzhou:Zhejiang University.]
盛云燕,劉識(shí),李文濱,欒非時(shí). 2012. 與甜瓜性別分化相關(guān)植物激素生物合成途徑分析[J]. 農(nóng)業(yè)生物技術(shù)學(xué)報(bào),20(7):791-798. [Sheng Y Y,Liu S,Li W B,Luan F S. 2012. Hormone pathway analysis related to sex determination in melon(Cucumismelo L.)[J]. Journal of Agricultural Biotechnology,20(7):791-798.]
韋麗君,俞奔馳,呂平,檀小輝,雷開(kāi)文,馬崇熙,盧賽清,唐玉娟. 2020. 木薯葉芽和花芽的轉(zhuǎn)錄組差異分析[J]. 分子植物育種,18(7):2108-2117. [Wei L J,Yu B C,Lü P,Tan X H,Lei K W,Ma C X,Lu S Q,Tang Y J. 2020. Transcriptome difference analysis of cassava(Mahihot esculehta) leaf bud and flower bud[J]. Molecular Plant Breeding,18(7):2108-2117.
肖楓. 2019. 皺葉膏桐成花相關(guān)基因的克隆及分析[D]. 貴陽(yáng):貴州大學(xué). [Xiao F. 2019. Cloning and analysis of genes related to flowering of Jatropha nigroviensrugosus[D]. Guiyang:GuiZhou University.]
薛麗君. 2015. 苧麻性別分化相關(guān)基因的克隆、表達(dá)及遺傳轉(zhuǎn)化研究[D]. 長(zhǎng)沙:湖南農(nóng)業(yè)大學(xué). [Xue L J. 2015. Clo-ning,expression and genetic transformation of genes rela-ted to sex differention in ramie[D]. Changsha:Hunan Agricultural University.]
閆春冬. 2018. 南瓜性別分化轉(zhuǎn)錄組及差異表達(dá)基因分析[D]. 哈爾濱:東北農(nóng)業(yè)大學(xué). [Yan C D. 2018. Sex di-fferentiation transcriptome and differentially expressed genes analysis in pumpkin[D]. Harbin:Northeast Agricultural University.]
閆明科,徐強(qiáng),劉春燕,張瓊,姚小洪. 2015. 基于microRNA深度測(cè)序的獼猴桃性別分化初探[J]. 園藝學(xué)報(bào),42(7):1260-1272. [Yan M K,Xu Q,Liu C Y,Zhang Q,Yao X H. 2015. Preliminary investigation on sex differentiation of Actinidia chinensis by high-throughput microRNAs sequencing[J]. Acta Horticulturae Sinica,42(7):1260-1272.]
俞奔馳,韋麗君,李軍,田益農(nóng),盧賽清. 2017. 木薯兩性花及其種子的形態(tài)特征[J]. 植物學(xué)報(bào),52(2):175-178. [Yu B C,Wei L J,Li J,Tian Y N,Lu S Q. 2017. Morphological characteristics of bisexual flowers and seeds in cassava[J]. Bulletin of Botany,52(2):175-178.]
俞奔馳,羅燕春,李軍,黃強(qiáng),盤(pán)歡,鄭華,文峰,付海天,陳顯雙,馬崇熙,田益農(nóng). 2014. 一種木薯開(kāi)花調(diào)控技術(shù).中國(guó)[P]. CN103733859A. [Yu B C,Luo Y C,Li J,Huang Q,Pan H,Zheng H,Wen F,F(xiàn)u H T,Chen X S,Ma C X,Tian Y N. 2014. Flowering induction technology of cassava. China[P]. CN103733859A.]
周大顏,張志新,黃彩林,招志杰,莫飛龍. 2019. 3種白鯽雜交子代的轉(zhuǎn)錄組學(xué)分析[J]. 南方農(nóng)業(yè)學(xué)報(bào),50(6):1328-1338. [Zhou D Y,Zhang Z X,Huang C L,Zhao Z J,Mo F L. 2019. Transcriptomic analysis of three Carassius auratus cuvieri hybrids[J]. Journal of Southern Agriculture,50(6):1328-1338.]
張加強(qiáng),史小華,劉慧春,馬廣瑩,鄒清成,朱開(kāi)元,周江華,毛軍銘. 2018. 基于轉(zhuǎn)錄組學(xué)的不同色系蝴蝶蘭花色苷差異積累分析[J]. 分子植物育種,16(14):4530-4542. [Zhang J Q,Shi X H,Liu H C,Ma G Y,Zou Q C,Zhu K Y,Zhou J H,Mao J M. 2018. Study on the differential accumulation of anthocyanin in different-colored phalaenopsis based on transcriptomics[J]. Molecular Plant Bree-ding,16(14):4530-4542.]
Chen L N,Zhang J,Li H X,Niu J,Xue H,Liu B B,Wang Q,Luo X,Zhang F H,Zhao D G,Cao S Y. 2017. Transcriptomic analysis reveals candidate genes for female sterility in pomegranate flowers[J]. Front Plant science,8:1430. doi:10.3389/fpls.2017.01430. eCollection 2017.
Dewitte W,Scofield S,Alcasabas A A,Maughan S C,Menges M,Braun N,Collins C,Nieuwland J,Prinsen E,Sundaresan V,Murray J A H. 2007. Arabidopsis CYCD3 D-type cyclins link cell proliferation and endocycles and are rate-limiting for cytokinin responses[J]. Proceedings of the National Academy of Sciences of the United States of America,104(36):14537-14542.
Heikrjam M,Sharma K,Prasad M,Agrawal-Euphytica V. 2015. Review on different mechanisms of sex determination and sex-linked molecular markers in dioecious crops;a current update[J]. Euphytica,201(2):161-194.
Higginson T,Li S F,Parish R W. 2003. AtMYB103 regulates tapetum and trichome development in arabidapsis thaliana[J]. Plant Journal for Cell & Molecular Biology,35(2):177-192.
Jofuku K D,Den Boer B G,van Montagu M,Okamuro J K. 1994. Control of Arabidopsis flower and seed development by the homeotic gene APETALA2[J]. The Plant Cell,6(9):1211-1225.
Leng N,Dawson J A,Thomson J A,Ruotti V,Rissman A I,Smits B M G,Haag J D,Gould M N,Stewart R M,Kendziorski C. 2013. EBSeq:An empirical bayes hierarchical model for inference in RNA-seq experiments[J]. Bioinformatics,29(8):1035-1043.
Mason M G,Mathews D E,Argyros D A,Maxwell B B,Kieber J J,Alonso J M,Schaller G E. 2005. Multiple type-B response regulators mediate cytokinin signal transduction in Arabidopsis[J]. The Plant Cell,17(11):3007-3018.
McAdam S A,Brodribb T J,Banks J A,Hedrich R,Atallah N M,Cai C,Geiger D. 2016. Abscisic acid-controlled sex before transpiration in vascular plants[J]. Proceedings of the National Academy of Sciences of the United States of America,113(45):12862-12867.
Nakata M,Mitsuda N,Herde M,Koo A J K,Moreno J E,Suzuki K,Howe G A,Ohme-Takagi M. 2013a. A bHLH-type transcription factor,ABA-INDUCIBLE BHLH-TYPE TRANSCRIPTION FACTOR/JA-ASSOCIATED MYC2-LIKE1,acts as a repressor to negatively regulate jasmonate signaling in Arabidopsis[J]. The Plant Cell,25(5):1641-1656.
Nakata M,Ohme-Takagi M. 2013b. Two bHLH-type transcription factors,JA-ASSOCIATED MYC2-LIKE2 and JAM3,are transcriptional repressors and affect male fertility[J]. Plant Signaling & Behavior,8(12):e26473.
Pan B Z,Chen M S,Jun N,Xu Z. 2014. Transcriptome of the inflorescence meristems of the biofuel plant Jatropha curcas treated with cytokinin[J]. BMC Genomics,15:974. doi:10.1186/1471-2164-15-974.
Serra T S,F(xiàn)igueiredo D D,Cordeiro A M,Almeida D M,Louren?o T,Abreu I A,Sebastián A,F(xiàn)ernandes L,Contreras-Moreira B,Oliveira M M,Saibo N J. 2013. OsRMC,a negative regulator of salt stress response in rice,is regulated by two AP2/ERF transcription factors[J]. Plant Molecular Biology,82(4-5):439-455.
Shogo I,Song Y H,Josephson-Day A R,Miller R J,Breton G,Olmstead R G,Imaizumi T. 2012. Flowering bHLH transcriptional activators control expression of the photoperiodic flowering regulator constans in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,109(9):3582-3587.
To J P,Kieber J J. 2008. Cytokinin signaling:Two-components and more[J]. Trends in Plant Science,13(2):85-92.
Tao Q Y,Niu H H,Wang Z Y,Zhang W H,Wang H,Wang S H,Zhang X,Li Z. 2018. Ethylene responsive factor ERF110 mediates ethylene-regulated transcription of a sex determination-related orthologous gene in two Cucumis species[J]. Journal of Experimental Botany,69(12):2953-2965.
(責(zé)任編輯 陳 燕)
收稿日期:2020-02-25
基金項(xiàng)目:廣西自然科學(xué)基金項(xiàng)目(2017GXNSFBA198172);廣西科技計(jì)劃項(xiàng)目(桂科AB1850037);國(guó)家現(xiàn)代農(nóng)業(yè)產(chǎn)業(yè)技術(shù)體系建設(shè)專(zhuān)項(xiàng)(CARS-11)
作者簡(jiǎn)介:*為通訊作者,俞奔馳(1973-),高級(jí)農(nóng)藝師,主要從事木薯育種研究工作,E-mail:yubenchi@126.com。韋麗君(1979-),博士,高級(jí)農(nóng)藝師,主要從事木薯分子生物學(xué)及育種研究工作,E-mail:215377275@qq.com
優(yōu) 秀 青 年 學(xué) 者 論 壇
韋麗君(1979-),博士,高級(jí)農(nóng)藝師,主要從事木薯分子生物學(xué)及育種研究工作。主持有廣西重點(diǎn)研發(fā)計(jì)劃項(xiàng)目“基于開(kāi)花調(diào)控的木薯兩性花育種新技術(shù)的應(yīng)用與示范”、廣西自然科學(xué)基金項(xiàng)目“基于EST數(shù)據(jù)的木薯成花預(yù)測(cè)與分析”和廣西亞熱帶作物研究所專(zhuān)項(xiàng)“涼蔗基因組SNP標(biāo)記的開(kāi)發(fā)與應(yīng)用研究”等科研項(xiàng)目;作為主要成員參與省部級(jí)項(xiàng)目“木薯特異種質(zhì)資源的引進(jìn)與利用研究”“木薯花藥離體培養(yǎng)技術(shù)研究”及“秋水仙素誘導(dǎo)木薯多倍體的研究”等20余項(xiàng)。獲授權(quán)國(guó)家發(fā)明專(zhuān)利4項(xiàng)、實(shí)用新型專(zhuān)利3項(xiàng),參與選育(認(rèn)定)作物新品種4個(gè);在《植物學(xué)報(bào)》《植物生理學(xué)報(bào)》《南方農(nóng)業(yè)學(xué)報(bào)》《西北植物學(xué)報(bào)》等期刊上合著發(fā)表學(xué)術(shù)論文48篇,其中第一作者或通訊作者18篇。

