少見細胞色素P450 2C9 等位基因對中國漢族心房顫動患者華法林穩態劑量的影響及預測模型的構建
華法林是目前臨床應用最廣泛的口服抗凝藥[1-2],其臨床證據堅實充分,適應證廣泛,且經濟、易于拮抗;然而,其缺點也顯而易見,如治療窗窄、穩態劑量個體差異大且易與多種藥物發生相互作用等[1]。不當的給藥劑量可能會導致嚴重出血事件發生[3]。因此應用華法林時需要頻繁監測國際標準化比值(INR)來調整劑量,以達到最佳的抗凝效果。許多遺傳和臨床因素與華法林穩態劑量的變異性相關[4]。大量研究已經證實,基因多態性,主要包括細胞色素P4502C9(CYP2C9)和維生素K 環氧化物還原酶復合體1(VKORC1)相關的突變在華法林穩態劑量變異性中起到重要作用[5-7]。
VKORC1的幾種單核苷酸多態性位點(rs7196161,rs9923231,rs9934438,rs8050894和rs2359612)存在高度連鎖不平衡[5]。其中,VKORC1-1639G/A(rs9923231)是重要的基因多態性位點。與此同時,迄今已發現62種CYP2C9等位基因,CYP2C9等位基因在不同人群中的分布存在明顯差異[7]。CYP2C9*3 為亞洲人群最常見的突變類型,而CYP2C9*2 則極為罕見[8]。近年來在漢族人群發現了多種少見CYP2C9基因突變型,如CYP2C9*13、*16、*36、*39、*43、*45、*60 等,其基因頻率與CYP2C9*2 相當,而其功能表達——CYP2C9 酶的活性在體外和體內實驗中被證明較野生型明顯降低[9-11]。繼而可能對臨床患者的華法林穩態劑量產生潛在影響。現有的華法林穩態劑量預測模型中CYP2C9基因多僅納入CYP2C9*2 和CYP2C9*3 突變作為變量[4,12-14]。基因的異質性使得源自其他種族得出的華法林穩態劑量模型無法有效地適用于中國漢族人群。本研究基于漢族人群CYP2C9等位基因分布特點,結合其他遺傳和非遺傳因素,建立華法林穩態劑量模型,探究除CYP2C9*2 和CYP2C9*3以外的少見CYP2C9等位基因對中國漢族心房顫動(房顫)患者華法林穩態劑量的影響。
1 資料與方法
選取2011 年1 月至2017 年3 月于北京醫院就診的中國漢族房顫患者681 例。入選標準:年齡≥18 歲,滿足抗凝治療適應證,同意接受華法林抗凝治療≥3 個月。排除標準:血壓≥170/110 mmHg(1 mmHg=0.133 kPa),合并活動性出血,凝血功能異常、惡性腫瘤以及合并妊娠。隨機將所納入樣本以2:1 的比例分為建模組(n=454)和驗證組(n=227),詳細記錄患者統計學及臨床資料,包括:年齡、性別、身高、體重、吸煙情況、血肌酐水平、合并用藥情況(他汀類藥物、胺碘酮);以及華法林穩態劑量:即在啟動口服華法林治療≥7 d 后,在華法林周給藥劑量不變的情況下,患者至少連續2 次(間隔至少7~14 d)血INR 處于目標范圍(2.0~3.0)時患者口服華法林的平均日劑量值(mg/d,即周劑量/7 d)[4]。本研究獲得北京醫院倫理委員會批準。全部患者簽署知情同意書。
主要試劑:DNA 聚合酶及擴增緩沖液(TakaRa公司,日本);DNA 相對分子質量梯度標準Marker(TakaRa 公司,日本);PCR 擴增引物(北京天一輝遠生物工程公司);E.Z.N.A 凝膠回收試劑盒(Omega Biotek 公司,美國);DTCS QuickStart DNA 測序試劑盒(Beckman Coulter 公司,美國);蝦堿性磷酸酶(Promega 公司,美國);核酸外切酶I(NEB 公司,美國);重組凝血酶原試劑(IL 公司,意大利)。
主要儀器:ABI-9700 型PCR 儀(ABI 公司,美國);電泳儀及水平電泳槽(北京市六一儀器公司)、凝膠成像系統(上海復日公司)、CEQTM8000 測序儀(Beckman Coulter 公司,美國)、UV200 紫外分光光度儀(島津公司,日本)。
DNA 的提取:收集每例患者外周靜脈血2 ml,以乙二胺四乙酸(EDTA)抗凝,采用鹽析法提取基因組DNA,置于-20 ℃冰箱內保存。根據人CYP2C9和VKORC1已知基因組序列及基因多態性,參照相關文獻,采用聚丙烯酰胺凝膠電泳(PAGE)回收純化方式,由北京天一輝遠生物工程公司合成擴增用引物和測序用引物。擴增引物序列見表1。

表1 CYP2C9 和VKORC1 基因擴增引物序列
PCR 擴增:采用50 μl 的反應體系,內含:2×Taqmix(包括緩沖液、DNA 聚合酶、脫氧核糖核苷三磷酸)25 μl,100 ng 的基因組DNA 以及0.2 μmol/L 的上、下游引物,加雙蒸水(ddH2O)定容至50 μl。PCR 擴增循環參數如下:95℃預變性5 min,94℃變性30 s,60℃退火30 s,72℃延伸30 s,35個循環后再延伸5 min。PCR 產物用0.8%瓊脂糖凝膠電泳進行檢測,驗證擴增產物。
DNA 產物測序分析:取PCR 擴增產物5 μl,與4.8 U 蝦堿性磷酸酶及1.5 U 核酸外切酶Ⅰ混合,于37℃反應30 min,后85℃維持20 min。將純化后的測序產物放入CEQTM8000DNA 測序儀,輸出測序結果經DNAstar6.0 和Chromas 軟件進行分析。
統計學方法:所有數據用SPSS 25.0 軟件分析。采用直接計數法計算各等位基因和基因型頻率,χ2檢驗確定是否符合Hardy-Weinberg 遺傳平衡定律。計量資料用均值±標準差()表示,計數資料用百分比(%)表示。主要參數均進行正態性檢驗,如不服從正態分布,則進行自然對數轉換后再進行正態性檢驗;如仍不符合正態分布則采用非參數檢驗。各組間等位因與基因型頻率的比較采用χ2檢驗。組間華法林劑量平均值比較采用獨立樣本t檢驗,計量資料與華法林劑量的相關性采用Pearson 相關性分析。采用單因素線性回歸分析篩選與華法林穩態劑量相關的遺傳和臨床變量,進行多元線性回歸分析,建立預測方程。P<0.05 為差異有統計學意義。
2 結果
2.1 研究對象基線特征(表2)
681 例患者中男性458 例,女性223 例,平均年齡(68.0±10.2)歲。用藥情況方面,單獨應用華法林403 例(59.2%),合并使用華法林和他汀類藥物120 例(17.6%),合并使用華法林和胺碘酮122例(17.9%),合并使用華法林、他汀類藥物和胺碘酮36 例(5.3%)。華法林穩態劑量范圍為0.50~9.00 mg/d,平均穩態劑量為(3.34±1.18)mg/d。
2.2 CYP2C9 和VKORC1-1639 基因多態性對華法林穩態劑量的影響
經檢驗,研究人群CYP2C9和VKORC1-1639等位基因及基因型頻率分布符合Hardy-Weinberg 平衡定律,具有群體代表性。
CYP2C9*1/*3 是研究群體中最常見CYP2C9的突變基因型,占9.3%,攜帶者平均華法林穩態劑量為(2.30±0.88)mg/d,顯著低于野生型CYP2C9*1/*1[(3.47±1.13)mg/d,P<0.001]。CYP2C9*1/*2 和CYP2C9*3/*3 基因型攜帶者各1例,穩態劑量分別為2.50 mg/d 和0.50 mg/d。除CYP2C9*2 和CYP2C9*3 以外,本研究發現了6 種少見CYP2C9等位基因突變,包括CYP2C9*7、*13、*16、*29、*33、*16,均為雜合子,基因型頻率為0.92%。其中3 種突變(CYP2C9*13、*16、*60)攜帶者的臨床和藥物遺傳學信息被完整獲取。這三種其他少見基因型CYP2C9*1/*13、CYP2C9*1/*16、CYP2C9*1/*60 平均華法林穩態劑量分別為(1.88±0.53) mg/d、1.39 mg/d、(1.00±0.35)mg/d,均低于CYP2C9*1/*1 及CYP2C9*1/*3 均值(P均<0.05)。將CYP2C9*1/*13、*16、*60 合并為變量CYP2C9(13/16/60),平均華法林穩態劑量為(1.42±0.54)mg/d,顯著低于CYP2C9*1/*1(P<0.001)及CYP2C9*1/*3(P<0.05)。
對VKORC1-1639G/A 基因突變位點進行檢測,AA 是主要的基因型,占總樣本數的78.7%,GA 雜合子占總樣本數的19.1%,GG 純合子占總數的2.2%。AA 組華法林穩態劑量最低,為(3.07±0.87)mg/d,顯著低于 GA 組[(4.27±1.37)mg/d]和GG 組[(5.59±1.84)mg/d],差異均有統計學意義(P均<0.001)。
2.3 CYP2C9 和VKORC1-1639 不同基因型組合對華法林穩態劑量的影響(表3)
將樣本人群按照CYP2C9與VKORC1-1639G/A不同基因型組合進行分組,可以發現野生型基因型組合CYP2C9*1/*1 +VKORC1-1639AA 最為常見,占69.5%,平均華法林穩態劑量為(3.18±0.82)mg/d。各基因型組合穩態劑量與野生型組合相比較后的P值見表3。對于特定的CYP2C9基因型,華法林穩態劑量均值由VKORC1-1639AA 基因型至GA 型至GG 型逐漸升高。而對于特定的VKORC1-1639AA 基因型,CYP2C9突變型[*1/*3、*3/*3、CYP2C9(13/16/60)]的穩態劑量均值均低于野生型CYP2C9*1/*1(P均<0.01)。
表2 681 例患者的基線特征()
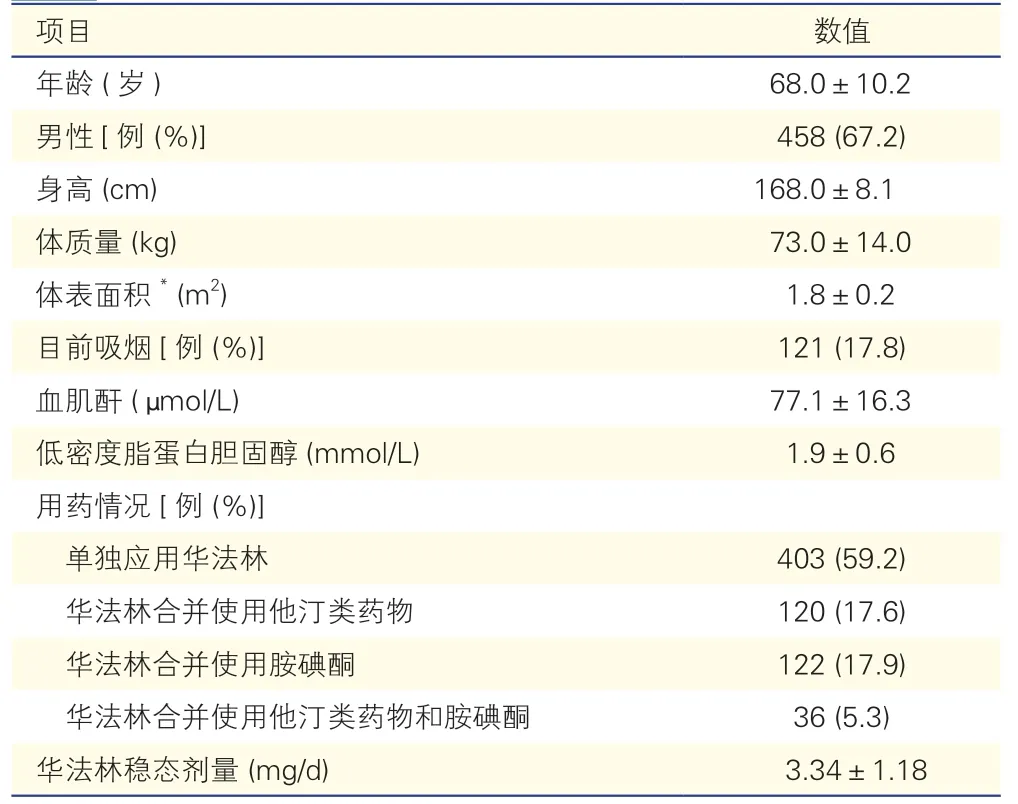
表2 681 例患者的基線特征()
注:*:體表面積計算參照Stevenson's 公式,即:體表面積(m2)=0.0061×身高(cm)+0.0128×體質量(kg)-0.1529
表3 681 例患者不同基因型組合華法林穩態劑量情況()

表3 681 例患者不同基因型組合華法林穩態劑量情況()
注:CYP2C9:細胞色素P450 2C9;VKORC1:維生素K 環氧化物還原酶復合體1。與CYP2C9*1/*1+VKORC1-1639AA 比△P<0.01
2.4 公式建立
對建模組454 例患者的遺傳和非遺傳變量進行單因素回歸分析,其中體表面積、合并使用胺碘酮、CYP2C9*3、CYP2C9(13/16/60)、VKORC1-1639GA、VKORC1-1639GG 均被發現與華法林穩態劑量相關(P均<0.001)。其中,胺碘酮、CYP2C9*3、CYP2C9(13/16/60)與華法林穩態劑量之間呈負相關;體表面積、VKORC1-1639GA,VKORC1-1639GG 這3 個變量則與華法林穩態劑量呈顯著性正相關。其余變量經初步分析與華法林穩態劑量之間的相關性均不顯著(P均>0.05)。將上述6 個變量進一步納入多元回歸模型,進行分步回歸分析,建立華法林穩態劑量預測模型,得到回歸方程:華法林日劑量=exp[0.524+0.344×體表面積-0.082×胺碘酮-0.393×CYP2C9*3-0.740×CYP2C9(13/16/60)+0.276×VKORC1-1639GA+0.593×VKORC1-1639GG]R2=44.3%。本模型預測權重達44.3%,遺傳因素的總預測權重達39.6%。由表4 可見,CYP2C9*3 是最重要的預測因子,可解釋15.8%的劑量差異,而CYP2C9(13/16/60)占總基因頻率的0.7%,可以解釋6.3%的華法林劑量個體差異,VKORC1-1639G/A 共可解釋17.5%的華法林穩態劑量個體差異。

表4 華法林穩態劑量多元線性回歸模型
2.5 模型的驗證
將驗證組的227 例患者的臨床及遺傳信息代入本研究所建立的華法林穩態劑量預測模型,進行Pearson 相關性分析(圖1)。本研究建立模型得到的相關系數r=0.567,其中55.5%的樣本預測劑量與實際劑量的偏差小于20%。
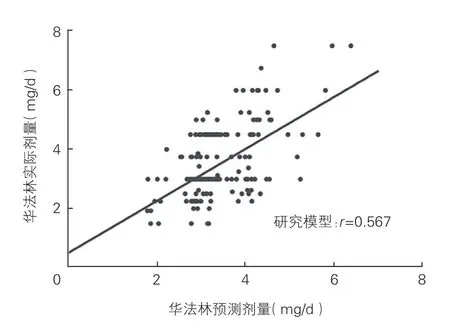
圖1 驗證組中華法林預測劑量與實際劑量關系
3 討論
CYP2C9所編碼的細胞色素P450 酶是更具藥理活性的S-華法林消旋體代謝的關鍵酶。目前已發現62 種CYP2C9等位基因,CYP2C9等位基因在不同人群中的分布有著明顯差異[7]。CYP2C9*3 是亞洲人群中最常見的等位基因突變,基因頻率為2%~8%,而CYP2C9*2 則極為罕見[8]。本研究中CYP2C9*3 和CYP2C9*2 的基因頻率與既往國內報道的基因頻率相當[14-15]。CYP2C9基因多態性在華法林穩態劑量個體差異中發揮著重要的作用,本研究中CYP2C9*3 是最重要的遺傳預測變量,其可解釋約15.8%華法林穩態劑量變異性。
近年來,除CYP2C9*2 和CYP2C9*3 以外的少見CYP2C9基因型在華法林穩態劑量中的影響越來越受到重視。CYP2C9*5、*6、*8、*11 是其中研究最多的少見CYP2C9突變基因,并與低華法林穩態劑量密切相關[16-17]。它們在非洲人群中最為常見,基因頻率可高達約8%~10%,但在東亞人群中卻極為罕見[8,18]。在一項研究中,將少見基因突變CYP2C9*5、*6、*8、*11 納入華法林穩態劑量預測模型,可增加了6%的華法林穩態劑量預測權重[19]。基于上述證據,2017 年臨床藥物基因組學實施聯盟(CPIC)指南推薦,對于CYP2C9*5、*6、*8、*11 基因突變的攜帶者,應下調其初始華法林劑量15%~30%[1]。
目前國內尚未有將除CYP2C9*2 和CYP2C9*3以外的少見CYP2C9等位基因作為變量納入華法林穩態劑量預測模型的報道。本研究共發現了CYP2C9*7、*13、*16、*29、*33、*60 共6 種少見CYP2C9等位基因,均為雜合子,上述突變基因頻率均與CYP2C9*2 相當。國內2013~2015 年發表的幾項研究[8-11],建立了漢族人群中最大的CYP2C9等位基因數據庫,發現了除CYP2C9*2 和CYP2C9*3 以外的36 種CYP2C9等位基因,總等位基因頻率達2.44%,其中27 種等位基因在體外實驗中代謝活性較野生型明顯降低,包括本研究中發現的CYP2C9*13、*16 和*60。CYP2C9*13 在2004 年首次于中國漢族人群中發現[20],是中國人群中較為常見的少見CYP2C9等位基因,基因頻率達0.16%~0.70%[8,21]。多項體內和體外實驗已經證明,CYP2C9*13 與更低的藥物代謝活性相關[22-23]。此外臨床上也發現帶有CYP2C9*13 等位基因的個體有著更低華法林劑量需求[24]。CYP2C9*16 最早于2004 年在東南亞人群中被發現[25]。戴大鵬等[8]2013年的研究報道,CYP2C9*16 在漢族人群基因頻率為0.19%。體內和體外實驗也已經證明,CYP2C9*16與更低的藥物代謝活性相關[9,15,26]。CYP2C9*60 首次于2015 年在對1 例極低華法林穩態劑量患者的研究中被發現,后續的體內和體外實驗證明,它與更低的藥物代謝活性相關[11]。本研究中6 種其他少見CYP2C9等位基因總基因型頻率約為0.92%,低于戴大鵬等的報道。其中3 種少見基因突變(CYP2C9*13、*16、*60)攜帶者的臨床和遺傳信息被完整獲取,并證實相關突變與低的華法林穩態劑量相關。根據漢族人群中CYP2C9等位基因特點,綜合CYP2C9*13、*16、*60 三種少見基因型,我們建立了變量CYP2C9(13/16/60),平均穩態劑量顯著低于CYP2C9*1/*1(P<0.001)及CYP2C9*1/*3(P<0.05)。這可能預示攜帶這些等位基因的患者有著更低的華法林劑量需求,按常規劑量給藥可能會導致出血風險增高。CYP2C9(13/16/60)基因型頻率共占0.7%,但可以解釋6.3%的華法林劑量個體差異。盡管少見CYP2C9等位基因的基因頻率較少,但考慮到中國有著約13 億漢族人口,以及它們對華法林穩態劑量的顯著影響,研究少見CYP2C9等位基因對華法林穩態劑量的影響對指導中國漢族房顫患者華法林個體化給藥具有重要的意義。
VKORC1所編碼的維生素K 環氧化物是維生素K 循環的關鍵酶和華法林作用的靶點[5]。rs9923231(-1639G>A)是常見的VKORC1基因多態性。VKORC1基因多態性與種族相關,亞洲人群中AA 基因型頻率最高達86%,其次是歐洲人達37%,最低是非洲人達10%[5-6];而GG、GA 與更高的華法林穩態劑量相關[5]。這可能是亞洲人華法林穩態劑量較低的部分原因。本研究證實了以上發現,VKORC1-1639G/A 共可解釋17.5%的華法林穩態劑量個體差異。本研究所建立模型中遺傳因素的總預測權重達39.6%。
臨床因素中,體表面積及胺碘酮的使用被納入模型,其中體表面積與華法林穩態劑量呈正相關,而合并使用胺碘酮與華法林穩態劑量呈負相關。研究表明,胺碘酮及其代謝產物可能通過抑制CYP2C9 酶系統,減少華法林的代謝,從而降低華法林的穩態劑量[27]。
本研究納入了681 例服用華法林預防血栓事件并達到穩態劑量的患者。基于藥物因組學、人口統計學和臨床資料,使用逐步回歸分析,在漢族人群中首次將除CYP2C9*2 和CYP2C9*3 以外的其他少見CYP2C9基因突變作為變量,建立中國北方漢族房顫患者華法林穩態劑量預測模型,預測權重達44.3%。將得到的模型應用于驗證組,結果優于國內外IWPC 模型[4]、Gage 模型[12]、Ohno 模型[13]和Miao 模型[14]。新模型未來如推廣到臨床,在指導和預測華法林的給藥劑量、縮短INR 達標時間以及降低華法林過量風險等方面可能較現有的模型更具優勢,當然這還需要進一步前瞻性臨床試驗的證實。
局限性:(1)發現少見CYP2C9基因例數較少,據此建立的模型方程難免存在偏倚,仍有待于進一步擴大樣本量,把更多其他少見CYP2C9基因納入模型,優化方程,探究對華法林穩態劑量的影響。(2)遺傳因素僅納入了CYP2C9和VKORC1基因,而近年來研究發現,其他遺傳因素如CYP4F2、CYP2C19、GGCX、EPHX1、CALU等也與華法林穩態劑量相關[1,28-29]。(3)臨床因素中僅有體表面積和胺碘酮的使用被納入模型,預測權重低于國內外其他研究模型[12-14],以后還可以通過優化樣本結構、豐富更多的臨床信息,進一步完善模型。(4)本研究屬于回顧性研究,其結果還需要前瞻性研究進行驗證。
利益沖突:所有作者均聲明不存在利益沖突

