胃癌相關基因及靶向治療的研究進展
王永云,靳文,俞蘭
(1.內蒙古醫科大學研究生學院,呼和浩特 010000; 2.內蒙古自治區人民醫院臨床醫學研究中心,呼和浩特 010000)
據統計,胃癌居全球惡性腫瘤發病率的第五位,死亡率居第三位,在亞洲胃癌死亡率僅次于肺癌[1]。我國為胃癌高發國家,世界衛生組織統計顯示,2018年全球胃癌的發病例數已超103萬,我國占44%;總死亡人數逾78萬,約一半為中國人[2]。近年來胃癌的發病率逐年升高,社會負擔和衛生經濟支出負擔也隨之加重。手術結合放化療是目前治療胃癌的主要方法,但因胃癌早期癥狀隱匿,確診時多處于中晚期,5年生存率仍不足20%[3]。對化療藥物的普遍耐藥也是導致療效欠佳的主要原因之一[1]。精準醫療是腫瘤診斷和治療的一種新模式,已被廣泛應用于醫學的各個領域。目前基于基因的靶向治療應用逐漸增多,致癌、抑癌基因在胃癌的靶向治療中發揮著重要作用。現就當前胃癌致癌和抑癌基因的國內外研究現狀進行總結,便于進一步探索胃癌的有效靶向治療方法。
1 胃癌中關鍵致癌基因及其靶向治療
1.1人表皮生長因子受體(human epidermal growth factor receptor,HER)-2 HER-2定位于17q21,突變率為6.1%~23.0%[4-5]。HER-2的表達升高可激活下游信號通路磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)/哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和促分裂原活化的蛋白激酶(mitogen activated protein kinase,MAPK)途徑,抑制腫瘤細胞凋亡、促進腫瘤血管再生、增強腫瘤細胞的侵襲力[6]。臨床研究顯示,HER-2在發生遠處轉移、Lauren分型為腸型以及中高分化的胃腺癌患者中陽性率更高,與患者的年齡、腫瘤大小及位置無關[7]。HER-2是受體酪氨酸激酶家族的重要成員之一,而酪氨酸激酶抑制劑在胃癌個體化治療中有重要作用,可能是胃癌靶向治療中潛力較大的靶向基因之一[7-8]。
曲妥珠單抗是目前針對HER-2陽性胃癌患者的靶向藥物,旨在干擾HER-2調控的信號通路,介導免疫反應,抑制血管生成和腫瘤細胞增殖力。應用曲妥珠單抗后HER-2表達明顯降低,但HER-2陽性細胞不能完全消失,因此不能徹底根除腫瘤。為提高治療效果,有學者采用曲妥珠單抗與化療方案聯合的治療方式,結果顯示,曲妥珠單抗與伊立替康+順鉑方案聯合可降低糖類抗原125、癌胚抗原和特異性組織多肽抗原的水平;曲妥珠單抗聯合多西他賽+替吉奧膠囊方案可降低血清糖類抗原724、糖類抗原199、癌胚抗原的水平;曲妥珠單抗聯合奧沙利鉑+亞葉酸鈣+5-氟尿嘧啶方案可明顯提高行為狀態評分,并增強近期化療的療效[9-11]。上述三種方案均可提高胃癌患者的生存質量,療效更佳。
隨著曲妥珠單抗的廣泛應用,耐藥問題也隨之產生。Riccio等[12]研究發現,T細胞招募雙特異性抗體衍生物可以識別并結合兩種及以上不同的抗原,對腫瘤細胞的毒性大幅增加;對曲妥珠單抗的耐藥細胞也有效,可解決曲妥珠單抗的耐藥性問題;還可降低心臟毒性等不良反應。Kubota等[13]利用金納米粒子(gold nanoparticl,AuNPs)構建靶向HER-2的AuNPs(T-AuNPs),并在耐藥細胞株MKN7上證明T-AuNPs抗瘤能力明顯強于曲妥珠單抗。Shi等[14]指出,曲妥珠單抗發生耐藥的機制是神經調節蛋白1激活HER4-Yes相關蛋白1軸,促進Yes相關蛋白1表達,最終誘導上皮-間充質轉化(epithelial mesenchymal transformation,EMT)發生。因此,干擾HER4-YAP1軸將有效降低耐藥的發生。上述研究思路為胃癌治療提供了新方法,為解決曲妥珠單抗耐藥性問題提供了新策略。
1.2磷脂酰肌醇-3-激酶催化亞單位α(phosphatidylinositol 3-kinase catalytic alpha,PIK3CA) PIK3CA定位于3q26.3,突變率為10%,突變后激活PI3K/Akt通路,抑制細胞凋亡,增強癌細胞的侵襲能力和遠處轉移能力[15]。與其他類型的胃癌相比,PIK3CA在EB病毒相關胃癌中突變明顯升高,并與T分期和腫瘤浸潤程度呈正相關[16]。PIK3CA的突變常發生在第9和20位外顯子,5年生存率分別為0和80%[17]。
mTOR抑制劑(西羅莫司)可阻斷由PIK3CA基因調控的與細胞周期進展和血管生成相關蛋白的翻譯及表達有關的過程;應用西羅莫司后,患者的無進展生存期為1.9個月,總生存期為3.6個月[18]。為延長生存時間,目前已有團隊嘗試采用其他種治療方法。周新科等[19]應用殼聚糖包被PIK3CA 小干擾RNA制備納米粒子,用該粒子處理胃癌細胞后,PIK3CA的表達降低,胃癌細胞侵襲性減弱。同時,You等[20]在SGC-7901細胞中明確了miR-152-5p的作用靶點為PIK3CA-mut-3′非翻譯區,研究顯示miR-152-5p下調PIK3CA的表達、抑制SGC-7901細胞的增殖、遷移、侵襲、EMT及血管生成,并促進細胞凋亡,進而抑制腫瘤的生長和轉移。該結果為PIK3CA突變型胃癌的靶向治療提供了數據基礎。
1.3鼠類肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,KRAS) KRAS定位于12p12.1,是表皮生長因子受體(epidermal growth factor receptor,EGFR)信號通路的下游因子[21]。KRAS突變后可致RAS蛋白非控制性激活。RAS蛋白位于細胞膜內,調控著細胞的生長、增殖、運動、遷移及血管生成,KRAS突變將顯著增加胃癌的侵襲性[22]。KRAS的表達在Lauren分型為腸型及女性胃癌患者中更高,其常見突變位點為G12V、G13D、G12S、G12D和G12A,與其他位點相比,發生在G12V的突變患者生存期較短,預后較差[23]。
聯合應用含Src同源結構域2的蛋白酪氨酸磷酸酶2和促分裂原活化的蛋白激酶激酶(mitogen-activated protein kinase kinase,MEK)抑制劑對野生型KRAS胃食管腫瘤效果顯著[24]。但Choi等[25]認為,長期應用MEK抑制劑易出現耐藥,并增加腫瘤的侵襲力,以c-MET和PI3K/mTOR為靶點的藥物可以解決這一問題。近年來發現一種優于西妥昔單抗或帕尼單抗的新型抗EGFR抗體——GC1118,該新型抗體具有獨特的結合表位,對胃癌的生長抑制較西妥昔單抗更強。研究顯示,無論單獨使用GC1118還是聯合細胞毒性化療藥物,對胃癌的抗瘤作用均強于西妥昔單抗[26]。
1.4Erb-b2受體酪氨酸激酶(Erb-B2 receptor tyrosine kinase,ERBB)3 ERBB3又名HER-3[27],定位于12q13,與ERBB2同屬于EGFR家族,ERBB3通過激活一系列復雜的信號通路如PI3K/Akt和RAS/RAF/MAPK等發揮作用,ERBB3基因作為腫瘤發生的啟動子,與胃癌的侵襲性和預后顯著相關[28]。有研究顯示,ERBB3基因在Lauren分型為腸型的胃癌中呈高表達,說明其可促進腸型胃癌的發生[29]。當ERBB3與ERBB1共過表達時,與腫瘤大小、宏觀特征、腫瘤分化、腫瘤分期、復發顯著相關,并可預測患者的生存情況[30]。
吉非替尼是EGFR-酪氨酸激酶抑制劑的代表性藥物。針對EGFR突變型胃癌,單獨應用吉非替尼治療,僅10%~15%的患者能從中獲益[31]。在細胞水平上,當吉非替尼與ERBB3小干擾RNA共用時能更有效地抑制PI3K/Akt和ERK信號通路,增強吉非替尼的抗瘤活性和敏感性[32]。表明聯合應用多個EGFR受體治療可明顯提高EGFR突變型胃癌的治療效果。
1.5脂肪非典型鈣黏蛋白1(fat atypical cadherin 1,FAT1) FAT1定位于4q35.2,是一種鈣離子依賴性黏附因子,屬于Ⅰ型跨膜蛋白FAT家族,參與調節細胞的生長、遷移和黏附過程,在腫瘤的發生發展中發揮重要作用[33]。FAT1基因在不同腫瘤中的作用不同,在食管癌中FAT1基因作為抑癌基因,而在胃癌中則起致癌作用[33]。研究顯示,FAT1基因主要參與胃癌細胞的侵襲和遷移,且表達量越高,預后越差[34]。
目前在多種胃癌細胞系中檢測到維替泊芬抑制胃癌細胞的生長,但作用機制尚不清楚。研究發現,應用維替泊芬后,遷移相關基因和具有致癌潛能的基因表達下調[25]。因此推測維替泊芬是通過靶向FAT1抑制腫瘤轉移的藥物。
2 胃癌中重要的抑癌基因
2.1腫瘤蛋白p53(tumor protein p53,TP53) TP53定位于17p13,是公認的重要的抑癌基因,被譽為“基因組衛士”[35]。TP53是人類腫瘤中突變最頻繁的基因,近50%的腫瘤發生TP53突變[34]。TP53基因具有調控細胞周期、細胞凋亡和DNA修復等功能。TP53的突變位點集中在R175、G245、R248、R273和R282,其中R248位點突變的胃癌患者預后最差[36]。
TP53可用于胃癌的超早期篩查,并可通過監測細胞游離DNA突變監測胃癌術后的復發情況,也可預測紫杉醇聯合卡培他濱治療晚期胃癌的療效[37-38]。Imanishi等[39]通過研究TP53野生型胃癌發現,TP53可上調致癌基因鼠雙微粒體(murine double minute,MDM)2和MDM4的表達,而自身功能被抑制;當同時敲減MDM2和MDM4時,可阻滯細胞周期G1期向S期進展,并提高5-氟尿嘧啶的抗腫瘤作用。因此,聯合應用MDM2或MDM4抑制劑和細胞毒性藥物將是治療TP53野生型胃癌的一個有效策略。bamHI-A region rightward transcript(BART)-3p是EB病毒miRNA組的重要成員之一。研究發現,BART-3p可誘導TP53基因高表達,其通過直接作用于TP53的3′非翻譯區,下調細胞周期蛋白依賴性激酶抑制因子1A、Bcl-2相關X蛋白質、凋亡因子FAS的表達,增強細胞增殖能力,抑制細胞凋亡[38]。同時,BART-3p在誘導TP53高表達時能對化療藥物和電離輻射產生抗性[40]。此研究首次證明了EB病毒miRNA與TP53的關系,可能有助于在未來開發治療胃癌的新途徑。
2.2AT豐富結合域1A(AT-rich interactive domain 1A,ARID1A) ARID1A定位于1p36.11,突變率為12%,參與DNA合成和基因轉錄的相關過程,其功能失調可導致染色質重構異常,進而引發腫瘤疾病[41]。ARID1A的表達與腫瘤大小、淋巴結轉移、預后呈顯著負相關[42]。在EB病毒相關胃癌中,ARID1A突變率較高,可通過激活Akt信號通路促進程序性細胞死亡配體1高表達[43]。
研究表明,ARID1A突變型腫瘤細胞對PI3K和聚腺苷二磷酸核糖聚合酶抑制劑敏感,單獨應用PI3K或PARP抑制劑時效果并不顯著,兩者聯合應用時可通過誘導DNA損傷有效抑制ARID1A突變型胃癌細胞的增殖、克隆形成、侵襲和遷移,是該種類型胃癌的首選治療方案[44]。
2.3腺瘤結腸息肉基因(adenonmatous poplyposis coligene,APC) APC定位于5q22.2,是Wnt通路的關鍵基因之一,突變常發生于第14和15位外顯子,發生在70%~90%的家族性腺瘤性息肉病中[45]。研究發現,APC基因與胃癌的分化和分期呈負相關,與淋巴結轉移無關[46]。APC基因突變后可改變蛋白表達、影響細胞周期調控增加胃癌的發病率。Magalh?es等[47]在彌漫型和腸型胃癌中發現,hsa-miR-135b-5p可負向調控APC基因,促進胃癌細胞的增殖和遷移。Yang等[48]闡述了一種新型長鏈非編碼RNA——LINC01133,通過啟動miR-106a-3p調控APC或Wnt/β聯蛋白通路,進一步抑制腫瘤的進展與轉移。
2.4轉化生長因子-βⅡ型受體(transforming growth factor-β receptor typeⅡ,TGFBR2) TGFBR2定位于3p24.1,參與許多細胞的生理調控過程,如細胞分化、細胞生長、細胞凋亡、細胞遷移,與胃癌進展呈負相關[49]。研究發現,miR-204通過靶向TGFBR2介導上皮細胞發生EMT,提高胃癌細胞對5-氟尿嘧啶的敏感性,并改善腫瘤耐藥[50]。此外,miR-155和onco-miR-130可通過負調控TGFBR2,促進胃癌細胞的生長和侵襲,為胃癌的治療和耐藥研究奠定了一定的基礎[51-52]。
2.5鈣黏蛋白1(cadherin 1,CDH1) CDH1定位于4q28.1,主要編碼上皮鈣黏素,突變率較低,但后果嚴重,不僅可降低上皮鈣黏素的活性,還可促進HER2的過表達[53]。CDH1檢測可用于遺傳性彌漫型胃癌的篩查。CDH1突變具有遺傳性,以常染色體顯性方式遺傳。攜帶突變CDH1男性80歲之前罹患彌漫型胃癌的累積風險為70%、女性為56%[37]。發生CDH1突變的胃癌患者病理檢查以印戒細胞癌為多,目前針對CDH1突變攜帶者的治療方式主要是預防性全胃切除[54]。但該方法創傷大且效果差,相關CDH1靶向藥物研究尚空缺。
2.6Ras同源基因家族成員A(Ras homolog gene family member A,RhoA) RhoA定位于4q28.1[55],屬于RAS亞家族成員之一。RHOA突變可促進彌漫性胃癌的發生,其在女性、遠端胃癌、低分化胃癌 (G3/G4)、T1/T2期以及無遠處轉移的患者中更為普遍[56]。當RhoA基因在Y42點突變時,可與c-Met直接結合,促進胃癌的增殖和轉移,患者預后差[57]。在現有研究中,胃動蛋白1、miR-31、CD24均可靶向RhoA抑制腫瘤進展,其中miR-31靶向RhoA時可同時增加腫瘤細胞對5-氟尿嘧啶的敏感性[58]。有關RhoA突變及其靶向機制還有待進一步研究。
3 胃癌中致癌基因與抑癌基因的相互調控作用
胃癌的致癌基因與抑癌基因存在相互作用,如圖1所示。KRAS和RhoA共同調控RAS-RAF-MEK-胞外信號調節激酶信號通路,促進胃癌的發生與發展。PIK3-Akt-mTOR通路不僅參與了胃癌的發生發展,而且是腫瘤細胞對化療藥物產生耐藥的主要通路。該通路中關鍵致癌基因ERBB2、PIK3CA或ERBB3的激活,在胃癌細胞的增殖和凋亡中發揮作用。除此之外,胃癌相關基因KRAS、TP53、FAT1和ERBB2的高表達增加了患者對幽門螺桿菌的易感性,從而增加了胃癌的患病風險[59]。在EB病毒相關胃癌中,PIK3CA和ARID1A具有較高的突變頻率,且兩者呈負調控關系[60]。
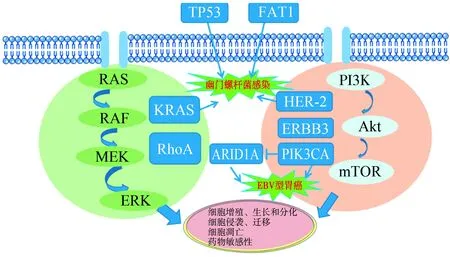
TP53:腫瘤蛋白p53;FAT1:脂肪非典型鈣黏蛋白1; MEK:促分裂原活化的蛋白激酶激酶;ERK:胞外信號調節激酶;KRAS:鼠類肉瘤病毒癌基因;RhoA:Ras同源基因家族成員A;HER-2:人表皮生長因子受體2;ERBB3:Erb-b2受體酪氨酸激酶3;PIK3CA:磷脂酰肌醇-3-激酶催化亞單位α;ARID1A:AT豐富結合域1A;PI3K/Akt/mTOR:磷脂酰肌醇-3-激酶/蛋白激酶B/哺乳動物雷帕霉素靶蛋白通路
圖1 致癌基因與抑癌基因的關系
4 展 望
雖然生物信息學分析技術和精準醫療的發展推動了胃癌靶向治療的進步,但目前研究還尚未成熟,仍需進一步探索以實現精準化和個體化治療。部分基因(如ERBB3、FAT1、CDH1和RhoA)在胃癌治療及耐藥方面的研究比較缺乏。目前雖然與胃癌靶向治療研究相關的基因眾多,但只有ERBB2是美國國家綜合癌癥網絡指南推薦的與胃癌治療相關的基因。另外,單個基因的靶向治療對胃癌的治療效果并不理想,而多種胃癌基因的靶向藥物聯合可提高胃癌患者的生存率。因此,尋找新的胃癌治療靶點以及關鍵基因之間的相互作用可能是急需攻破的難題。

