創傷修復用絲素蛋白敷料的研究進展
吳建兵 夏娟
摘要: 敷料的出現為加快創傷修復過程、緩解病人疼痛帶來了希望,然而敷料本身的材料來源、制備工藝、理化性能及與藥物的相互作用對創傷修復的效果至關重要。絲素蛋白安全性高、生物相容性好、易塑形、可根據敷料的要求靈活設計絲素蛋白材料。文章比較了各類創傷修復用絲素蛋白敷料,包括絲素蛋白膜、水凝膠、支架、納米纖維膜的性能特點、優勢及在創傷治療過程中存在的不足。另外,從細胞外基質的微環境出發,討論了雙層復合膜、纖維?凝膠,微球?支架等新型絲素蛋白復合敷料的研究進展,總結了其所存在的問題及需努力的方向。
關鍵詞: 絲素蛋白;敷料;創傷;修復;組織工程
中圖分類號: TS102.1
文獻標志碼: A
文章編號: 10017003(2020)10002905
引用頁碼: 101106
DOI: 10.3969/j.issn.1001?7003.2020.10.006(篇序)
Research progress of silk fibroin dressings for wound healing
WU Jianbing, XIA Juan
(School of Textile Garment and Design, Changshu Institute of Technology, Suzhou 215500, China)
Abstract:
The emergence of dressings brings hopes for speeding up the healing process and alleviating pains in patients. However, the material source, preparation process, physical and chemical properties of the dressing and interactions with drugs are very important to the effect of wound healing. Silk fibroin exhibits high safety, excellent biocompatibility, easiness for shaping, and silk fibroin materials can be flexibly designed according to dressing requirements. In this paper, all kinds of silk fibroin dressings for wound healing are compared in this paper, including property characteristics, advantages and defects of silk fibroin film, hydrogel, scaffold and nanofiber membrane. In addition, the research progress of new composite silk fibroin wound dressings involving double?layer composite film, fiber?gel and microsphere?scaffold are discussed from the microenvironment of extracellular matrix, and the existing problems and effort directions are summarized.
Key words:
silk fibroin; dressing; wound; healing; tissue engineering
收稿日期: 20200303;
修回日期: 20200916
基金項目: 江蘇省高等學校自然科學面上基金項目(19KJB430006);國家自然科學青年基金項目(51903019);大學生創新創業計劃項目(XJDC2019313);常熟理工學院科研啟動基金項目(KYZ2018028Q)
作者簡介: 吳建兵(1990),男,講師,主要從事絲蛋白生物醫用材料的研究。
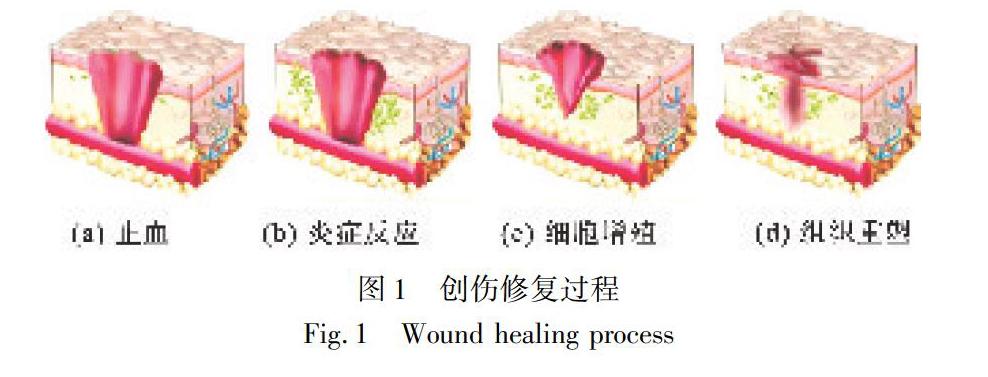
皮膚是人體抵御外界微生物入侵及細菌感染的第一道屏障。外力、高溫、化學腐蝕及自身代謝疾病是皮膚創傷的主要原因,使人飽受痛苦折磨的同時增加醫療負擔[1]。皮膚創傷治療,尤其是慢性難愈性創傷,及時有效地愈合非常重要,而傷口修復涉及止血、炎癥反應、細胞增殖分化和組織重塑四個階段[2],如圖1所示[3]。其中,止血和預防創面感染是皮膚創傷修復的首要前提。繃帶、紗布、棉墊等傳統敷料可作為傷口的物理保護層,然而該類敷料干燥、難以控制傷口微環境水分、易黏附在新生肉芽組織上,在更換時易發生損傷,造成疼痛,甚至會影響創傷愈合[4]。理想的敷料需滿足保持創傷濕潤的微環境要求外,還應具有抗菌性、透氣性、吸附性和不易黏附等特性[5]。目前,藥物遞送系統敷料將活性物質(抗菌藥物、生長因子)裝載在不同形式的載體敷料中,通過細胞反應促進傷口愈合,是最具治療潛力的生物活性敷料。藥物遞送系統敷料按其材料來源可分為天然、天然改性及合成三大類。天然高分子材料相比于其他兩種的獨特優勢在于:首先,材料毒副作用小,使用安全性高;其次,材料本身易塑形,為開發滿足創傷修復用的功能性敷料創造了有利的條件;最后,自身降解產物能夠被細胞信號識別,作為細胞生長、增殖及組織再生的營養成分[6]。目前殼聚糖[7]、透明質酸[8]、海藻酸鹽[9]、明膠[10]、膠原[11]、絲素蛋白[12]等,作為創傷修復用敷料材料來源而受到重點關注。
蠶絲富有光澤,手感細膩柔軟,已經作為手術縫合線廣泛應用在生物醫學領域中,具有優異的可降解性和安全性。在過去的幾十年中,各種蠶絲品種,包括絲素蛋白[12]、絲膠蛋白[13]、天然蜘蛛絲[14]和重組蠶絲蛋白[15]等已被廣泛用于創傷修復用敷料的研究。蠶絲主要是由絲素蛋白和絲膠蛋白構成。絲素蛋白包含重鏈、輕鏈和P 25蛋白三種結構,其中重鏈內94%的氨基酸序列是由甘氨酸?絲氨酸?丙氨酸構成的高度重復的結晶區,是絲素蛋白形成穩定β折疊構象的根本原因[16]。脫膠純化后的絲素蛋白水溶液的可塑性強,能形成薄膜、水凝膠、納微米球、微膠囊、靜電紡納米纖維、多孔支架等材料[17]。絲素蛋白優異的細胞相容性對細胞遷移、增殖和血管生成有良好的促進作用,并受到了人們的廣泛贊譽[12]。為了發揮絲素蛋白特有的生物學特性優勢,近年來作為人工皮膚替代物和具有生物活性的傷口敷料已經被陸續開發,并成為創傷快速修復新的策略。
本文將綜述各類創傷修復用絲素蛋白敷料的應用現狀,以及從細胞外基質的微環境出發,開發加快創傷愈合的新型敷料的研究進展,著重討論創傷修復用絲素蛋白敷料的優勢、所存在的問題與未來需要努力的方向。
1?絲素蛋白敷料的研究現狀
1.1?絲素蛋白膜
絲素蛋白膜的制備工藝簡單(流延法、澆筑法),成膜大小、厚度和孔隙大小等性能參數易調控,可為靈活設計滿足創傷修復用敷料的要求創造有利條件[17]。Liu等[18]驗證了再生絲素蛋白膜對人VEGF基因的L 929細胞無毒性,并且對細胞粘連、生長和凋亡均沒有不良作用,可作為人造皮膚替代品。盡管具備優良的細胞相容性,但是未能通過模擬動物創傷修復試驗進一步驗證絲素蛋白膜的有效性。另外,直接澆筑形成的絲素蛋白膜質堅、易脆且穩定性差,需通過后處理(水蒸氣、甲醇)來解決,也可與其他材料混合制備成膜。Gu等[19]將殼聚糖與絲素蛋白通過藻酸鹽二醛(ADA)交聯制備得到吸水率和透氣性均滿足創傷敷料要求的共混膜。該研究盡管解決了單一絲素蛋白膜存在的問題,但是由于創傷敷料缺乏膠原形成所需的生長因子,不利于創傷修復,尤其是慢性難愈性傷口。對蠶腺進行基因改造,得到含有生長因子功能化的蠶絲,以此方法促進傷口愈合是可行的。Bienert等[20]將成纖維細胞生長因子(FGF)、表皮生長因子(EGF)、角質細胞生長因子(KGF)、血小板生長因子(PDGF)或血管內皮生長因子(VEGF)功能化的絲素蛋白膜與不含生長因子的絲素蛋白膜進行了比較,研究發現所有絲素蛋白膜均具有良好的細胞相容性。在體外傷口愈合試驗中,與純絲素蛋白膜、KGF或PDGF功能化的絲素蛋白膜相比,當用EGF、FGF或VEGF功能化的絲素蛋白膜覆蓋時,傷口顯示了更高的愈合能力。因此,通過基因工程方法制備生長因子功能化的絲素蛋白膜,有望成為未來創傷修復用敷料的備選品。
1.2?絲素蛋白水凝膠
絲素水凝膠是三維空間的水合網絡結構,含水率極高(>95%),具有較高的分子通透性和彈性,利用涂布創面的方法,在創傷修復中有顯著的優勢。首先,可為細胞所需的氧氣、營養成分及代謝產物提供交換場所;其次,作為最接近細胞外基質的微環境,有利于細胞遷移、生長和增殖;最后,環境濕潤對新生肉芽組織無黏附作用,且易吸收壞死脫落的膿液和組織,減輕患者換藥時的疼痛。絲素蛋白溶液可在剪切力(渦旋、震蕩、超聲)作用下自組裝形成凝膠,制備工藝簡單,為制備生物活性的傷口敷料創造了條件[17]。利用水凝膠模擬細胞外基質微環境,一直是促進創傷修復研究的關鍵策略。將成纖維細胞生長因子(FGF)脯氨酸(形成膠原蛋白所需要的氨基酸)與絲素蛋白溶液共混得到熱穩定性優異,表面形態良好,溶脹保水性能突出,釋放、降解速率可控,生物相容性優異的共混凝膠。相比于其他凝膠基質,具有生物活性的絲素凝膠在創傷組織再生和修復方面的優勢突出[21?22]。然而該方法制備凝膠的彈性依然無法滿足臨床皮膚組織修復的要求。幸運的是,通過弱電場誘導形成的絲素蛋白凝膠已在神經、軟骨和骨骼等組織工程修復中得到廣泛應用[23]。基于該優勢,Karahaliloglu[24]制備了含有姜黃素的絲素蛋白電凝膠(CUR?SF e?gel),其孔隙率達到80%,溶脹率超過100%,相比于純絲素凝膠,CUR?SF e?gel能有效抑制細菌增殖,且對成纖維細胞無毒。因此,CUR?SF e?gel可以改善傷口愈合,有望用作傷口包扎材料。
1.3?絲素蛋白支架
絕大部分絲素支架可直接通過冷凍干燥的方法獲得,孔徑可由添加鹽顆粒的大小等方法決定。與水凝膠一樣,絲素支架也是三維網絡結構,自身的多孔結構有利于氣液體的交換,可為細胞生長提供空間。根據彈性蛋白是膠原蛋白的主要成分的特點,Vasconcelos等[25]利用天然生物交聯劑京尼平將絲素蛋白與彈性蛋白交聯冷凍干燥后,獲得小孔徑、低溶脹率、低釋放速率和降解速率的多孔支架(SF/EL)。通過燒灼誘導標準化燒傷創面并評估其對傷口愈合的效果,發現絲素蛋白/彈性蛋白復合支架在創面中的上皮組織形成最快,傷口愈合同樣最快。因為皮膚組織內蛋白質和多糖所含成分較多,有利于維持細胞的各項生理活動。為了進一步模擬細胞外基質微環境,Feng等[26]將魔芋葡甘露聚糖(KGM)通過物理交聯的方式裝載在絲素蛋白支架中(KGM/SF),可通過改變SF/KGM的混合比例來調控支架的多孔結構。令人欣慰的是該支架具有與天然皮膚組織相似的壓縮模量,滿足傷口處理時對敷料柔韌性的要求。因此,強大的吸水性能、持久的濕潤環境、類似于皮膚組織的壓縮模量和優異的細胞相容性,使得KGM/SF支架在敷料應用中具有巨大的潛力。加快創傷修復是敷料價值的體現,同樣微生物入侵和細菌感染也無法忽視,也是創傷修復最大的挑戰之一。支架敷料設計時應充分考慮最大程度減少傷口的細菌感染。Mehrabani等[27]成功地研制出不同含量納米銀顆粒的絲素蛋白/甲殼素納米復合材料支架,研究發現納米復合支架不僅具有良好的機械性能和高孔隙率,而且抗菌性和生物相容性優異,是傷口敷料的良好候選者。
1.4?絲素蛋白納米纖維膜
將絲素蛋白經過變性劑處理(六氟異丙醇或甲酸)后得到紡絲液在靜電紡絲噴頭噴出即可獲得納米纖維膜,其理化性能(形態、直徑、孔隙)等可通過電壓、噴絲頭孔徑、紡絲液濃度、流動速度或噴頭到接收器之間的距離調控。絲素納米纖維膜的比表面積通常較大,孔隙率可控,具備優良的皮膚親和力與良好的氣液滲透性。Zhao等[28]制備了重組絲蛋白納米纖維膜(pNSR 16),研究發現纖維平均直徑影響因素分別為電壓>流動速度>凝固距離;影響纖維均勻度因素分別是流速>凝固距離>電壓。另外,電紡膜與流延膜的組成相同,但前者的孔隙率高于后者,達到84.85%,可為細胞氣體交換、吸收營養物質和排出代謝產物提供空間。隨后用電紡膜對Sprague Dawley大鼠進行創傷治療,研究發現該創傷敷料能加速創面愈合和堿性成纖維細胞生長因子的表達。Zhang等[29]制備了具有大孔隙率和比表面積的靜電紡絲素納米纖維膜(ESF),然后利用聚多巴胺涂層(PDA)形成PESF膜,相比于ESF膜,PESF膜在膜的親水性、蛋白質吸附能力及成纖維細胞的增殖等方面更優越。進一步體內組織學分析證實,與ESF膜和市售敷料(3 MTMTegadermTM)相比,PESF膜可在2周內更有效地促進大鼠皮膚傷口中羥脯氨酸(膠原蛋白成分)含量的增加,表明了PESF膜的傷口愈合效果增強。因此,PESF膜作為創傷敷料在創面治愈和皮膚再生中具備一定的使用價值。可將間充質干細胞(MSC)或表皮干細胞(ESC)作為皮膚傷口修復的細胞本源,以保留患者剩余的自體皮膚并減少傷口面積與疼痛。許多研究用MSC作為傷口愈合的治療細胞,但用ESC進行治療可以加快傷口修復。除添加治療性細胞外,敷料的生物力學特性和表面形貌還影響傷口愈合的速度。絲素蛋白(SF)具備促進膠原蛋白再生以加速創面愈合的特性。Huang等[30]用親水性聚乙烯醇(PVA)制成了絲素納米纖維膜,再經甲醇處理得到PVA?SF敷料(PFSM),可以模擬內源性細胞外基質的結構。在體內,PFSM/ESC在第三天顯示肉芽組織再生,傷口閉合百分比為53.49%。因此,預先將干細胞分化成ESC并結合PFSM敷料能夠在一定程度上加速體內傷口愈合的速度。Song等[31]將抗菌肽(Cys?KR 12)包埋在靜電紡絲素納米纖維膜上,發現Cys?KR 12在絲素納米纖維膜上的包埋密度可以精確控制,且反應產率高。Cys?KR 12包埋的絲素蛋白納米纖維膜對四種病原細菌菌株(金黃色葡萄球菌、表皮葡萄球菌大腸桿菌和銅綠假單胞菌)均表現出抗菌活性。另外,它還促進了角質形成細胞和成纖維細胞的增殖,角質形成細胞的分化,并增強了細胞間的附著。Yang等[32]將具有抗炎、抗菌及促進組織生長功效的麥盧卡蜂蜜(MH)通過靜電紡絲制備了包埋不同含量的MH絲素蛋白納米纖維膜(MH/SF),MH的添加保持MH?SF優異生物相容性的同時提高了其抗菌活性。此外動物試驗數據表明,MH/SF復合納米纖維膜在改善傷口愈合方面表現出優異的性能,可能是傷口包扎有前途的醫用敷料。
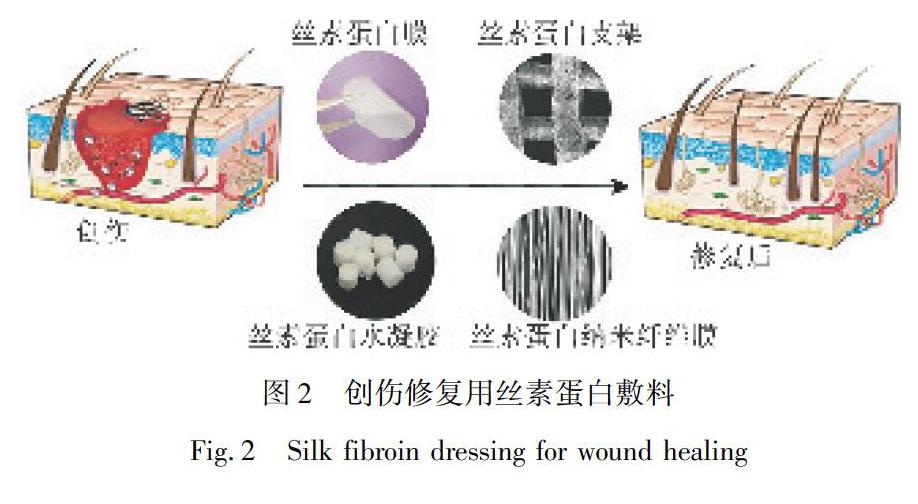
盡管上述的絲素蛋白材料在創傷修復中的應用取得了明顯的突破,如圖2所示,但是依然存在很多限制。例如,絲素蛋白膜難以清除傷口中壞死的組織和膿液,使得上皮組織再生受阻;絲素蛋白水凝膠的力學性能較差,降解的過程中易崩塌,可能會誤認為傷口的再次感染;絲素蛋白支架除了黏附性能差以外,其降解速率與皮膚組織再生的速率也不協調;絲素蛋白納米纖維膜在制備過程中需要添加劇毒的六氟異丙醇,存在毒性。另外,絲素蛋白具有大量的非極性氨基酸,單一的絲素敷料遠不能滿足創傷修復的要求,例如親水性、抗菌性、材料本身的力學性能及難愈性創傷的持久性治療等。傷口的性質和愈合過程非常復雜,具有生物活性的單層藥物遞送敷料遠不能滿足創傷修復的要求。雙層復合敷料由兩種材料組合而成,可實現多種功能,例如抗菌消炎的同時可快速吸收膿液,減少更換敷料的次數,促進創傷的高效修復。
2?新型絲素蛋白敷料的研究進展
2.1?雙層絲素蛋白復合膜敷料
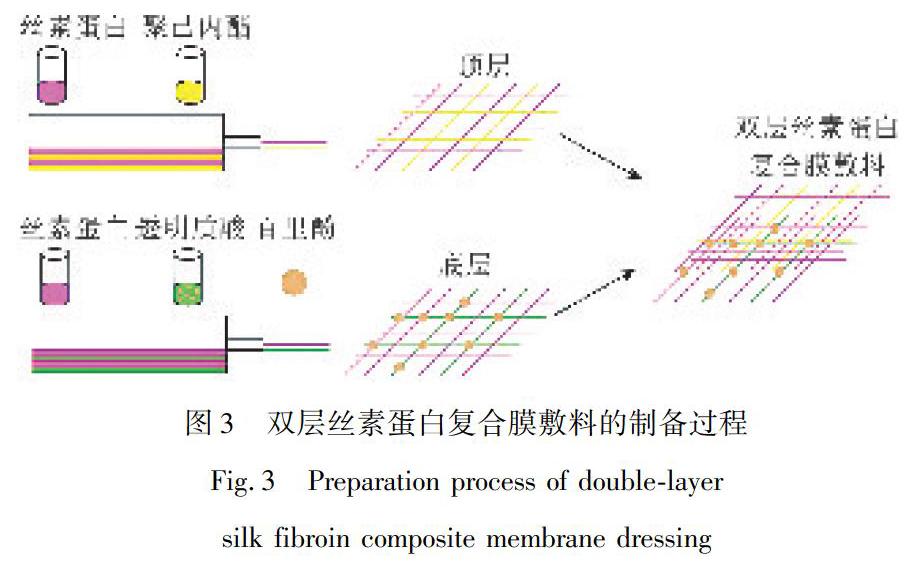
如今新型的具有改進性能的傷口敷料正在開發中,其中不對稱膜由于其模仿皮膚表皮和真皮層的兩層結構而引起了越來越多的關注。為此,Miguel等[33]使用靜電紡絲技術制備了新的不對稱膜,如圖3所示。頂層由絲素蛋白(SF)和聚己內酯制成,以再現表皮的致密性質和防水能力。另一方面,用絲素蛋白和負載有百里酚(THY)的透明質酸來制備真皮樣底層。試驗數據表明,所制備的靜電紡不對稱膜的孔隙率、潤濕性、機械性能及生物相容性滿足創傷修復的要求,真皮樣底層含THY可改善其抗氧化和抗菌性能。因此,雙層不對稱絲素蛋白膜在傷口愈合中具備不言而喻的使用價值。
2.2?絲素蛋白纖維?凝膠復合敷料
羊水(AF)中含有高度豐富的多種治療劑,可以促進細胞反應和傷口愈合[34]。純絲素蛋白凝膠的彈性難以滿足實際傷口敷料使用的要求。如何發揮AF與絲素蛋白凝膠的優勢制備理想的新型生物活性傷口敷料引起研究人員的思考。Ghalei等[35]首先通過靜電紡絲方法制備了絲素蛋白纖維,然后將其包埋在含有AF的藻酸鹽水凝膠(ALG)中,從而提高凝膠的彈性。掃描電子顯微鏡圖像顯示,絲素蛋白纖維均勻分布在藻酸鹽水凝膠中,且敷料的彈性模量與斷裂伸長率可通過ALG/AF比例調控,ALG濃度的增加可延緩AF的體外釋放。成纖維細胞體外培養結果表明,AF含量的增加有利于細胞增殖、擴散和分泌膠原蛋白。因此,新型的生物活性敷料在促進創面愈合中具備一定的利用價值。
2.3?絲素蛋白微球?支架復合敷料
慢性傷口愈合是組織工程和再生醫學的難點。為了促進傷口愈合,不僅需要生物活性傷口敷料,而且生物活性能否長時間保持是傷口愈合的關鍵。將生長因子均勻包埋在絲素微球中,伴隨著微球骨架逐漸降解的同時延緩生長因子的釋放,從而實現慢性傷口的長效治療。將具有生物活性胰島素絲素微球與絲素支架復合對于慢性傷口的治療是有優勢的。基于此,Li等[36]對該設想進行驗證,利用同軸電噴霧絲素蛋白水溶液制備包埋胰島素的絲素蛋白微球。胰島素的體外長效緩慢釋放長達28 d,且從微球釋放出的胰島素依然可以維持原始的分子構象。通過人角質形成細胞和內皮細胞的細胞遷移試驗,證實了從絲素微球釋放的胰島素依然保留了其天然的生物活性。此外,將胰島素包封的微球裝載到絲素蛋白支架中,制備生物活性傷口敷料,并且評估了敷料在大鼠的背側全厚度傷口上的治療效果。結果顯示,包埋胰島素絲素微球的生物活性創傷敷料可以加速傷口閉合、膠原蛋白沉積和血管形成,從而促進傷口愈合。因此,該新型絲素蛋白復合敷料為慢性傷口提供了新的治療策略。
3?結?語
創傷修復用絲素蛋白敷料的研究已經取得了豐富的成果。不僅多種形態的絲素蛋白為創傷修復用敷料提供了豐富的材料選擇,而且絲素蛋白的可塑性強,可構建模擬細胞外基質的微環境,保持生長因子的生物活性,促進不同細胞的附著、遷移、生長和增殖,加快創傷修復的進程。
肯定絲素蛋白敷料應用價值的同時,也應該清楚地認識到依然有很多問題亟待解決。例如:1)如何實現絲素蛋白敷料降解速率與皮膚組織再生速率的協調;2)如何針對創傷修復過程中的不同生理特點設計功能靈活的絲素蛋白敷料;3)如何弄清生物活性敷料的絲素蛋白在促進細胞分裂、遷移、增殖等生理過程方面的作用機制;4)如何開發新技術優化絲素蛋白敷料的理化性能實現創傷修復的安全性、適用性和高效性。
創傷修復是一個復雜的過程,需要不同的細胞、細胞外基質成分和生物活性分子相互作用才能完成。針對上述存在的問題,未來的研究一方面應該集中在根據傷口類型優化功能性敷料的理化性能和組成,充分研究其與創傷修復之間的生物學效應;另一方面,依然通過生物活性分子對絲素蛋白材料進行功能化,開發高效修復、降低瘢痕組織生成風險的創傷敷料,為創傷修復的臨床應用治療提供理論與材料支撐。
參考文獻:
[1]CLARK R A, TONNESEN M G, GAILIT J, et al. Transient functional expression of alphaVbeta 3 on vascular cells during wound repair[J]. The American Journal of Pathology, 1996, 148(5): 1407?1421.
[2]VELNAR T, BAILEY T, SMRKOLIJ V. The wound healing process: an overview of the cellular and molecular mechanisms[J]. Journal of International Medical Research, 2009, 37(5): 1528?1542.
[3]LIN P H, SERMERSHEIM M, LI H, et al. Zinc in wound healing modulation[J]. Nutrients, 2017, 10(1): 1?20.
[4]PEREIRA R F, BARTOLO P J. Traditional therapies for skin wound healing[J]. Advances in Wound Care, 2016, 5(5): 208?229.
[5]MIR M, ALI M N, BARAKULLAH A, et al. Synthetic polymeric biomaterials for wound healing: a review[J]. Progress in Biomaterials, 2018, 7(1): 1?21.
[6]MOGOSANU G D, GRUMEZESCU A M. Natural and synthetic polymers for wounds and burns dressing[J]. International Journal of Pharmaceutics, 2014, 463(2): 127?136.
[7]LIU H, WANG C, LI C, et al. A functional chitosan?based hydrogel as a wound dressing and drug delivery system in the treatment of wound healing[J]. RSC Advances, 2018, 8(14): 7533?7549.
[8]ZHU J, LI F, WANG X, et al. Hyaluronic acid and polyethylene glycol hybrid hydrogel encapsulating nanogel with hemostasis and sustainable antibacterial property for wound healing[J]. ACS Applied Materials & Interfaces, 2018, 10(16): 13304?13316.
[9]LU Y, HUANG C L, YU F, et al. Effect of calcium alginate dressing on the cytokine contents, collagen synthesis degradation balance and apoptosis gene expression in the wound after perianal abscess surgery[J]. Journal of Hainan Medical University, 2017, 23(18): 2514?2516.
[10]YOON D S, LEE Y, RYU H A, et al. Cell recruiting chemokine?loaded sprayable gelatin hydrogel dressings for diabetic wound healing[J]. Acta Biomaterialia, 2016, 38: 59?68.
[11]CHOI S M, RYU H A, LEE K M, et al. Development of stabilized growth factor?loaded hyaluronate?collagen dressing(HCD) matrix for impaired wound healing[J]. Biomaterials Research, 2016, 20(9): 1?7.
[12]CHOUHAN D, CHAKRABORTY B, NANDI S K, et al. Role of non?mulberry silk fibroin in deposition and regulation of extracellular matrix towards accelerated wound healing[J]. Acta Biomaterialia, 2017, 48: 157?174.
[13]ARAMWIT P, PALAPINYO S , SRICHANA T, et al. Silk sericin ameliorates wound healing and its clinical efficacy in burn wounds[J]. Archives of Dermatological Research, 2013, 305(7): 585?594.
[14]ZAHRA S, MOSTAFA M, ARMAN H, et al. Evaluation of wound dressing made from spider silk protein using in a rabbit model[J].The International Journal of Lower Extremity Wounds, 2018, 17(2): 71?77.
[15]LI Y, ZHAO L, WANG H, et al. Preparation of regenerated silk fibroin?based heat?management sponge for wound healing[J]. Journal of Applied Polymer Science, 2019, 136(44): 48173.
[16]MELKE J, MIAHA S, GHOSH S, et al. Silk fibroin as biomaterial for bone tissue engineering[J]. Acta Biomaterialia, 2016, 31: 1?16.
[17]ROCKWOOD D N, PREDA R C, YUCEL T, et al. Materials fabrication from Bombyx mori silk fibroin[J]. Nature Protocols, 2011, 6(10): 1612?1631.
[18]LIU T, MIAO J, SHENG W, et al. Cytocompatibility of regenerated silk fibroin film: a medical biomaterial applicable to wound healing[J]. Journal of Zhejiang University Science B(Biomedicine & Biotechnology), 2010, 11(1): 10?16.
[19]GU Z, XIE H X, HUANG C, et al. Preparation of chitosan/silk fibroin blending membrane fixed with alginate dialdehyde for wound dressing[J]. International Journal of Biological Macromolecules, 2013, 58: 121?126.
[20]BIENERT M, HOSS M, BARTNECK M, et al. Growth factor?functionalized silk membranes support wound healing in vitro[J]. Biomedical Materials, 2017, 12(4): 045023.
[21]HE S, SHI D, HAN Z, et al. Heparinized silk fibroin hydrogels loading FGF1 promote the wound healing in rats with full?thickness skin excision[J]. Biomedical Engineering Online, 2019, 18(1): 97.
[22]THANGAVEL P, RAMACHANDRAN B, KANNAN R, et al. Biomimetic hydrogel loaded with silk and l‐proline for tissue engineering and wound healing applications[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2017, 105(6): 1401?1408.
[23]KARAHALILOGLU Z, YALCIN E, DEMIRBILEK M, et al. Magnetic silk fibroin e?gel scaffolds for bone tissue engineering applications[J]. Journal of Bioactive & Compatible Polymers, 2017, 32(6): 596?614.
[24]KARAHALILOGLU Z. Curcumin?loaded silk fibroin e?gel scaffolds for wound healing applications[J]. Materials Technology, 2018, 33(4): 276?287.
[25]VASCONCELOS A, GOMES A C, CAVACO?PAULO A. Novel silk fibroin/elastin wound dressings[J]. Acta Biomaterialia, 2012, 8(8): 3049?3060.
[26]FENG Y, LI X, ZHANG Q, et al. Mechanically robust and flexible silk protein/polysaccharide composite sponges for wound dressing[J]. Carbohydrate Polymers, 2019, 216: 17?24.
[27]MEHRABANI M G, KARIMIAN R, MEHRAMOUZ B, et al. Preparation of biocompatible and biodegradable silk fibroin/chitin/silver nanoparticles 3D scaffolds as a bandage for antimicrobial wound dressing[J]. International Journal of Biological Macromolecules, 2018, 114: 961?971.
[28]ZHAO L, CHEN D, YAO Q, et al. Studies on the use of recombinant spider silk protein/polyvinyl alcohol electrospinning membrane as wound dressing[J]. International Journal of Nanomedicine, 2017, 12: 8103?8114.
[29]ZHANG Y, LU L, CHEN Y, et al. Polydopamine modification of silk fibroin membranes significantly promotes their wound healing effect[J]. Biomaterials Science, 2019, 7(12): 5232?5237.
[30]HUANG T Y, WANG G S, TSENG C C, et al. Epidermal cells differentiated from stem cells from human exfoliated deciduous teeth and seeded onto polyvinyl alcohol/silk fibroin nanofiber dressings accelerate wound repair[J]. Materials Science and Engineering: C, 2019, 104: 109986.
[31]SONG D W, KIM S H, KIM H H, et al. Multi?biofunction of antimicrobial peptide?immobilized silk fibroin nanofiber membrane: implications for wound healing[J]. Acta Biomaterialia, 2016, 39: 146?155.
[32]YANG X, FAN L, MA L, et al. Green electrospun Manuka honey/silk fibroin fibrous matrices as potential wound dressing[J]. Materials & Design, 2017, 119: 76?84.
[33]MIGUEL S P, SIMOES D, MOREIRA A F, et al. Production and characterization of electrospun silk fibroin based asymmetric membranes for wound dressing applications[J]. International Journal of Biological Macromolecules, 2019, 121: 524?535.
[34]LANG A K, SEARLE R F. The immunomodulatory activity of human amniotic fluid can be correlated with transforming growth factor?beta 1(TGF?β1) and β2 activity[J]. Clinical and Experimental Immunology, 1994, 97(1): 158?163.
[35]GHALEI S, NOURMOHAMMADI J, SOLOUK A, et al. Enhanced cellular response elicited by addition of amniotic fluid to alginate hydrogel?electrospun silk fibroin fibers for potential wound dressing application[J]. Colloids and Surfaces B: Biointerfaces, 2018, 172: 82?89.
[36]LI X, LIU Y, ZHANG J, et al. Functionalized silk fibroin dressing with topical bioactive insulin release for accelerated chronic wound healing[J]. Materials Science and Engineering: C, 2017, 72: 394?404.

