SD大鼠血清TF、TM、vWF的含量與CRT形成的關(guān)系
韋 艷應(yīng)燕萍凌 瑛趙慧函蔣慶娟甘 曉文 萃
(廣西醫(yī)科大學(xué)第一附屬醫(yī)院,南寧 530021)
導(dǎo)管相關(guān)性血栓(catheter-related thrombosis,CRT)是指導(dǎo)管留置期間或是移除后7 d內(nèi),在留置導(dǎo)管的靜脈或鄰近靜脈內(nèi)以及導(dǎo)管外壁出現(xiàn)血凝塊,附壁血栓可自導(dǎo)管向血管腔內(nèi)延伸擴(kuò)展[1-2]。有研究報道,CRT 發(fā)生率為10.30%~30.77%[3-4],它可致導(dǎo)管功能喪失,增加患者的醫(yī)療風(fēng)險和住院費用[5]。早在19 世紀(jì),Virchow 提出血栓形成條件包括血管內(nèi)皮損傷、血流狀態(tài)改變和血液高凝狀態(tài)[6],該理論同樣適用于CRT 的形成。無論是經(jīng)典理論,還是近來的研究發(fā)現(xiàn),血管內(nèi)皮損傷始終參與眾多血栓性疾病的形成。本研究通過頸外靜脈置管構(gòu)建大鼠 CRT 模型,檢測并分析組織因子(TF)、血栓調(diào)節(jié)蛋白(TM)及血管性假血友病因子(vWF)3 種血管內(nèi)皮損傷標(biāo)志物在大鼠血液中的含量變化,探討其與 CRT 形成的關(guān)系,為 CRT 的預(yù)防、診斷和治療提供參考。
1 材料和方法
1.1 實驗動物
SPF 級 SD 雄性大鼠 120 只,12 周齡,體重 160~210 g,均購自并飼養(yǎng)于廣西醫(yī)科大學(xué)實驗動物中心[SCXK(桂)2020-0004],實驗前適應(yīng)性飼養(yǎng)1周,均給標(biāo)準(zhǔn)飼料喂養(yǎng),自由飲水,濕度為50% ~60%,室溫為20℃~25℃,光線和通風(fēng)情況均良好。無菌手術(shù)在廣西醫(yī)科大學(xué)實驗動物中心屏障動物實驗設(shè)施進(jìn)行[SYXK(桂)2020-0003],所有實驗操作均獲得廣西醫(yī)科大學(xué)動物實驗倫理委員會的批準(zhǔn)(201808009),在研究過程中,實驗者嚴(yán)格遵循國際實驗動物福利倫理“3R”原則,給予大鼠應(yīng)有的人道關(guān)懷。
1.2 主要儀器與試劑
酶標(biāo)儀(Thermo 公司);離心機(jī)(TD5A-WS,湖南湘儀);切片機(jī)(RM2245,德國Leica 公司);生物組織自動包埋機(jī)(HD-310,湖北慧達(dá)儀器有限公司);紫外可見分光光度計(UV-5200PC,上海元析);正置熒光顯微鏡(BX53,日本Olympus 公司);大鼠組織因子(TF)酶聯(lián)免疫試劑盒(96T,武漢華美生物工程有限公司,批號:CSB-E07914r);大鼠血栓調(diào)節(jié)蛋白(TM)酶聯(lián)免疫試劑盒(96T,武漢華美生物工程有限公司,批號:CSB-E07939r);大鼠血管性假血友病因子(vWF)酶聯(lián)免疫試劑盒(96T,武漢華美生物工程有限公司,批號:CSB-E08438r);1%戊巴比妥鈉及1#(硅膠)小鼠頸靜脈插管(思科諾生物科技(北京)有限公司);10%中性緩沖福爾馬林固定液(廣州維格斯生物科技有限公司)。
1.3 實驗方法
1.3.1 分組及造模
采用sjwz 動物隨機(jī)分組軟件,將120 只SD 大鼠分為空白對照組(n=40 只)、假手術(shù)組(n=40只)、模型組(n=40 只),各組又分為術(shù)后 1 d、4 d、7 d、10 d、14 d 5 個亞組,每個亞組各 8 只。模型組:參照課題組前期實驗手術(shù)方式[7],行大鼠腹腔內(nèi)麻醉(1%戊巴比妥鈉,按40 mg/kg 計算),待麻醉滿意后,大鼠予仰臥位固定,完成備皮和消毒后,沿頸中線偏右側(cè)(約0.5 cm)作一縱行切口,鈍性分離皮下組織,暴露并完全游離右頸外靜脈(長約1 ~1.5 cm),在靜脈管壁上全層剪一"V"形小口,約占其周長的1/3~1/2,將末端連接有1 mL 注射器的小鼠頸靜脈硅膠導(dǎo)管經(jīng)由"V"形小口處置入2 ~2.5 cm,推抽注射器,見有血液回流且推注順暢,予0.9%氯化鈉注射液沖管后,導(dǎo)管末端用不銹鋼堵頭封管。以4-0 號線結(jié)扎固定近、遠(yuǎn)心端導(dǎo)管,并將導(dǎo)管連同附近的少許肌肉縫合2 ~3 針進(jìn)行固定。導(dǎo)管遠(yuǎn)心端取長約1 ~1.5 cm 埋于手術(shù)切口皮下,最后縫合切口。假手術(shù)組:暴露右頸外靜脈后,不行靜脈切開,立即縫合手術(shù)切口。空白對照組:不做任何手術(shù)處理,予正常飼養(yǎng)。術(shù)畢,均以0.5%碘伏消毒手術(shù)切口,保溫(室溫約24℃),大鼠麻醉復(fù)蘇后予正常分籠飼養(yǎng)。
1.3.2 大鼠樣本取材、處理
于術(shù)后 1 d、4 d、7 d、10 d、14 d,分別從三組中隨機(jī)取大鼠8 只,待大鼠麻醉滿意后,于腹部作一長約3 cm 縱行切口,暴露腹主動脈后,行腹主動脈采血,每只抽取全血5 mL,采血完成后逐層縫合腹壁切口。將血標(biāo)本用離心機(jī)以4000 r/min 速度離心5 min 制備血清,放入-80℃深低溫冷凍冰箱保存?zhèn)錅y。大鼠采血后實行安樂死,假手術(shù)組與模型組,沿原手術(shù)切口切開皮膚,鈍性分離皮下組織,暴露右頸外靜脈后,截取右頸外靜脈至上腔靜脈段(長約2 cm)的血管組織作為標(biāo)本。空白對照組取與假手術(shù)組、置管組相同部位、相同長度的血管組織作為標(biāo)本,用10%福爾馬林液固定48 h,脫水后石蠟包埋、切片,并行HE 染色,顯微鏡下觀察血栓的病理情況。取材術(shù)后,嚴(yán)格遵照動物實驗倫理委員會的要求安置處理所有實驗大鼠。
1.3.3 大鼠血清 TF、TM、vWF 濃度檢測
血清TF、TM、vWF 含量采用酶聯(lián)免疫吸附試驗(ELISA)法測定,嚴(yán)格按照試劑盒說明書標(biāo)準(zhǔn)進(jìn)行實驗操作,最后通過專業(yè)Curve Expert 軟件繪制標(biāo)準(zhǔn)曲線,根據(jù)標(biāo)準(zhǔn)曲線換算出待測樣品的血清TF、TM、vWF 含量。
1.4 統(tǒng)計學(xué)方法
采用SPSS 22.0 統(tǒng)計軟件分析數(shù)據(jù),計量資料以平均數(shù)±標(biāo)準(zhǔn)差(±s)表示,多組均數(shù)間比較采用單因素方差分析和兩兩比較的LSD 或Tamhane檢驗。P<0.05 差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 動物一般情況及病理學(xué)結(jié)果
術(shù)后所有大鼠精神佳、正常進(jìn)食、活動良好,實驗期間,大鼠均存活。實驗中,成功建立大鼠右頸外靜脈導(dǎo)管留置模型40 例,置管成功率為100%,并有34 只發(fā)生CRT,CRT 發(fā)生率為85%。模型組術(shù)后1 d、4 d,血栓形成率分別為50.0%(4/8)、75.0%(6/8);術(shù)后 7 d、10 d、14 d 血栓形成率均為100.0%(8/8)。筆者前期研究的病理結(jié)果示[8]:空白對照組及假手術(shù)組,血管內(nèi)膜完整,管腔內(nèi)均無血栓形成。模型組術(shù)后1~4 d 是CRT 的形成階段,均為混合血栓,鏡下可見血小板小梁及梁間有紅細(xì)胞分布;術(shù)后7~14 d 為CRT 機(jī)化的發(fā)展階段,隨著時間的推移,鏡下可見血栓與血管壁黏連面積增大、纖維增生及毛細(xì)血管生成增多,且血管壁炎癥浸潤程度加重;術(shù)后14 d,鏡下見血栓被肉芽組織完全替代,血管腔出現(xiàn)再通。
2.2 同組不同留置時間TF、TM、vWF 含量變化
空白對照組及假手術(shù)組TF、TM、vWF 的含量在不同時間點的差異無統(tǒng)計學(xué)意義(P>0.05)。模型組術(shù)后不同時間點TF、TM、vWF 比較,差異有統(tǒng)計學(xué)意義(P<0.01),見表1。術(shù)后,模型組大鼠血清TF、TM、vWF 含量隨時間逐漸增加,其中 TF、vWF 含量在術(shù)后1~4 d 急劇上升,術(shù)后10 d 達(dá)到峰值,隨后迅速下降;TM 含量在術(shù)后4 ~7 d 驟升,術(shù)后7 d達(dá)到峰值,隨后開始下降并逐漸穩(wěn)定,但仍高于術(shù)后4 d 水平。
表1 模型組不同時間點TF、TM、vWF 濃度比較( ±s)Table 1 Comparison of TF,TM and vWF concentrations at different time points in the model group

表1 模型組不同時間點TF、TM、vWF 濃度比較( ±s)Table 1 Comparison of TF,TM and vWF concentrations at different time points in the model group
注:與術(shù)后1、14 d 比較,*P<0.05;與術(shù)后4 d 比較,△P<0.05;與術(shù)后1、4 d 比較,#P<0.05;與術(shù)后7 d 比較,※P<0.05;與術(shù)后1 d 比較,$P<0.05。Note.Compared with 1 and 14 days after surgery,*P <0.05.Compared with 4 days after surgery,△P<0.05.Compared with 1 and 4 days after surgery,#P<0.05.Compared with 7 days after surgery,※P<0.05.Compared with 1 day after operation,$P <0.05.
組別Groups只數(shù)Number組織因子(pg/mL)Tissue factor血栓調(diào)節(jié)蛋白(ng/mL)Thrombomodulin血管性假血友病因子(ng/mL)Von Willebrand factor術(shù)后1 d 1 d after operation 8 33.802±6.390 13.265±2.845 540.450±101.738術(shù)后4 d 4 d after operation 8 46.259±6.953*$ 25.107±2.787 755.475±106.433 $術(shù)后7 d 7 d after operation 8 56.836±11.352*△ 51.352±4.223# 770.325±108.022 $術(shù)后10 d 10 d after operation 8 60.447±8.523*△ 38.408±4.526#※ 773.775±110.897 $術(shù)后14 d 14 d after operation 8 36.865±4.703 40.510±4.439#※ 664.275±117.066 $F /17.738 117.951 6.772 P/0.000 0.000 0.000
2.3 相同留置時間,不同組 TF、TM、vWF 含量變化
模型組發(fā)生CRT 大鼠的TF、TM、vWF 含量均較空白對照組和假手術(shù)組顯著升高(P<0.01),模型組發(fā)生CRT 大鼠的TM 含量較未發(fā)生CRT 大鼠明顯升高(P<0.01),模型組未發(fā)生CRT 大鼠的TM 含量較假手術(shù)組顯著升高(P<0.01),模型組未發(fā)生CRT大鼠的TM、vWF 含量較空白對照組明顯升高(P<0.01),見表2。術(shù)后各個時間點,模型組 TF、TM 含量均較空白對照組及假手術(shù)組明顯升高(P<0.01),見表3、表4。術(shù)后1 d,模型組vWF 含量較空白對照組明顯升高(P<0.01);術(shù)后 4 d、7 d、10 d、14 d,模型組vWF 含量較空白對照組及假手術(shù)組顯著升高(P<0.01),見表5。
表2 TF、TM、vWF 的濃度在不同組間比較( ±s)Table 2 Comparison of TF,TM and vWF concentrations among different groups
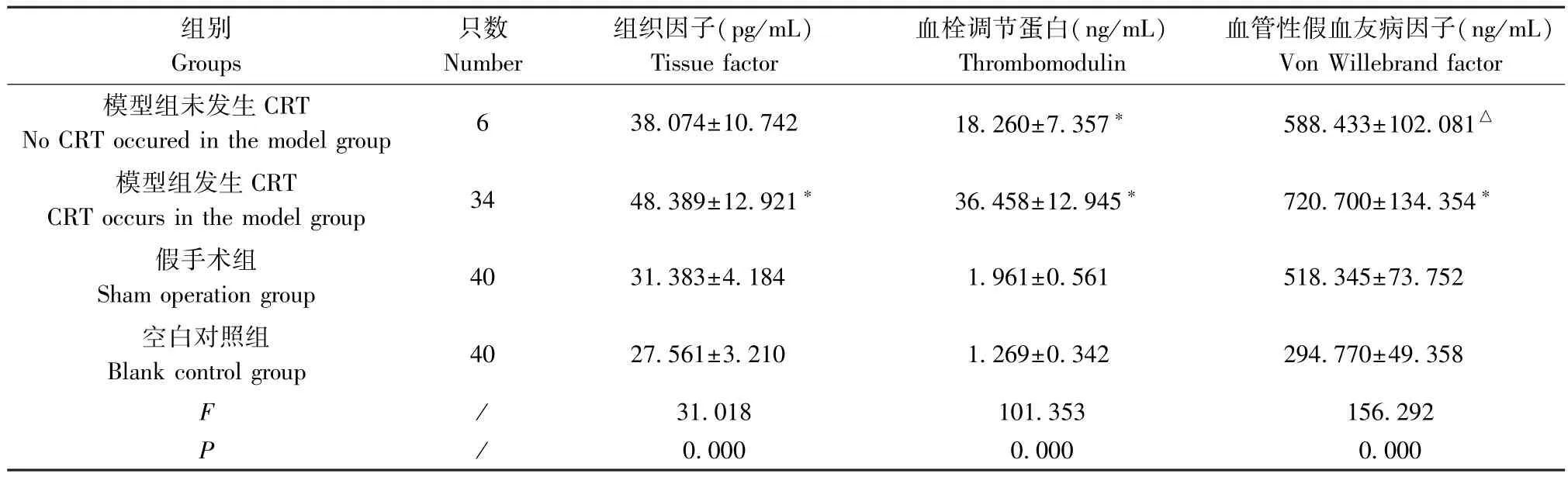
表2 TF、TM、vWF 的濃度在不同組間比較( ±s)Table 2 Comparison of TF,TM and vWF concentrations among different groups
注:與空白對照組及假手術(shù)組比較,*P<0.05;與空白對照組比較,△P<0.05。Note.Compared with the blank control group and sham operation group,*P<0.05.Compared with the blank control group,△P<0.05.
組別Groups只數(shù)Number組織因子(pg/mL)Tissue factor血栓調(diào)節(jié)蛋白(ng/mL)Thrombomodulin血管性假血友病因子(ng/mL)Von Willebrand factor模型組未發(fā)生CRT No CRT occured in the model group 6 38.074±10.742 18.260±7.357* 588.433±102.081△模型組發(fā)生CRT CRT occurs in the model group 34 48.389±12.921* 36.458±12.945* 720.700±134.354*假手術(shù)組Sham operation group 40 31.383±4.184 1.961±0.561 518.345±73.752空白對照組Blank control group 40 27.561±3.210 1.269±0.342 294.770±49.358 F /31.018 101.353 156.292 P/0.000 0.000 0.000
表3 術(shù)后不同時間點三組大鼠血清中TF 濃度的比較(pg/mL,±s)Table 3 Comparison of serum TF concentration in three groups of rats at different time points after operation

表3 術(shù)后不同時間點三組大鼠血清中TF 濃度的比較(pg/mL,±s)Table 3 Comparison of serum TF concentration in three groups of rats at different time points after operation
注:與空白對照組及假手術(shù)組比較,*P<0.05。Note.Compared with the blank control group and sham operation group,*P <0.05.
組別Groups只數(shù)Number術(shù)后1 d 1 d after operation術(shù)后4 d 4 d after operation術(shù)后7 d 7 d after operation術(shù)后10 d 10 d after operation術(shù)后14 d 14 d after operation空白對照組Blank control group 40 26.918±2.079 27.372±2.543 27.434±3.060 27.250±5.331 28.829±2.524假手術(shù)組Sham operation group 40 28.196±2.532 30.958±3.603 34.018±5.743 31.471±2.920 32.270±3.998模型組Model group 40 33.802±6.390* 46.259±6.593* 56.836±11.352* 60.447±8.523* 36.865±4.703*F /6.240 25.107 33.371 44.752 8.772 P/0.007 0.000 0.000 0.000 0.000
表4 術(shù)后不同時間點三組大鼠血清中TM 濃度的比較(ng/mL,±s)Table 4 Comparison of serum TM concentration in three groups of rats at different time points after operation
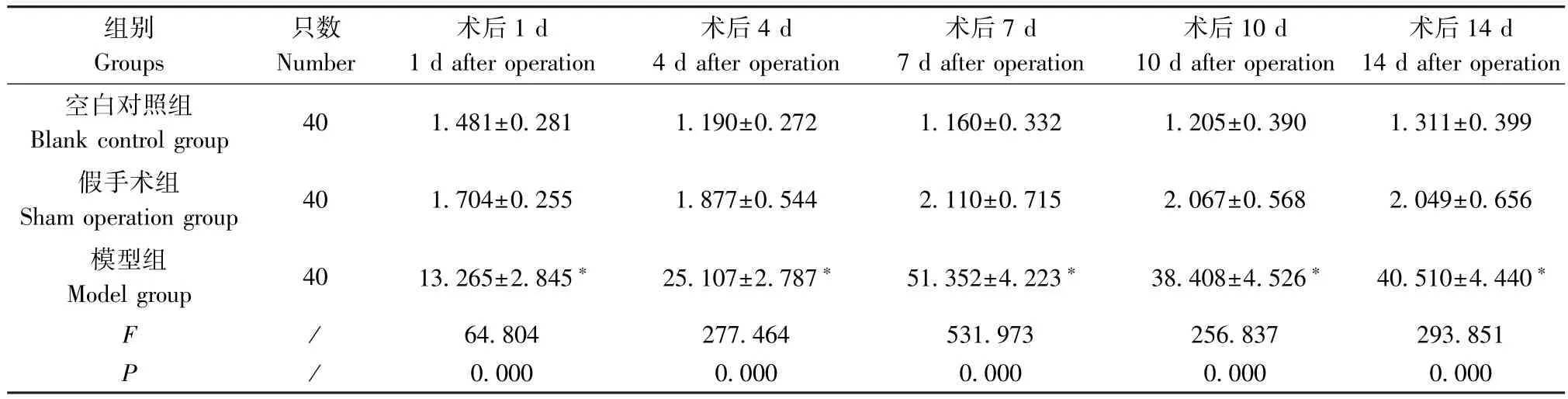
表4 術(shù)后不同時間點三組大鼠血清中TM 濃度的比較(ng/mL,±s)Table 4 Comparison of serum TM concentration in three groups of rats at different time points after operation
注:與空白對照組及假手術(shù)組比較,*P<0.05。Note.Compared with the blank control group and sham operation group,*P<0.05.
組別Groups只數(shù)Number術(shù)后1 d 1 d after operation術(shù)后4 d 4 d after operation術(shù)后7 d 7 d after operation術(shù)后10 d 10 d after operation術(shù)后14 d 14 d after operation空白對照組Blank control group 40 1.481±0.281 1.190±0.272 1.160±0.332 1.205±0.390 1.311±0.399假手術(shù)組Sham operation group 40 1.704±0.255 1.877±0.544 2.110±0.715 2.067±0.568 2.049±0.656模型組Model group 40 13.265±2.845* 25.107±2.787* 51.352±4.223* 38.408±4.526* 40.510±4.440*F /64.804 277.464 531.973 256.837 293.851 P/0.000 0.000 0.000 0.000 0.000
表5 術(shù)后不同時間點三組大鼠血清中vWF 濃度的比較(ng/mL,±s)Table 5 Comparison of serum vWF concentration in three groups of rats at different time points after operation

表5 術(shù)后不同時間點三組大鼠血清中vWF 濃度的比較(ng/mL,±s)Table 5 Comparison of serum vWF concentration in three groups of rats at different time points after operation
注:與空白對照組及假手術(shù)組比較,*P<0.05;與空白對照組比較,△P<0.05。Note.Compared with the blank control group and sham operation group,*P<0.05.Compared with the blank control group,△P <0.05.
組別Groups只數(shù)Number術(shù)后1 d 1 d after operation術(shù)后4 d 4 d after operation術(shù)后7 d 7 d after operation術(shù)后10 d 10 d after operation術(shù)后14 d 14 d after operation空白對照組Blank control group 40 291.975±67.355 300.600±44.561 296.750±43.494 299.400±53.498 285.125±45.979假手術(shù)組Sham operation group 40 507.950±42.688 499.250±63.158 531.975±63.284 565.950±114.309 486.600±54.117模型組Model group 40 540.450±101.738△ 755.475±106.433* 770.325±108.022* 773.775±110.897* 664.275±117.066*F 26.199 70.548 76.609 48.078 46.069 P/0.000 0.000 0.000 0.000 0.000/
3 討論
血管內(nèi)皮細(xì)胞(vascular endothelial cell,VEC),可以把血液中的血小板、凝血因子和有高度促凝作用的內(nèi)皮下細(xì)胞成分隔開,發(fā)揮物理屏障作用,而且可分泌多種生物活性物質(zhì),維持血管內(nèi)穩(wěn)態(tài),抑制血栓形成。經(jīng)過一個多世紀(jì),Virchow 的血栓形成機(jī)制雖已得到不斷的豐富和發(fā)展,但Virchow 機(jī)制中哪個因素對CRT 形成起主導(dǎo)作用,仍有待考究。隨著分子生物技術(shù)的發(fā)展,著手從分子和蛋白水平探討內(nèi)皮損傷與CRT 的關(guān)系,對深入研究CRT 的形成機(jī)制尤為重要。
本研究發(fā)現(xiàn),內(nèi)皮損傷程度與導(dǎo)管留置時間成正比,內(nèi)皮損傷越重,CRT 發(fā)生率越高。導(dǎo)管從穿刺到留置,都存在血管內(nèi)皮損傷的危險因素,最終導(dǎo)致CRT 的形成。本研究在建立導(dǎo)管留置模型時,因大鼠無意識、體積小及頸外靜脈解剖位置的特殊性,使體表盲穿置管無法進(jìn)行。因此置管手術(shù)只能在大鼠麻醉狀態(tài)下,通過依層切開皮膚、皮下組織,暴露右頸外靜脈后,在血管壁上剪一“V”形小口進(jìn)行置管,這是血管內(nèi)皮損傷的直接原因。內(nèi)皮損傷后,其物理屏障功能遭到破壞,血小板與內(nèi)膜的接觸機(jī)會增加,血小板和凝血因子Ⅻ被激活;而且損傷的VEC 會釋放促凝因子,激活凝血因子Ⅶ,隨著內(nèi)、外源性凝血過程的啟動,促使CRT 的形成。其次,導(dǎo)管作為異物,留置過程中對血管壁存在機(jī)械刺激,易致內(nèi)膜損傷;導(dǎo)管留置使局部血流速度變緩,被激活的凝血因子易在局部達(dá)到凝血需要的濃度,而血液瘀滯可引起血管內(nèi)膜局部缺血缺氧,血管內(nèi)皮細(xì)胞變性,暴露內(nèi)皮下膠原,從而引發(fā)凝血過程[6],加速CRT 的形成。
有研究表明,留置針置管可改變血液凝血物質(zhì)的水平[9]。組織因子(tissue factor,TF)是凝血級聯(lián)反應(yīng)的主要啟動因子,血管壁遭到破壞時,VEC 釋放的TF 暴露于血液中,與凝血因子Ⅶ/Ⅶa 結(jié)合發(fā)揮凝血作用,進(jìn)而激活凝血因子Ⅸ、Ⅹ,可致凝血酶生成[10-11],外源性凝血途徑被啟動,促使血栓形成。臨床研究發(fā)現(xiàn),行全膝關(guān)節(jié)置換術(shù)患者血漿TF 水平與術(shù)后 DVT 的發(fā)生呈正相關(guān)(r = 0.673,P<0.05),TF 的表達(dá)在血栓患者中上調(diào)[12]。本研究結(jié)果表明,模型組TF 含量較空白對照組及假手術(shù)組明顯升高(P<0.01)。隨著血栓的演變,模型組TF含量逐漸升高,術(shù)后1 ~4 d 增幅最大,術(shù)后10 d 含量達(dá)到峰值,隨后驟降至術(shù)后1 d 水平。血栓調(diào)節(jié)蛋白(thrombomodulin,TM),在VEC 破壞時會大量釋放,其通過凝血酶發(fā)揮其生物學(xué)效應(yīng),還能增加蛋白C 的活化效率來發(fā)揮其抗凝作用。在大鼠深靜脈血栓(deep venous thrombosis,DVT)模型實驗中發(fā)現(xiàn),血栓自然演變過程中,模型組各時間點血漿中sTM 濃度均顯著高于對照組[13]。有學(xué)者認(rèn)為,TM 是DVT 形成的重要標(biāo)志物[14]。不少臨床研究也報道,骨外傷、骨折及關(guān)節(jié)置換術(shù)后患者,血栓組TM 水平顯著高于非血栓組[15-18]。本研究結(jié)果示:模型組未發(fā)生CRT 大鼠的TM 含量較假手術(shù)組和空白對照組顯著升高(P<0.01);模型組TM 含量較空白對照組及假手術(shù)組明顯升高(P<0.01);模型組TM 含量進(jìn)行性升高,術(shù)后4 d 含量急速上升且在術(shù)后7 d 達(dá)到最高值,隨后逐漸下降并保持著高于術(shù)后4 d 的穩(wěn)定水平。血管性假血友病因子(von Willebrand factor,vWF),在凝血過程中通過發(fā)揮橋梁作用來介導(dǎo)血小板與內(nèi)皮下膠原之間發(fā)生黏附,其也是凝血因子Ⅷ在血液中的載體。VEC 損傷時vWF 釋放入血,促使血小板與管壁相互作用,引發(fā)血小板不斷地黏集使血液處于高凝狀態(tài),最終導(dǎo)致血栓形成。動物研究發(fā)現(xiàn),兔子耳緣靜脈置入留置針后,血漿中vWF 濃度與血栓發(fā)生率成正比[9,19]。Liu 等[20]的臨床研究報道,血漿中vWF 的濃度與血栓形成正相關(guān)。本研究也發(fā)現(xiàn),模型組未發(fā)生CRT大鼠的 vWF 含量較空白對照組明顯升高(P<0.01);術(shù)后 4 d、7 d、10 d、14 d,模型組 vWF 含量較空白對照組及假手術(shù)組顯著升高(P<0.01);vWF含量隨時間逐漸升高,術(shù)后1 ~4 d 含量驟升,術(shù)后10 d 含量達(dá)到峰值,術(shù)后14 d 含量急劇下降。
本研究中,置管手術(shù)和導(dǎo)管留置直接導(dǎo)致模型組大鼠血管內(nèi)皮損傷,誘發(fā)各種促血栓分子大量釋放,這是模型組未發(fā)生CRT 大鼠TM、vWF 含量較假手術(shù)組或空白對照組升高的原因。這部分大鼠鏡下雖未見CRT,但并不排除血栓形成的可能,因早期的新鮮血栓,體積較小,很有可能已被軟化、溶解。另外,手術(shù)創(chuàng)傷介導(dǎo)的VEC 損傷,引起凝血系統(tǒng)激活及血小板活化迅速啟動,可能是模型組術(shù)后1~4 d,TF、vWF 含量驟升的主要原因。VEC 自身具有抗凝特性,其合成、分泌的TM 與血液中的凝血酶結(jié)合,并激活蛋白C,滅活凝血因子,發(fā)揮抗凝作用。因此術(shù)后早期TM 含量并沒有大幅增加。術(shù)后4 d凝血系統(tǒng)激活最為迅速,凝血酶生成增多刺激性引起VEC 釋放TM。隨著導(dǎo)管留置時間延長,血栓體積增大及不斷機(jī)化,血液流速漸緩,內(nèi)膜缺血缺氧加重,VEC 損傷進(jìn)行性加重,此時促凝因子合成釋放增加、凝血系統(tǒng)激活及血小板黏附、黏集反應(yīng)增強,因此術(shù)后1~10 d,TF、TM、vWF 含量總體上呈現(xiàn)時間依賴性上升。術(shù)后14 d,血栓已完全機(jī)化,毛細(xì)血管生成增多,新生內(nèi)皮細(xì)胞逐漸增殖,內(nèi)皮功能逐漸恢復(fù),凝血系統(tǒng)激活與血小板活化等過程減弱,VEC 釋放 TF、TM、vWF 也隨之下降。
4 小結(jié)
在血管內(nèi)皮損傷為始發(fā)因素的前提下,以VEC損傷介導(dǎo)的凝血系統(tǒng)激活、血小板活化及血液流變學(xué)改變等多種因素可能共同參與了CRT 形成,可見CRT 形成的調(diào)控網(wǎng)絡(luò)是一個極其復(fù)雜多變的動態(tài)過程。本研究發(fā)現(xiàn),TF、TM、vWF 的高表達(dá),與血管內(nèi)皮損傷程度平行,在CRT 形成過程中,可能起到關(guān)鍵作用。為進(jìn)一步在分子、細(xì)胞層面研究CRT 形成機(jī)制奠定了基礎(chǔ)。

