溫經活血湯聯合依帕司他膠囊、硫辛酸片治療糖尿病痛性神經病變寒凝血瘀證臨床觀察
趙非亞 張立辰 曹永革 劉占國 雷香娟 李雪巖 王 蘭
(河北省隆堯縣醫院內四科,河北 隆堯 055350)
糖尿病痛性神經病變(diabetic painful neuropathy,DPN)是糖尿病周圍神經病變中的一種,是以痛覺過敏、痛覺超敏和自發性疼痛為主要表現的一類神經病理性疼痛,可表現為燒灼樣疼痛、電擊樣疼痛、針刺樣疼痛或刀割樣疼痛等,尤以夜間疼痛加重,是引起患者感染、下肢潰瘍、糖尿病足壞疽等的主要危險因素,具有高致殘風險[1]。其病因復雜,發病機制尚不明確,臨床缺乏有效的治療手段,對患者的健康和生活質量造成了嚴重的影響。如何緩解疼痛是臨床亟需解決的難題。2018-01—2019-02,我們采用溫經活血湯聯合依帕司他膠囊、硫辛酸片治療DPN寒凝血瘀證患者56例,并與西醫常規治療56例對照,觀察臨床療效及對疼痛視覺模擬評分(VAS)、正中神經和腓總神經的感覺神經傳導速度(SCV)和運動神經傳導速度(MCV)的影響,結果如下。
1 資料與方法
1.1 一般資料 全部112例均為河北省隆堯縣醫院內四科門診DPN患者,按照隨機數字表法分為2組。治療組56例,男34例,女22例;年齡38~87歲,平均(59.5±11.0)歲;2型糖尿病病程5~20年,平均(11.1±3.5)年。對照組56例,男30例,女26例;年齡42~87歲,平均(57.0±10.6)歲;2型糖尿病病程7~20年,平均(12.1±3.7)年。2組一般資料比較差異無統計學意義(P>0.05),具有可比性。
1.2 病例選擇
1.2.1 西醫診斷標準 參照《糖尿病性周圍神經病理性疼痛診療專家共識》[2]診斷標準:①有明確的2型糖尿病病史;②在診斷糖尿病之后出現臨床表現,神經系統查體及神經電生理檢查證實存在的周圍神經病變;③明確的周圍神經病變解剖部位出現神經病理性疼痛;④排除其他導致痛性周圍神經病理性疼痛的原因,如頸腰椎病變、腦梗死、嚴重的血管病變、代謝性、感染性、中毒性等。
1.2.2 中醫辨證標準 參照文獻[3]辨證為寒凝血瘀證,臨床表現為肢體麻木不仁,四末冷痛,得溫痛減,遇寒痛增,下肢為著,入夜更甚,神疲乏力,畏寒怕冷,尿清便溏或尿少水腫,舌質黯淡或有瘀點,苔白滑,脈沉細澀。
1.2.3 納入標準 ①均有2型糖尿病病史符合DPN診斷標準;②中醫辨證寒凝血瘀證;③無引起上述癥狀的其他神經系統疾病;④15 d內未經DPN藥物治療者,且自愿參加研究并簽署知情同意書。
1.2.4 排除標準 ①合并有心、肝、腎和造血系統等嚴重疾病者;②惡性腫瘤患者;③過敏體質或對多種藥物有過敏史者;④妊娠期或哺乳期婦女,或患有癲癇、精神疾病無法合作者。
1.3 治療方法 2組均給予積極的糖尿病飲食、運動及口服藥物降糖治療。
1.3.1 治療組 予溫經活血湯聯合依帕司他膠囊、硫辛酸片治療。溫經活血湯藥物組成:桂枝12 g,白芍12 g,通草10 g,細辛3 g,當歸12 g,川芎10 g,桃仁12 g,紅花10 g,黃芪15 g,天麻6 g,威靈仙6 g,牛膝和(或)桑枝6 g,其中下肢以牛膝、上肢以桑枝引經,上下肢均有病變則同時加用牛膝和桑枝各6 g。日1劑,水煎2次取汁200 mL,分早、晚2次口服。依帕司他膠囊(揚子江藥業集團南京海陵藥業有限公司,國藥準字H20040840)50 mg,每日3次飯前口服;硫辛酸片(山東齊都藥業有限公司,國藥準字H20100152)0.6 g,每日1次早餐前30 min口服。
1.3.2 對照組 予常規西藥治療。維生素B1片(廣東恒健制藥有限公司,國藥準字H44020620)10 mg,每日3次口服;腺苷鈷胺片(華北制藥股份有限公司,國藥準字H13020514)0.5 mg,每日3次口服;加巴噴丁片(海南賽立克藥業有限公司,國藥準字H20080223)0.3 g,第1 d口服1次,第2 d口服2次,第3 d口服3次,之后維持此劑量服用。
1.3.3 療程 2組均治療1個月。
1.4 觀察指標 ①觀察2組治療前后神經痛的改善情況,并對其疼痛強度進行量化比較。采用疼痛視覺模擬評分法(VAS)[4],做一長度為10 cm的游動標尺,以左側端“0”代表無痛,右側端“10”代表無法忍受的劇烈疼痛,“0”與“10”之間分別代表不同級別的疼痛程度,要求患者根據自身感受的疼痛強度在標尺上以數字的形式標記出來。②比較2組治療前后神經傳導速度改善情況。采用NDI-092型肌電圖/誘發電位儀(上海海神醫療電子儀器有限公司)分別檢測上肢正中神經和下肢腓總神經的MCV、SCV。
1.5 療效標準(自擬) 顯效:臨床癥狀明顯緩解,疼痛VAS較治療前下降≥75%,神經傳導速度改善幅度超出5.0 m/s;有效:臨床癥狀有所改善,疼痛VAS較治療前下降50%~74%,神經傳導速度改善幅度增加不足5.0 m/s;無效:臨床癥狀無明顯變化或加重,疼痛VAS較治療前下降≤49%或無變化,神經傳導速度無改善或降低。
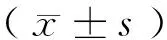
2 結 果
2.1 2組療效比較 見表1。

表1 2組療效比較 例
由表1可見,2組總有效率比較差異有統計學意義(P<0.05),治療組療效優于對照組。
2.2 2組治療前后疼痛VAS比較 見表2。
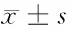
表2 2組治療前后疼痛VAS比較 分,
由表2可見,治療后2組疼痛VAS均較本組治療前降低(P<0.05),且治療后治療組低于對照組(P<0.05)。
2.3 2組治療前后神經傳導速度比較 見表3。
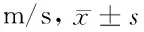
表3 2組治療前后神經傳導速度比較
由表3可見,治療后2組正中神經和腓總神經MCV、SCV均較本組治療前升高(P<0.05),且治療后治療組均高于對照組(P<0.05)。
2.4 不良反應 2組治療過程中均未發現明顯的藥物不良反應。
3 討 論
DPN發病機制錯綜復雜,其病理基礎是神經纖維的脫髓鞘改變,繼而神經出現炎性疼痛和神經傳導功能障礙[5]。通常認為高血糖是DPN的始動觸發因素。一方面,細胞外高糖環境可使蛋白質發生非酶促糖基化反應生成終末產物(AGEs),沉積在周圍血管壁,使血管基底膜增厚,管腔狹窄,導致營養神經的微血管閉塞,神經細胞缺血壞死,發生炎性反應,使神經纖維脫髓鞘改變,出現神經病理性疼痛。同時炎癥因子不但可以使β-內啡肽物質在中樞神經內生成減少,導致丘腦—垂體軸負反饋調節機制受損,對疼痛的下行傳導抑制功能減弱,疼痛傳導通路上的神經興奮性增高,痛閾下降,引起痛覺中樞敏化,而且還可以使速激肽P物質在外周神經內合成增加,而P物質的釋放又促進了神經細胞外鈣離子內流,改變了細胞膜上的電壓門控鈉離子通道[6],使外周末梢神經感受器發生敏化,擴大了疼痛刺激傳入信號的神經傳導[7],出現糖尿病痛性神經過敏。另一方面,細胞內高糖環境促使細胞超負荷工作,在細胞線粒體水平誘導超氧陰離子(O2-)的過度表達,發生氧化應激反應。產生的氧自由基除直接攻擊生物細胞膜,引起神經元細胞功能損傷外,還可進一步加強促炎因子的釋放,形成炎性反應的惡性循環,使疼痛程度加重[8]。同時細胞內多元醇代謝旁路激活,使得神經組織細胞內山梨醇堆積,引起胞內滲透壓升高,神經細胞腫脹變性壞死。且山梨醇競爭性抑制神經組織對肌醇的再攝取,使神經細胞膜合成的肌醇磷脂減少,抑制了細胞膜上Na+-K+-ATP酶的活性,阻滯了細胞膜的去極化,從而影響了神經沖動的正常傳導,使神經傳導速度減慢。
目前,DPN的治療手段比較單一,主要是從DPN的發病機制入手,通過使用不同作用機制的藥物來阻斷DPN炎性過程的某一環節緩解疼痛。本研究對照組中腺苷鈷胺對神經髓鞘中脂蛋白的合成有重要意義,是形成完整神經鞘脊髓纖維所必需的營養物質,還可以使巰基酶處于活性狀態,避免氧自由基的損傷,促進神經軸索、髓鞘再生[9]。維生素B1是糖代謝中的重要輔酶,能夠為神經組織修復提供所需的營養物質和能量,保證神經軸索結構蛋白的正常輸送,避免了神經傳導物質的減少,恢復了神經間的正常傳導[10]。加巴噴丁通過提高γ-氨基丁酸(GABA)介導通路的抑制性輸入,使受損的中樞神經無法進行異常放電活動,并對N-甲基-D-天冬氨酸(NMDA)受體產生拮抗作用,阻斷鈣離子通道,抑制周圍神經的痛覺傳導而達到止痛效果[11]。由于該方法并沒有對DPN的病因進行阻斷與治療,因此也不能阻止DPN的進一步發展。
DPN屬中醫學“消渴痹證”范疇。其病因病機為消渴日久,陰虛燥熱,氣陰兩虧,日久陰損及陽,寒濁內生,久病入絡留瘀,阻滯脈道,氣血運行不暢“不通則痛”。臨床多以寒凝血瘀證為主。治宜補血溫經散寒,活血化瘀止痛。溫經活血湯由當歸四逆湯加減化裁而來,方中當歸補血活血,桂枝溫經通脈,兩者為君藥以養血溫經通絡。白芍伍桂枝調和營衛;細辛外溫經脈,內溫臟腑,通達表里以散寒邪,助桂枝溫經散寒通脈,二者為臣藥。黃芪甘溫補氣;川芎行氣活血,止痛;桃仁、紅花活血化瘀;威靈仙辛散溫通,性善走竄,能通行十二經絡而止痛;天麻熄風止痙,除肢體拘攣麻痛,共為佐藥。桑枝、牛膝為引經藥;通草淡滲利濕消腫,又能防桂枝、細辛之燥熱,更能入經通脈,開路除障,為引經藥牛膝、桑枝直達病所提供方便之門。現代藥理研究表明,當歸四逆湯有抗凝、改善微循環、擴張血管及降低血液黏稠度的作用[12],能夠降低細胞因子及炎癥介質的釋放而發揮抗炎鎮痛效果,對糖尿病周圍神經病變起到保護作用[13];黃芪可以調控血糖,有神經保護、鎮痛鎮靜、抗炎作用,能夠降低細胞內質網氧化應激反應水平,減少氧自由基生成[14];川芎、桃仁、紅花活血化瘀,可以減輕血管內皮及神經細胞的充血水腫,緩解炎性反應,并抑制糖基化物質在神經血管的沉積,增加病變神經的血氧供應,促進損傷神經的修復[15];天麻具有抗驚厥、鎮痛、擴血管、增加血流量、抗炎消腫的功效,還能使血中谷胱甘肽過氧化物酶(GSH-Px)的活性升高,起到抗氧化作用,減少活性氧簇的釋放[16];威靈仙對神經痛能夠起到良好的鎮痛效果[17]。治療組中硫辛酸片能夠阻止蛋白質的非酶促糖基化反應,并抵抗脂質過氧化現象,有效抑制了強氧化物生成,降低了炎癥因子水平,促進了內源性抗氧化劑(谷胱甘肽、超氧化物歧化酶等)的再生,避免氧化應激反應對神經組織的損傷,促進神經元細胞髓鞘及軸突再生[18]。依帕司他能夠抑制醛糖還原酶活性,降低神經組織細胞內山梨醇水平,恢復神經細胞內肌醇含量,維持神經細胞膜的生理穩定性,增強Na+-K+-ATP酶活性,提高了神經傳導速度。三者聯合應用能夠從DPN病因入手,通過多環節有效干預,阻斷了高糖對神經的損傷,延緩了病情進展,療效顯著,作用持久。
由于高糖環境下“糖毒”對周圍神經組織的損傷,神經細胞的炎性反應使得神經纖維脫髓鞘改變,破壞了神經解剖結構的完整性,影響了神經傳導速度,且炎癥因子的釋放刺激受損神經,從而出現神經病理性疼痛。臨床治療也應以消除神經組織炎癥,促進神經修復,消除疼痛,恢復神經傳導為目的。因此,本研究以疼痛VAS評分及神經傳導速度作為療效指標進行治療前后觀察。結果顯示,治療組總有效率明顯高于對照組(P<0.05);治療后2組神經痛疼痛VAS均降低(P<0.05),且治療組低于對照組(P<0.05);治療后2組正中神經、腓總神經MCV、SCV均提高(P<0.05),且治療組均高于對照組(P<0.05)。說明2組用藥方案均能通過各自藥物的不同作用機制,阻斷痛性神經病變炎性過程的某個環節,從而發揮相應的治療效果,達到緩解疼痛、提高神經傳導速度的目的。而治療組藥物組合協同優勢更明顯,療效優于對照組。此外,2組均用藥安全,無藥物不良反應。
綜上所述,DPN的發生是多種致病因素共同作用的結果,而這些發病機制是交叉融合的。西藥藥理機制明確,作用位點精準,中藥從整體觀念出發,辨證施治,合理配伍組方,具有多成分、多靶點、多途徑的整體調節優勢,中西藥聯合應用,能夠取長補短,療效更好。

