TAT-SOD 在長期保藏的重組畢赤酵母中表達的條件優化
李孔翰, 陳玲琳, 周建森, 劉樹滔
(福州大學 生物工程研究所,福建 福州 350002)
超氧化物歧化酶 (Superoxide Dismutase, 簡稱SOD)是一種含金屬的、人體最重要的抗氧化酶,它在維持機體自由基產生和消除之間的動態平衡方面起著重要作用[1]。 SOD 可分為 CuZn-SOD、Mn-SOD、Fe-SOD 等 3 種類型。 其中 CuZn-SOD 分布最廣,廣泛分布于細胞質、細胞核、過氧化物酶體及線粒體膜間隙中, 對防御內源性和外源性活性氧毒性、預防衰老以及炎癥等方面有重要意義[2-5]。 目前CuZn-SOD 雖然已在食品、醫藥、化妝品等方面有所應用,但由于它是大分子蛋白質,細胞膜通透性差。這限制了SOD 的實際應用。 TAT-SOD 是TAT 蛋白轉導結構域與CuZn-SOD 的融合蛋白質, 其中的TAT 片段可實現蛋白質的跨膜轉導功能[6]。 TATSOD 作為獨特的新型抗氧化酶,改善了細胞膜通透性差的問題,因此具有較大的應用潛力[7]。
巴斯德畢赤酵母作為甲醇營養酵母,近年來被公認為最優秀、應用最廣泛的外源基因表達系統之一[8]。 作者所在實驗室的陳瑩等 2007 年構建了TAT-SOD 的重組畢赤酵母表達菌株,實現了TATSOD 在該菌株的高水平表達[9]。 由于發酵條件(包括pH 值、培養溫度、溶解氧、甲醇濃度、誘導時間等)的優化是提高外源蛋白質在畢赤酵母表達水平的重要手段, 陳躬瑞等對搖瓶發酵條件進行優化,使SOD 酶活水平從 289 U/mL 提高到 475 U/mL[10]。 類似,張海玲等使用畢赤酵母密碼子的偏好性構建了能高效分泌表達人源CuZn-SOD 的畢赤酵母工程菌,用來優化表達以提高產量[11]。鄭屹峰等通過搖瓶實驗,研究了不同因素對人CuZn-SOD 在畢赤酵母中表達的影響[12]。 但這些研究對SOD 表達優化的內在機制, 如目的基因轉錄水平的差異尚未深入分析。 另外,表達菌株可能因長期保藏而發生退化,目前很少對長期保藏菌株表達目的蛋白質的優化條件進行研究。 作者以2007 年構筑并長期保藏在-20 ℃的TAT-SOD 重組畢赤酵母菌作為出發表達菌株,研究搖瓶實驗的誘導劑體積分數、誘導溫度、初始pH 等因素對發酵菌株的生物量、TAT-SOD 的蛋白質表達水平和酶活的影響, 并通過熒光定量PCR 測定目的基因的mRNA 的表達水平等方法分析優化表達的內在機制,以期更大程度地獲得目的蛋白質,為TAT-SOD 的產業化生產條件提供參考。
1 材料與方法
1.1 菌種與質粒
-20 ℃低溫長時間保存表達TAT-SOD 菌株Pichia pastoris X33:福州大學生物工程研究所提供。
1.2 儀器設備與藥品
高速離心機Avanti TMJ-251:日立公司;紫外分光光度計型號U-1900:日本HITACHI 公司;蛋白質電泳儀: 日本 ATTO 公司; 恒溫培養振蕩器(ZHWY-200B):上海智城分析儀器有限公司;Yeast Extract 和 Tryptone:OXOID 公司;鹽酸羥胺、對氨基苯磺酸、甲萘胺、冰醋酸、甘油、葡萄糖等:均為分析純, 國藥集團化學試劑有限公司; 黃嘌呤氧化酶:Roche Diagnlstics 公司。
1.3 培養基
種子液培養基YPD(組分g/L):酵母膏10,蛋白胨20,葡萄糖10;搖瓶誘導培養基(組分g/L):酵母膏10,蛋白胨 20,葡萄糖 10。 YPDM 培養基:體積分數0.5%~3.0%甲醇;固體培養基在YPD 培養基中加入質量分數1.5%瓊脂粉。
1.4 實驗方法
1.4.1 菌種的活化及培養方法 菌種活化步驟是將菌株涂布在含有Zeocin 的YPD 固體培養基上活化,在30 ℃條件生長24~36 h,將平板上的單菌落平板劃線或者在試管中斜面劃線,在30 ℃生長24~36 h 后在4 ℃冰箱保存。
搖瓶培養:4 ℃冰箱中取出保存菌株接種于100 mL YPD 種子液培養基三角瓶中培養 (裝液量25 mL),同時加入體積分數0.1% Zeocin,培養至一定濃度以體積分數1.0%轉接于含有0.1%Zeocin 的YPDM 誘導培養基三角瓶,15 h 后用誘導劑甲醇進行誘導,甲醇誘導每24 小時補加一次,誘導前后每24 小時取樣, 共培養 135~159 h。 搖瓶裝液量為100 mL(500 mL 三角瓶)[13],于 30 ℃轉速 200 r/min搖床培養。
1.4.2 比色分析法測定菌體濃度 使用比色法測定菌體濃度, 以紫外分光光度計600 nm 波長處的光密度值 OD600表示[14]。 從斜面將接種體積分數1.0%畢赤酵母于25 mL YPD 培養基中搖瓶發酵培養,每隔2 小時取樣,測量樣品菌體濃度OD600值,直至數值趨于穩定為止。 共持續32 h,取樣16 次,以OD600為縱坐標, 時間為橫坐標作種子液培養基生長曲線。將OD600為15,搖瓶培養20 h 的種子液按接種體積分數1.0%接種于YPD 誘導培養基中,確定誘導培養基生長曲線。 每次試驗都有一次重復試驗,其中每批試驗的各個梯度都做了3 個平行。
1.4.3 超氧陰離子自由基清除法測定酶活及不同表達條件目的蛋白質SDS-PAGE 分析 SOD 酶活測定:鹽酸羥胺法測定[15]。 通過黃嘌呤氧化酶對黃嘌呤的催化作用, 可以產生超氧陰離子自由基,同時使鹽酸羥胺氧化成亞硝酸鹽,亞硝酸鹽在對氨基苯磺酸與甲萘胺的共同作用下表現紫紅色。 采用紫外分光光度計測定了530 nm 處的吸光度。 當樣品中含有抑制超氧陰離子自由基生成的組分時,樣品中的亞硝酸鹽含量降低。 最后測量吸光值時,樣品的氧化活性越高其吸光值就越低。 因此,樣品抗氧化活性可以用分光光度法測定。
樣品酶活測定取離心發酵上清液(4 ℃、12 000 r/min,5 min); 發酵液上清液的 SDS-PAGE 分析及目的蛋白質相對分子質量確定的具體步驟參照文獻[15]。 采用SPSS 統計分析軟件進行數據處理,每組重復3 次,3 次測定結果的平均標準偏差不大于±10%。實驗結果做3 個平行,結果標準偏差±5%,否則不予使用。
1.4.4 目的蛋白質誘導表達測定 作者以Invitrogen 公司的畢赤酵母表達說明書為參考,先從平板上挑取重組菌株置于YPD 種子液培養基中,30 ℃振蕩培養20 h 后, 按1.0%的接種體積分數轉接至100 mL 的YPDM 誘導培養基中培養。 加入體積分數1.0%甲醇誘導,30 ℃搖瓶培養, 每隔24 小時取樣并添加甲醇作為誘導劑, 在誘導4 d 后將發酵液收集, 進一步離心后取上清液做SDS-PAGE實驗。
1.4.5 TAT-SOD 基因的熒光定量PCR 分析 采用UNIQ-10 柱Trizol 總RNA 提取試劑盒提取表達菌株總RNA, 使用第一鏈cDNA 合成試劑盒合成的cDNA 進行定量PCR 試驗, 試驗方法按照試劑盒說明書進行。 根據TAT-SOD 基因序列設計定量PCR的引物 SOD-F2 (5′-TCAACCCATTGTCCAGAAAG C-3′)和 SOD-R2(5′-GGTCACCAGACAAAGAGAT AACAGA-3′)。 定量 PCR 采用 ABI Stepone plus 型熒光定量 PCR 儀, 實驗反應體系為:0.4 μL 的引物F2(10 mmol/L),0.4 μL 的引物 R2(10 mmol/L),10 μL 的 SYBR Green qPCR Master Mix (2X),2 μL模板 cDNA,,加無菌水至 20 μL。 定量 PCR 擴增程序按照標準程序為:95 ℃預變性3 min;95 ℃變性5 s;60 ℃退火加延伸 30 s;45 個循環,其中融解曲線的程序溫度為 65~95 ℃。 實驗所用試劑為SybrGreen SG Fast qPCRMaster Mix 購自 BBI 公司,相對表達量計算采用 2-△△CT法。
2 結果與討論
2.1 種子液的生長曲線
比色分析法測定菌體濃度從而制作生長曲線。從斜面將菌體接種于搖瓶培養后,每隔2 小時取樣測量菌體濃度,結果見圖1。 從圖1 可知,種子液在搖瓶培養 18~22 h 之間, 即 OD600在 10~21 范圍內時,菌體生長處于指數期且濃度較高,比較合適接種到誘導培養基中。
2.2 菌株在YPDM 誘導培養基的生長曲線
誘導時需要較強的菌體活力與一定菌體濃度,因此將 OD600為 15, 搖瓶培養 20 h 的 YPD 種子液按接種體積分數1%接種于YPDM 誘導培養基中,并每隔2 小時 取樣,使用比色分析法測定菌體濃度得到生長曲線。 從圖2 可以看出, 菌體在培養10~16 h 為指數期,為得到一定菌體濃度與較高菌體活力,在培養 12~16 h(OD600為 5~17 范圍內)時誘導較為合適。

圖1 種子液的生長曲線Fig. 1 Growth curve of seed broth

圖2 菌株在YPDM 培養基的生長曲線Fig. 2 Strains growth curve in YPDM medium
2.3 誘導劑體積分數對目的蛋白質表達水平的影響
在30 ℃搖床培養15 h 后, 每天加入不同體積分數的甲醇進行誘導。 誘導劑體積分數分別為0.5%、1.0%、2.0%、3.0%。誘導開始及隨后的每24 小時取樣,測定樣品菌體濃度和酶活,并進行上清液SDS-PAGE 分析,結果見圖 3。
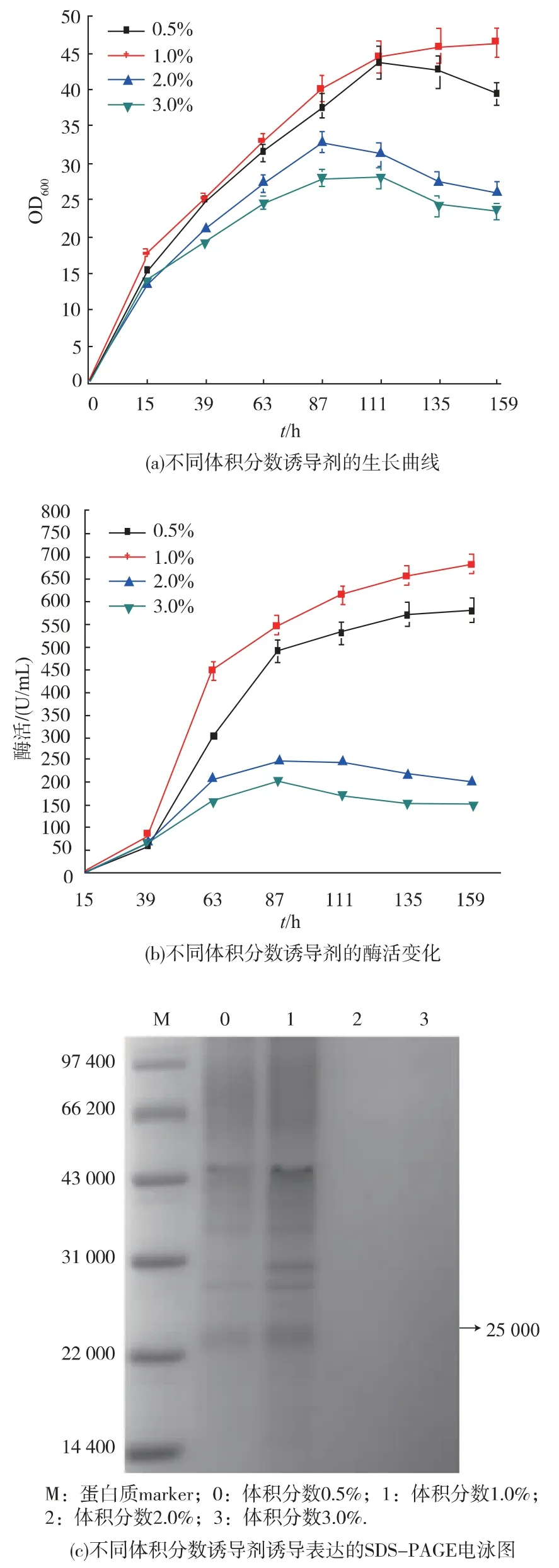
圖3 不同體積分數誘導劑的生長曲線、 酶活變化及SDS-PAGE 電泳圖Fig. 3 Effect of different inducer concentration on cell growth, enzyme production and SDS-PAGE result
從圖 3(a)和圖 3(b)可看出,當誘導劑體積分數為1.0%時,樣品的菌體濃度達到最高,酶活達到最高。經 SPSS 軟件分析,圖3(a)各梯度濃度菌體生長 159 h 時 F 值為 178.90,圖 3(b)各梯度濃度酶活159 h 時 F 值為 885.98,查表得 F0.01(3,4)=16.69,各組顯著差異(P<0.05)。由此可見,誘導劑甲醇體積分數對菌體濃度和SOD 酶活的影響顯著。誘導劑的每天補加量大于體積分數1.0%時,前期菌體生長和蛋白質表達差異不明顯,但后期酵母可能因甲醇中毒導致生長和表達蛋白質受到抑制;每天補加量少于體積分數1.0%時菌體生長較慢, 酶活也提高緩慢。因為畢赤酵母以誘導劑甲醇為其惟一碳源時,若甲醇體積分數過低將限制菌體生長。 從圖3(b)可看出,每天補加體積分數1.0%甲醇在誘導111 h 后增加不明顯。 圖 3(c)的 SDS-PAGE 結果也可以看出,試驗中誘導劑體積分數為1.0%時最佳,體積分數過低限制菌體生長,影響目的蛋白質的表達;在此體積分數以上目標蛋白質的表達逐漸下降,可能是由于畢赤酵母以甲醇為惟一碳源。 其代謝產物甲醛和過氧化氫的積累對畢赤酵母有毒害作用[16],因此后續實驗的誘導時間定為111 h, 每日加入體積分數1.0%甲醇進行誘導。
2.4 發酵初始pH 值對目的蛋白質表達水平的影響
為了調整YPDM 誘導培養基的pH 值, 使用檸檬酸緩沖液和磷酸緩沖液將初始pH 值分別調為4.0、5.0、6.0、7.0、8.0。 將酵母于 30 ℃搖床培養,在15 h 后用體積分數1.0%甲醇持續進行誘導159 h,誘導前和誘導后每 24 小時取樣測定樣品, 培養基pH 變化見表1,最終菌體濃度、酶活和SDS-PAGE電泳圖見圖4。
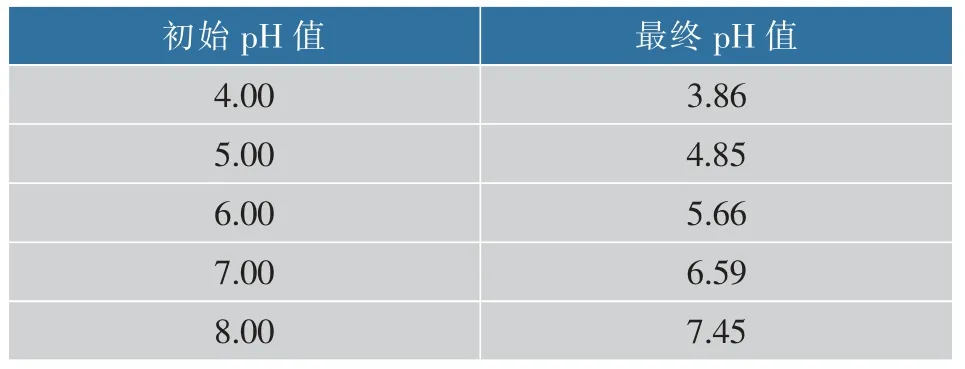
表1 不同 pH 值培養基在培養前后 pH 值的變化Table 1 The change of pH value in different pH medium before and after fermentation

圖4 不同初始pH 值的生長曲線、酶活變化及SDS-PAGE電泳圖Fig. 4 Effect of different initial pH value on cell growth,enzyme production and SDS-PAGE result
由表1 可知, 使用緩沖溶液可以將pH 值穩定在一定范圍,說明實驗結果有一定參考價值。 各梯度初始 pH 值得到159 h 酶活數據經 SPSS 軟件分析得 F 值為 946.64,查表 F0.01(4,5)=11.39,各組差異顯著(P<0.05)。 這表示不同初始pH 值對菌株酶活、目的蛋白質表達水平有較大影響。比較圖4(b)中各梯度初始pH 所對應表達酶活,在初始pH 值為5.0以下時酶活很低,pH 值為 7.0 時酶活最高。 從圖4(a) 可以看出,初始 pH 值小于 5.0 時菌株可以生長但比較緩慢,在pH 6.0~8.0 時生長較快,說明該菌株有較強的pH 適應性。 圖4(c)也說明目的蛋白質表達受不同初始pH 影響明顯,隨著pH 值的升高,電泳目的條帶也逐漸增粗,pH 值達到6.0~8.0 后,繼續提高pH 值對目的蛋白質表達水平影響不大,初始pH 值達到7.0 后蛋白質表達較好。 綜上可知,相比于菌體生長情況, 不同初始pH 范圍對酶活和蛋白質表達有較大影響,因此以7.0 為最佳初始pH 值。
2.5 誘導溫度對目的蛋白質表達水平的影響
畢赤酵母通常在 30 ℃時利于外源蛋白質表達,當溫度高于 32 ℃時,酵母的外源蛋白質表達受到較大影響。 在上述優化條件基礎上確定誘導溫度,分別選取在 28、30、32 ℃共3 個溫度培養菌株,并使用體積分數1%甲醇誘導111 h,測定最終菌體濃度(OD600)和酶活,結果見圖 5(a)和圖 5(b),培養上清液蛋白質電泳圖見5(c)。
SPSS 軟件結果顯示,F =157.65,F0.01(2,3)=30.82,各組間差異有顯著性(P<0.05),表明溫度對目標蛋白質的表達有顯著影響。 當誘導溫度為30 ℃時,酶活性和目標蛋白質表達水平最高。
從圖5(a)可以看出,在試驗的 3 個溫度下,隨著溫度的升高,菌體生長加快,在 30 ℃和 32 ℃得到較高的菌體濃度,在30 ℃菌體生長最好。 從圖5(b)可以看出,在 30 ℃時,測得的酶活最高,在 32 ℃時酶活降低較多。 圖5(c)電泳結果說明,30 ℃時菌體外源蛋白質表達最大。 雖然畢赤酵母在 28~32 ℃時菌體均迅速生長,但低的誘導溫度使菌體濃度和表達外源蛋白質不足,高溫下外源蛋白質表達受到抑制。 所以選取30 ℃作為TAT-SOD 表達菌株的生長溫度和最佳誘導表達溫度。
2.6 目的蛋白質誘導表達最終優化條件測定
TAT-SOD 酵母菌株X33 搖瓶試驗得到菌體濃度和SOD 酶活見圖6(a),上清液菌體樣品SDS-PAGE見圖 6(b)。 確定發酵條件為:經過 20 h 搖瓶培養OD600為15 的YPD 種子液按接種體積分數1.0%接種到YPDM 誘導培養基中,在優化搖瓶發酵條件下(培養15 h 時誘導,誘導劑體積分數1.0%,誘導溫度 30 ℃,初始 pH 值為 7.0),誘導 159 h 后收樣,發酵液上清液酶活水平為753 U/mL, 較初始提高5.1倍。
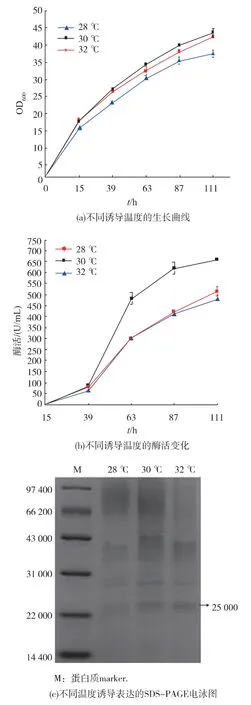
圖5 不同誘導溫度的生長曲線、 酶活變化及SDS-PAGE電泳圖Fig. 5 Effect of different inducing temperature on cell growth, enzyme production and SDS -PAGE result
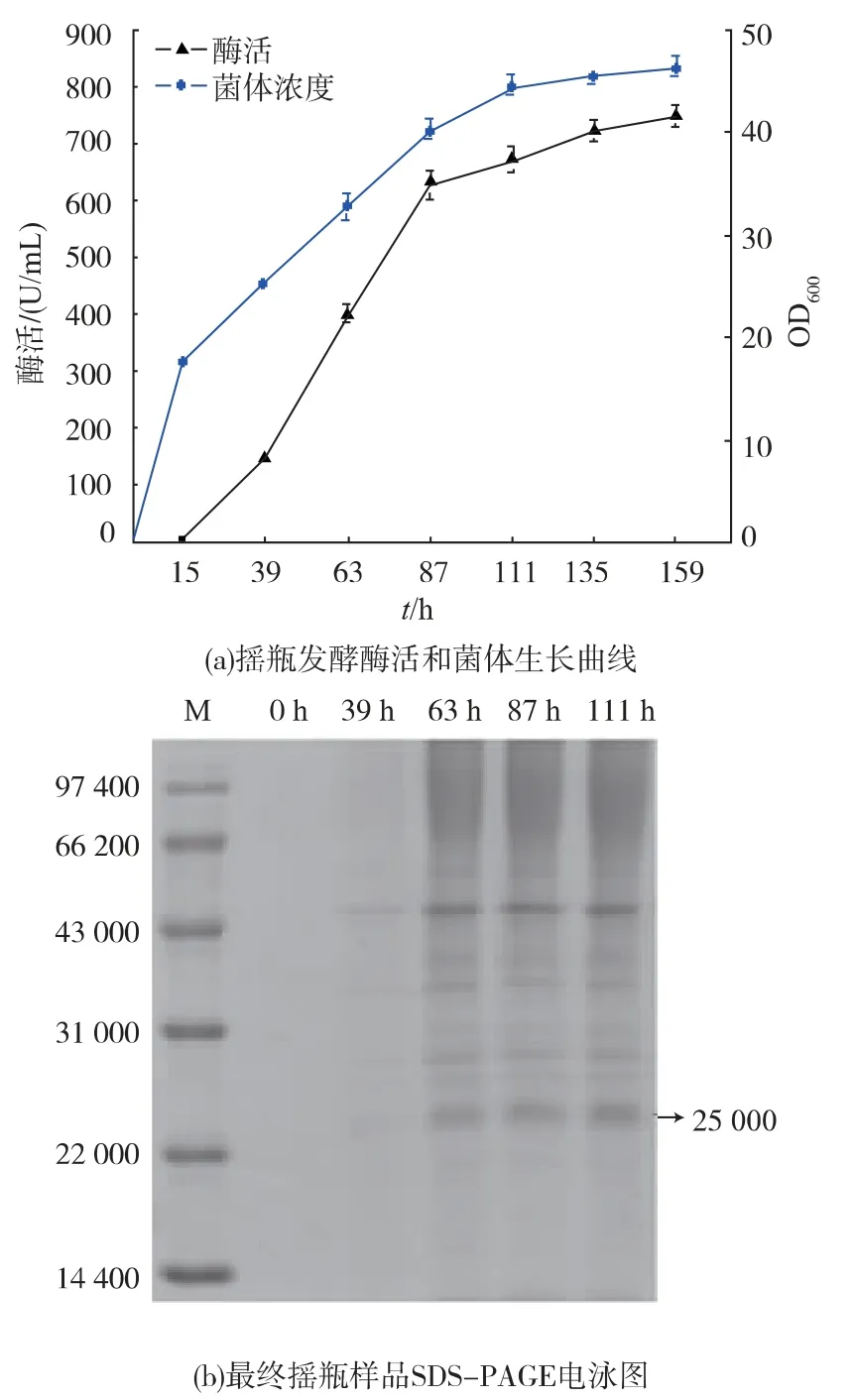
圖6 搖瓶發酵酶活、 菌體生長曲線和樣品SDS-PAGE 電泳圖Fig. 6 The enzyme production, cell growth and SDSPAGE result of induced expression in shake flask fermentation
從圖6(a)可以看出,菌體生長隨著酶活分泌同步增加。在111 h 之后菌體生長與酶活變化不大,最終誘導159 h 搖瓶上清液酶活為753 U/mL。 從圖6(b)的電泳圖也可以清晰看到,電泳條帶隨誘導時間逐漸變粗,在誘導87 h 后電泳條帶不變,目的蛋白質表達提高不明顯。 因此該菌株最佳搖瓶誘導時間為111 h,可以避免發酵后期染菌的風險。
2.7 pH 值對TAT-SOD 基因的轉錄水平的影響分析
誘導培養基發酵培養酵母,研究隨著不同初始pH 變化TAT-SOD 基因的表達規律。熒光定量PCR選擇內參基因actin 對目的基因相對定量的分析結果, 并 3 次重復實驗得到 2-△△CT值進行單因素方差分析。 定量PCR 結果顯示,在不同 pH 值培養下菌株中TAT-SOD 基因的誘導表達情況不相同。從圖7可知,以菌株在pH 4.0 時的樣品作為對照組,pH 在5.0 時表達mRNA 與對照組的差別不顯著。 而pH為 6.0、7.0、8.0 時表達 mRNA 分別是對照組的2.4 倍、3.5 倍和 3.1 倍, 各組跟對照組有顯著差異(P<0.05),經 SPSS 軟件分析得 F 值為 657.32,查表 F0.01(4,5)=11.39。 并認為有顯著的組間差異,這說明不同pH 環境對菌株的基因轉錄表達水平有顯著影響。
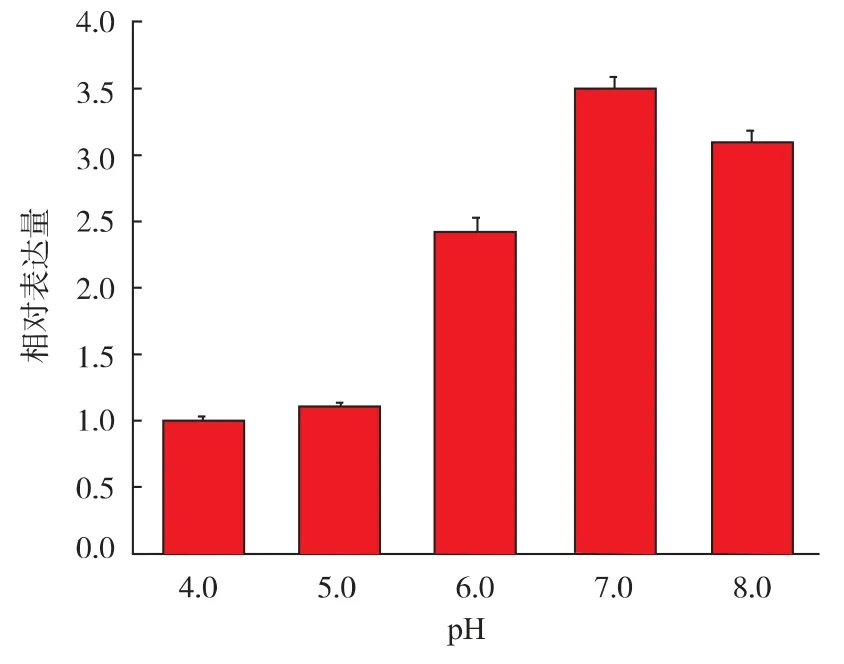
圖7 菌株在不同 pH 值培養下TAT-SOD 基因的相對表達量Fig. 7 Relative expression levels of TAT-SOD in Pichia pastoris grown at different initial pH value
圖7 可以看出,X33 菌株在不同 pH 條件下,TAT-SOD 基因隨著pH 值的升高均有一定倍數的上調表達。 其中在pH 7 時上調表達的倍數最高,是對照組 pH 4.0 上調倍數的 3.5 倍。 在 pH 8 下,基因的表達量比pH 7 時略低。在對照組pH 4.0 中,TATSOD 基因的表達量要比其它組顯著變低。 而不同初始pH 條件下基因表達趨勢與最終得到的酶活趨勢基本相符合。 這表明除了菌體生長濃度影響目的蛋白質在發酵液中的表達水平, 不同pH 下基因轉錄水平差異也較大地影響了菌株的TAT-SOD 的表達程度。
3 結 語
作者采用經低溫長時間保存的畢赤酵母表達菌株, 使含有TAT-SOD 基因的菌株在優化搖瓶發酵條件下成功地胞外分泌表達TAT-SOD。分泌出目的蛋白質可以改善大分子蛋白質SOD 細胞膜通透性[17],實現將外源SOD 輸送進入細胞內部協助相應的生命活動,清除胞內外自由基,增加超氧化物歧化酶SOD 在臨床上的使用范圍。 可能是誘導表達TAT-SOD 可提高畢赤酵母的抗衰老能力,長期低溫保存的畢赤酵母在保藏過程中沒有出現退化現象,仍可保持較強的目的蛋白質表達能力。
畢赤酵母表達外源蛋白質的主要發酵條件包括誘導時間、甲醇體積分數、pH 值、培養溫度等因素。優化搖瓶發酵條件,誘導劑體積分數1.0%,誘導溫度 30 ℃,YPDM 培養基, 初始 pH 值為 7.0 條件下,發酵上清液酶活水平為753 U/mL,未優化酶活水平為148 U/mL, 較未優化初始酶活提高5.1 倍;初始pH 值為7.0 時表達水平提高3.4 倍;后期經過5 L 發酵罐發酵, 最終得到TAT-SOD 酶活達到14 934 U/mL,是搖瓶水平的19.8 倍,說明長期保藏的重組菌株仍適合表達。 熒光定量PCR 試驗表明,在轉錄水平差異上, 不同pH 條件下目的蛋白質表達水平受到基因轉錄水平和菌體生長的雙重影響,而且前者的影響強于后者。
研究發酵條件是提高外源蛋白質在畢赤酵母表達水平的重要手段。 從本研究數據來看,TATSOD 的畢赤酵母表達菌株,經長時間保存后仍可保持較強的活力; 而且誘導初始pH 值對目的蛋白質的影響顯著。 這些結果為該菌株的工業生產提供更多數據,有助于降低生產成本,更大程度上獲得目的蛋白質。

