南瓜中游離葉黃素的制備及抗氧化活性
孟繁玲 , 張 宇 *, 徐少博 , 趙 宏 , 王宇亮 , 趙芷萌 , 張 曼
(1. 佳木斯大學 黑龍江省新藥創制與藥效毒理評價重點實驗室,黑龍江 佳木斯 154007;2. 佳木斯大學 藥學院,黑龍江 佳木斯 154007;3. 黑龍江省第二醫院,黑龍江 哈爾濱 150010)
南瓜Cucurbita moschata Duch.是雙子葉被子植物門葫蘆科南瓜族南瓜屬植物,俗稱金瓜、倭瓜等[1],我國古代早就有關于南瓜食療保健作用的記載。 在中醫史書《本草綱目》中,李時珍將南瓜與上品藥材靈芝放在一起,稱其具有“補中益氣”之效[2]。南瓜營養豐富,富含粗纖維、維生素、β-胡蘿卜素,葉黃素等成分[3],其中葉黃素成分與許多生物活性密切相關。 葉黃素又名“植物黃體素”,是一種天然類胡蘿卜素類色素[4]。 大量研究表明,葉黃素在保護視覺、預防老年性黃斑變性、防治動脈硬化、增強免疫力等方面起著重要作用[5-8]。 南瓜中的葉黃素主要以葉黃素酯的形式存在,不易被人體吸收,需要經過皂化處理才能獲得人體所能吸收的游離態葉黃素[9-10]。 目前,葉黃素的研究主要集中在以萬壽菊為原料提取,且對游離葉黃素的制備和純化方面報道較少[11-13],限制了葉黃素的開發應用。 本研究以氫氧化鉀-甲醇溶液為皂化溶劑, 采用響應面法優化制備游離葉黃素的工藝參數, 并進行進一步的純化,以期為葉黃素的深入研究和南瓜的綜合利用提供參考。
1 材料與方法
1.1 實驗設備與材料
KQ-250DE 型數控超聲波清洗器: 購自昆山市超聲儀器有限公司;RE-2000A 旋轉蒸發器:購自上海亞榮生化儀器廠;FA2004 型電子天平:購自上海舜宇恒平科學儀器有限公司;DL-5-B 低速大容量離心機: 購自上海安亭科學儀器廠;LC-5510 型高效液相色譜儀: 購自北京東西分析儀器;Q Exactive質譜儀:購自美國Thermo 公司。
紅栗南瓜:干燥后粉碎,過60 目篩,貯存于實驗室備用;無水乙醇、乙酸乙酯、正己烷、石油醚:均為分析純, 天津市科密歐化學試劑有限公司產品;甲醇:色譜純,天津市科密歐化學試劑有限公司產品;硅膠H:青島海洋化工有限公司產品;無水硫酸鈉:天津市凱通化學試劑有限公司產品;氫氧化鉀:天津市凱通化學試劑有限公司產品;葉黃素標準品(純度 90%)、LOT(F03N8M46350):上海源葉生物科技有限公司產品。
1.2 實驗方法
1.2.1 游離葉黃素的制備
1) 南瓜葉黃素酯的提取 準確稱取南瓜粗粉60 g,加入乙酸乙酯-無水乙醇(體積比為 2∶1)混合溶劑,超聲提取。 提取結束后抽濾,濾液于4 000 r/min下離心10 min,收集上清液,減壓濃縮干燥,得葉黃素酯粗品。
2)南瓜葉黃素酯的皂化 參考胡建中的方法[14],用2 mL 正己烷將上述步驟中得到的葉黃素酯復溶,用一定濃度的KOH-甲醇溶液與其混合,比例1∶1,避光皂化。 于皂化結束時向反應體系注入一定體積雙蒸水,補充正己烷,萃取,取上層用無水硫酸鈉干燥,減壓濃縮,揮干溶劑備用。
1.2.2 葉黃素的純化 采用硅膠柱色譜法對葉黃素進行純化。 以石油醚為溶劑進行濕法裝柱,將適量1.1.2 得到的產品用少量溶劑溶解, 用膠頭滴管沿柱壁緩緩加入。 上樣完成后,用適量的石油醚和乙酸乙酯混合溶劑進行梯度洗脫, 收集目標組分,減壓濃縮,揮干溶劑,得純化產品。
1.2.3 葉黃素的高效液相色譜和質譜分析
1)高效液相色譜條件 HPLC 分析條件:ODSC18 色譜柱(4.6 mm×250 mm,5 μm),流動相為甲醇(體積分數 100%), 流量 0.5 mg/mL, 檢測波長450 nm,柱溫30 ℃,進樣量 10 μL。
2)質譜條件 MS 條件:采集方式為單離子檢測掃描(Single ion monitoring,SIM)與平行反應監測掃描(Parallel reaction monitoring,PRM);離子極性為正離子;離子化方式為電噴霧離子化;檢測對象葉黃素 m/z=568;毛細管電壓 3.0 kV;鞘氣壓力3×106Pa,輔助氣壓力 1×106Pa;離子傳輸管溫度320 ℃,加熱(蒸發)溫度 350 ℃。
1.2.4 葉黃素標準曲線繪制 準確稱取葉黃素標準品5.00 mg,用甲醇定容于25 mL 棕色容量瓶中,制備成 0.2 mg/mL 的標準溶液。 分別取 1、2、3、4、5 mL標準溶液用甲醇定容于10 mL 容量瓶中,配制成質量濃度分別為 0.02、0.04、0.06、0.08、0.10 mg/mL 的系列標準溶液,按照HPLC 色譜條件,每個系列質量濃度進樣3 次,取平均值,以葉黃素系列標準溶液質量濃度為橫坐標, 相應吸收峰面積為縱坐標,繪制葉黃素標準曲線,如圖1 所示,得到回歸方程y=97.47x+0.15,R2=0.999 8。
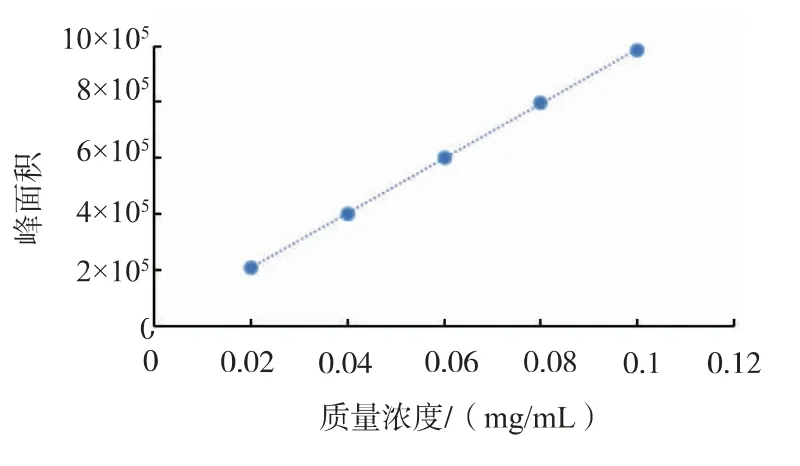
圖1 葉黃素標準曲線Fig. 1 Lutein standard curve
1.2.5 樣品中游離葉黃素的測定 取皂化后產品,溶劑復溶, 按1.2.4 葉黃素標準曲線的測定方法測定峰面積,根據標回歸方程求得游離葉黃素質量濃度。 南瓜提取物中游離葉黃素得率按公式(1)計算:

式中:c 為樣品溶液的濃度(mol/L);V 為復溶溶劑體積(mL);m 為南瓜粗粉質量(g)。
1.2.6 單因素實驗設計 將葉黃素酯提取液減壓濃縮干燥,在其他條件不變的情況下,以游離葉黃素得率為指標, 考察質量濃度分別為 5、10、20、30、40 g/dL;皂化溫度為 25、35、45、55、65 ℃;皂化時間為 2、5、8、11、14 h 條件下各因素對南瓜中游離葉黃素得率的影響,以確定最優皂化條件。
1.2.7 響應面法實驗設計 為優化南瓜中游離葉黃素的制備工藝條件,根據Box-Behnken 試驗設計原理,在單因素試驗基礎上,共設計17 個試驗點,12 個分析點,5 個零點以估計誤差, 選取皂化液質量濃度A、皂化溫度B、皂化時間C 為自變量,以游離葉黃素得率Y 為響應值,設計三因素三水平的優化試驗,試驗因素與水平設計見表1。
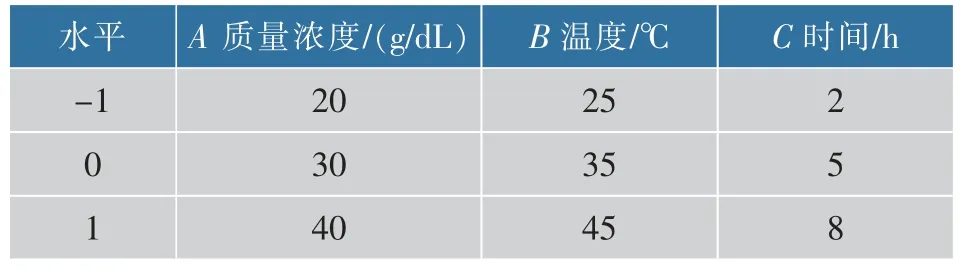
表1 響應面試驗因素與水平Table 1 Response surface test factors and levels
1.2.8 游離葉黃素的抗氧化能力測試
1) 南瓜中游離葉黃素清除DPPH·的能力 取不同質量濃度南瓜葉黃素乙醇溶液1 mL 于試管中, 分別加入 2×10-4mol/L DPPH·乙醇溶液 1 mL,搖勻,暗處靜置30 min,乙醇為空白對照,517 nm 處測吸光度A,按公式(2)計算南瓜葉黃素對DPPH·的清除率:
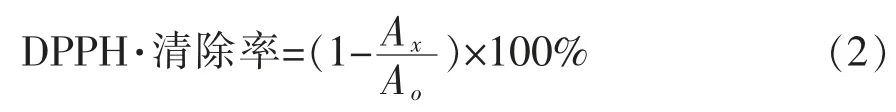
式中:Ax為樣品溶液的吸光度;Ao為對照溶液的吸光度。
2)南瓜中游離葉黃素清除·OH 的能力 取6 mmol/L FeSO4溶液 1 mL、6 mmol/L 水楊酸乙醇溶液1 mL,依次加入試管中,不同質量濃度南瓜葉黃素乙醇溶液1 mL 充分混勻, 隨后加入5 mmol/L H2O2溶液 1 mL 以啟動反應, 并于 37 ℃下水浴30 min,測定其510 nm 波長處吸光度A,另設乙醇為空白對照,按公式(3)計算南瓜葉黃素對·OH 的清除率:
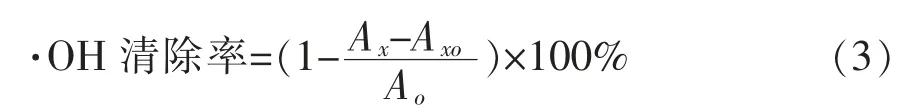
式中:Ax為樣品溶液的吸光度;Axo為不加H2O2時樣品溶液的吸光度;Ao為對照溶液的吸光度。
1.2.9 統計學處理 數據運用 Microsoft Excel、Design Expert 8.0.6、SPSS 13.0 統計軟件對實驗數據進行統計學分析和顯著性分析。 統計描述:計量資料數據用x ± s 表示,P<0.05 表示具有顯著性差異,P<0.000 1 表示具有極顯著性差異。
2 結果與分析
2.1 樣品測定
2.1.1 南瓜葉黃素的色譜測定 根據標準品的保留時間對南瓜中游離葉黃素的色譜峰初步定性,將樣品測定色譜圖與標準品色譜圖進行比較,以確定樣品的相應峰位。 按1.2.3 色譜條件測定標準品溶液和樣品溶液,色譜圖見圖2。標準品保留時間與樣品保留時間相同,初步確定樣品與標準品為同一物質。

圖2 樣品溶液和標準品溶液高效液相色譜圖Fig. 2 High performance liquid chromatogram of sample solution and standard solution
2.1.2 南瓜葉黃素的質譜鑒別 葉黃素標準品和樣品的MS 檢測結果見圖3。 樣品溶液中含有與標準品一致的質譜碎片及其特征離子峰度,從而進一步證明南瓜中含有葉黃素。 葉黃素的相對分子質量為568, 一級質譜分析特征離子為m/z 569.4、430,其中m/z 569.4 峰為基峰,m/z 430 峰為碎片峰。
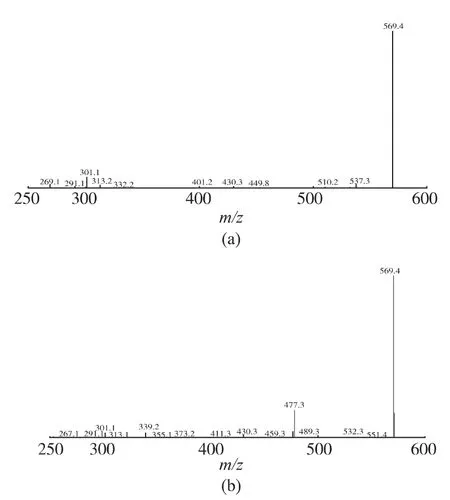
圖3 樣品溶液和標準品溶液一級質譜圖Fig. 3 Sample solution and standard solution primary mass spectrum
為了進一步驗證m/z 430 離子峰的來源, 并探明葉黃素的質譜分析裂解規律, 以m/z 569.4 離子峰為母離子,對葉黃素標準品溶液和樣品溶液中的葉黃素峰進行了二級質譜分析,樣品和標準品的二級質譜圖見圖4。 樣品的二級質譜特征離子與標準品一致,確定m/z 430 峰為m/z 569.4 離子峰的碎片峰,更進一步確定樣品與標準品為同一物質。 根據葉黃素一級和二級質譜特征,推斷葉黃素可能的質譜裂解方式,見圖5。
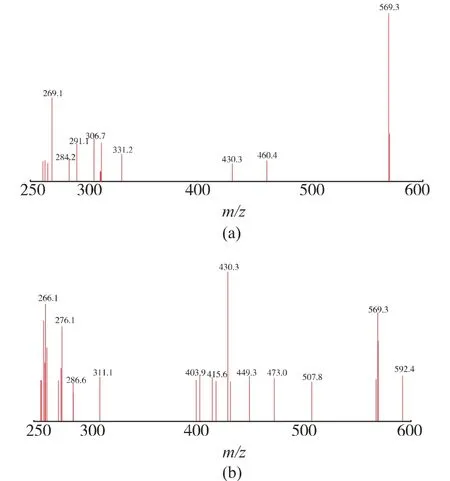
圖4 樣品溶液和標準品溶液二級質譜圖Fig. 4 Sample solution and standard solution secondary mass spectrum
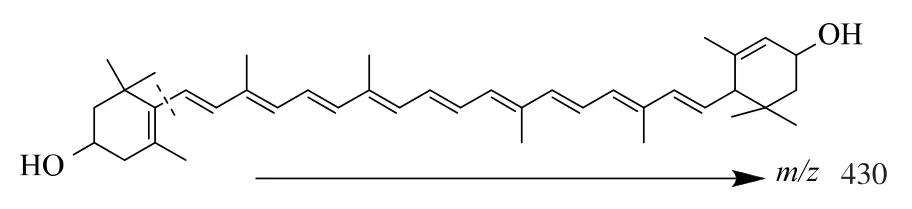
圖5 葉黃素裂解規律圖Fig. 5 Lutein pyrolysis rule
2.2 單因素實驗結果分析
2.2.1 氫氧化鉀-甲醇溶液質量濃度對葉黃素酯皂化效果的影響 由于葉黃素在強堿環境下易發生氧化和異構化,易轉化為玉米黃素,使游離葉黃素得率降低[15],見圖6。 在固定皂化溫度 35 ℃、皂化時間5 h 的條件下, 考察KOH-甲醇溶液質量濃度分別為 5、10、20、30、40 g/dL 時對游離葉黃素得率的影響,結果見圖 7(a)。 由圖 7(a)可知,氫氧化鉀-甲醇溶液質量濃度在5~40 g/dL 范圍內, 隨著氫氧化鉀質量濃度的增加, 游離葉黃素得率逐漸升高,高于30%則有下降趨勢。 因此選用30 g/dL 的氫氧化鉀-甲醇溶液為皂化液。

圖6 葉黃素轉化玉米黃素示意圖Fig. 6 Schematic diagram of lutein conversion to zeaxanthin
2.2.2 皂化溫度對葉黃素酯皂化效果的影響 在固定KOH-甲醇溶液質量濃度為30 g/dL,皂化時間5 h 的條件下, 考察皂化溫度分別為 25、35、45、55、65 ℃時對游離葉黃素得率的影響,結果見圖7(b)。由圖 7(b)可知,皂化溫度在 25~65 ℃范圍內,游離葉黃素得率呈先上升后下降的趨勢。 由于溫度過低不利于葉黃素酯在皂化體系中分散,導致皂化不完全,而溫度過高則會導致游離葉黃素的降解和異構化,使游離葉黃素得率下降,因此皂化溫度控制在35 ℃為宜。
2.2.3 皂化時間對葉黃素酯皂化效果的影響 在固定KOH-甲醇溶液質量濃度為30%、皂化溫度35℃的條件下, 考察皂化時間分別為 2、5、8、11、14 h時對游離葉黃素得率的影響,結果見圖7(c)。 由圖7(c)可知,皂化時間在 2~14 h 范圍內,當皂化時間小于5 h 時,隨著皂化時間的延長,游離葉黃素得率呈逐漸增大的趨勢。當皂化時間超過5 h 時,游離葉黃素得率逐漸下降。 可能由于5 h 時幾乎所有的葉黃素均以游離狀態存在,延長皂化時間只能使葉黃素在堿性條件下發生氧化和異構化,游離葉黃素得率反而減少。 因此,選擇皂化時間為5 h。
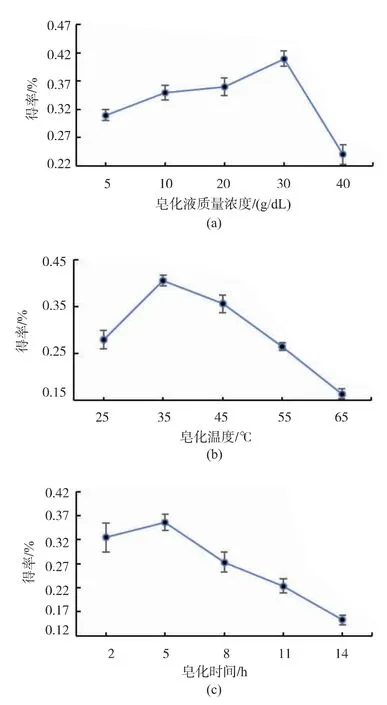
圖7 單因素試驗結果Fig. 7 Single factor test results
2.3 響應面優化葉黃素酯皂化條件
2.3.1 葉黃素酯皂化條件的工藝優化 在單因素試驗結果的基礎上,采用Box-Behnken 中心組合實驗設計原理對南瓜葉黃素酯皂化條件進行優化,選擇皂化液質量濃度A、皂化溫度B、皂化時間C 為自變量,以葉黃素得率Y 為響應值,設計三因素三水平的優化試驗, 采用Design Expert 8.0.6 軟件對數據進行分析,結果見表2。
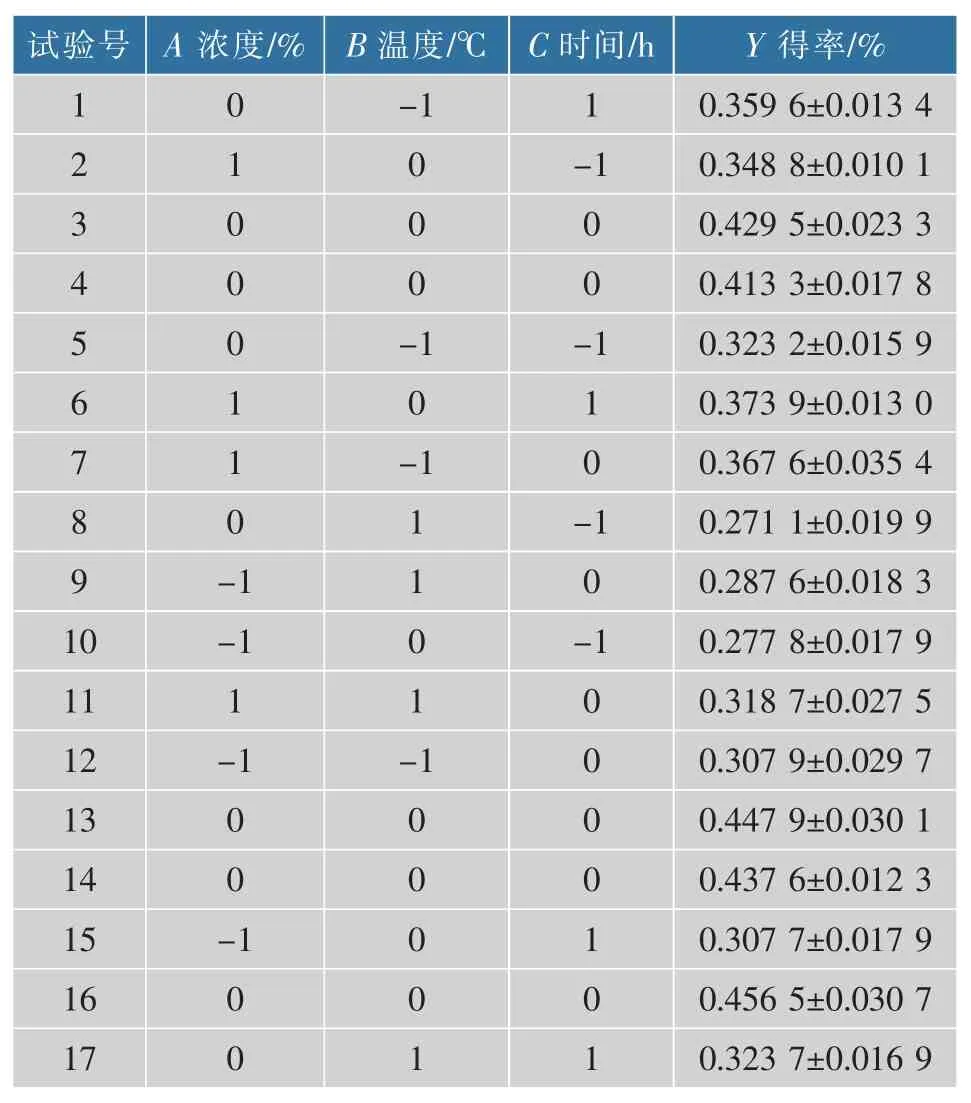
表2 響應面優化實驗設計及結果Table 2 Response surface optimization experiment design and results
通過回歸分析得到游離葉黃素得率與皂化液質量濃度A、皂化溫度B、皂化時間C 的回歸方程為Y=0.44+0.029A-0.020B+0.018C-7.150×10-3AB-1.200×10-3AC+4.050×10-3BC-0.054A2-0.062B2-0.055C2
回歸方程方差分析結果見表3。 可知該模型P<0.000 1,極顯著;失擬項 P 值為 0.676 6,不顯著。 這說明得到的多項回歸方程模型能準確反映皂化液質量濃度、 溫度和時間對南瓜葉黃素酯皂化的影響;模型決定系數R2=0.974 0,調整決定系數R2Adj=0.940 6, 表明本方程可以解釋94%以上的數據,該模型擬合度較好,誤差較小,該模型可用于分析與預測南瓜中游離葉黃素的制備工藝試驗。
通過表3 回歸方程系數顯著性檢驗,一次項皂化液質量濃度 A、溫度B 以及平方項 A2、B2和 C2游離葉黃素得率有極顯著影響,一次項中時間C 可顯著影響游離葉黃素得率,二次項中皂化液質量濃度與溫度AB,皂化液質量濃度與時間AC 和溫度與時間BC 對游離葉黃素得率影響不顯著。 從F 值可以看出,在所選的各因素水平范圍內,皂化液質量濃度對葉黃素得率的影響最大, 溫度的影響次之,時間的影響最小,即 A>B>C。
2.3.2 響應面圖分析 響應面圖是由特定的響應值對應自變量構成的三維曲線圖[16],為了更直觀地反映出各自變量對響應值的影響。 本研究根據回歸方程繪制出各影響因素對南瓜葉黃素得率的響應面圖見圖8。 根據響應曲面的傾斜度和等高線密集程度,可確定兩兩因素對響應值的影響程度,傾斜度越高,等高線越密集,說明兩者交互作用越顯著[17]。 由圖 8 可知,因素 A、B、C 的曲面傾斜程度皆較高,等高線較緊密,說明因素A、B、C 對響應值影響極顯著;因素A 和因素B、因素A 和因素C、因素B 和因素C 的響應面的曲面較平緩,其交互作用對游離葉黃素得率的影響不顯著,與方差分析結果一致。 對回歸方程一階求導,在游離葉黃素得率得最大值時,其皂化液質量濃度32.71 g/dL、溫度33.31 ℃、時間5.46 h, 此時南瓜提取物中游離葉黃素得率為0.443 9%。
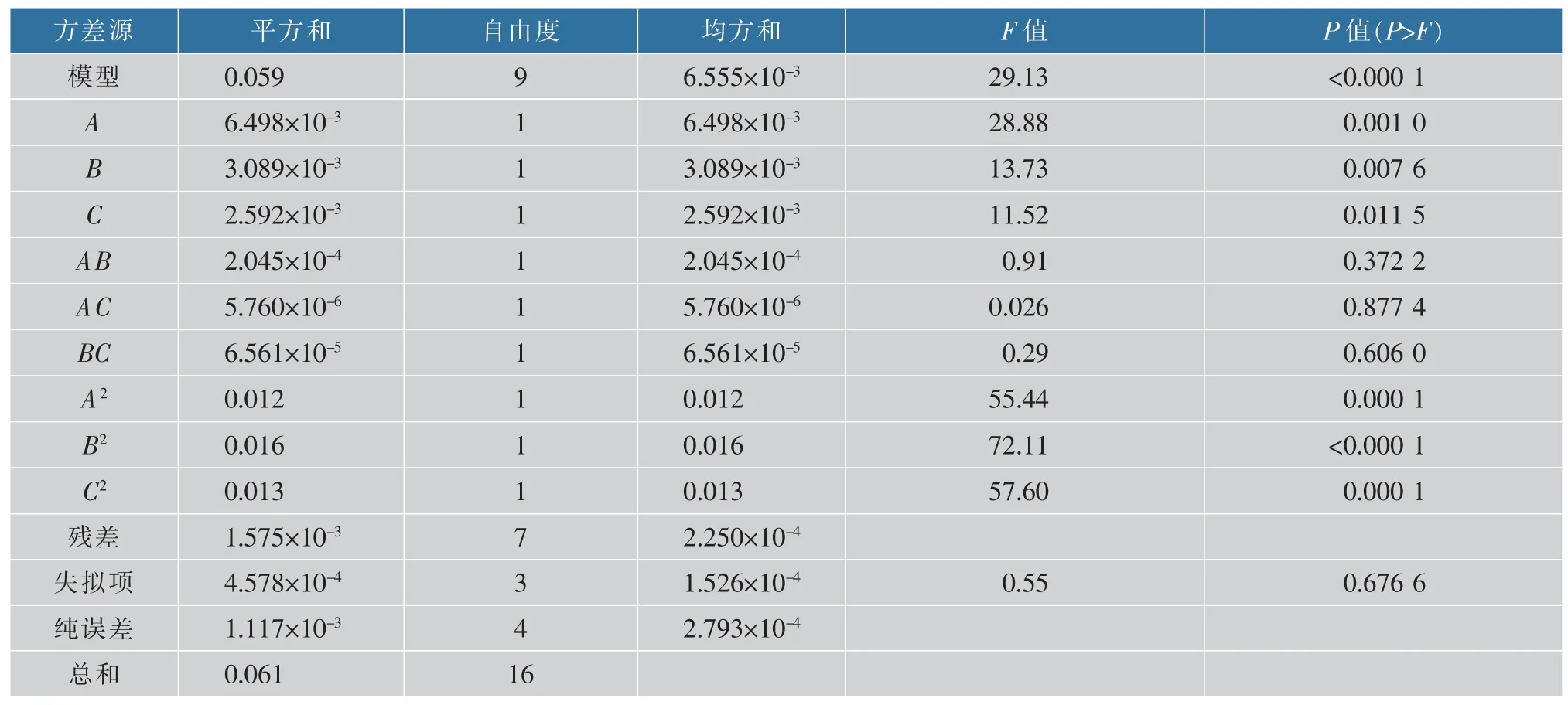
表3 回歸方程顯著性檢驗Table 3 Regression equation significance test

圖8 交互作用對南瓜葉黃素酯皂化效果的影響Fig. 8 Effect of interaction on the saponification effect of pumpkin lutein ester
2.3.3 驗證試驗 為檢驗方法預測的結果,用實驗中得到的最佳工藝條件重復試驗。 為便于實際操作,將試驗條件確定為,皂化液質量濃度33 g/dL,溫度33 ℃,時間5.5 h,修正后的條件制備游離葉黃素3 次,得率分別為 0.412 7%、0.436 5%、0.403 3%,平均得率為0.4175%,與理論值較為吻合,表明優選工藝效果較為理想。
2.4 游離葉黃素的純化
通過課題組前期預試驗比較,最終確定以硅膠為固定相, 石油醚-乙酸乙酯為流動相對游離葉黃素進行柱色譜純化。 先用石油醚-乙酸乙酯(3∶1)對雜質進行分離洗脫,再用石油醚-乙酸乙酯(3∶2)將目標產物洗脫下來。 減壓濃縮得游離葉黃素產品,純度達91.39%,結果見表4。 游離葉黃素HPLC 色譜圖見圖2(a),與葉黃素標準品出峰時間一致。 結果表明,利用硅膠柱色譜純化可以快速將目標葉黃素分離純化。
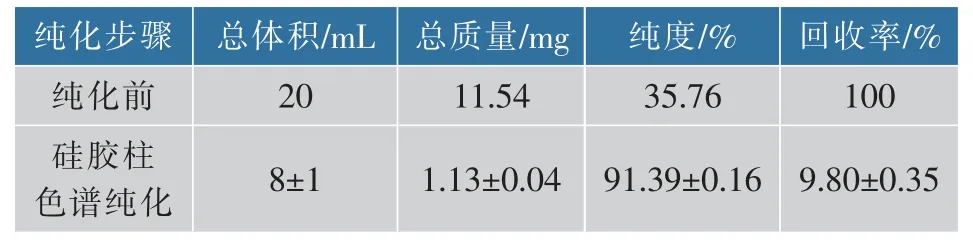
表4 游離葉黃素純化結果Table 4 Free lutein purification results
2.5 南瓜葉黃素的抗氧化活性
2.5.1 南瓜中游離葉黃素對DPPH·清除作用 南瓜葉黃素對DPPH·清除效果隨著游離葉黃素質量濃度的提高而逐漸增強,在一定質量濃度范圍內呈量效關系,結果見圖9。南瓜葉黃素質量濃度與其對DPPH·清除效果線性回歸分析方程為y=-3.57x2+37.41x-13.8, 相關系數 R2=0.986 9, 半抑制濃度IC50=0.021 4 mg/mL,擬合程度良好,說明南瓜葉黃素對DPPH·具有明顯的清除作用。
2.5.2 南瓜中游離葉黃素對·OH 清除作用 南瓜葉黃素對·OH 清除效果隨著游離葉黃素質量濃度的提高而逐漸增強,在一定質量濃度范圍內呈量效關系,結果見圖9。 南瓜葉黃素質量濃度與其對·OH清除效果線性回歸方程為y=-2x2+23.8x-11.8,相關系數R2=0.975 2, 半抑制質量濃度IC50=0.038 3 mg/mL,擬合程度良好,說明南瓜葉黃素對·OH 具有明顯的清除作用。
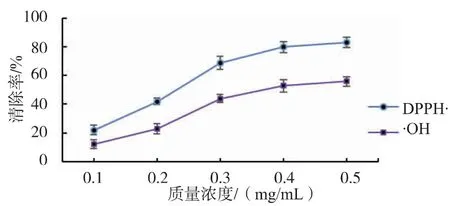
圖9 南瓜葉黃素對DPPH·和·OH 的清除作用Fig. 9 Scavenging effects of pumpkin lutein on DPPH·and·OH
3 結語
采用Box-Behnken 中心組合實驗原理對南瓜中游離葉黃素皂化工藝參數進行響應曲面優化,得到最佳工藝條件為:皂化液質量濃度33 g/dL,溫度33 ℃,時間5.5 h,此時南瓜提取物中游離葉黃素得率為0.417 5%。 在硅膠柱色譜純化后,游離葉黃素的純度可提高到91.39%。 目前,工業生產葉黃素主要是通過在萬壽菊花亞臨界低溫浸出獲得,其設備復雜、 原料昂貴。 本研究得到的優化工藝高效、可靠、成本低,可為南瓜葉黃素的進一步商業生產提供技術參考。
作者采用紫外分光光度法考察了南瓜葉黃素對DPPH·和·OH 自由基清除能力,這是兩種被廣泛認可的抗氧化活性評價方法,具有易操作、準確度高等特點。 南瓜葉黃素清除DPPH·、·OH 的半抑制質量濃度IC50分別為 0.021 4 mg/mL 和 0.038 3 mg/mL,結果顯示南瓜葉黃素具有較好的抗氧化活性。 科學研究表明,炎癥、癌癥、衰老等大量疾病大都與過量自由基的產生有關聯,而抗氧化劑抵消自由基對人體細胞的氧化攻擊,這也是已知葉黃素其具有保護視覺、預防老年性黃斑變性等功效的物質基礎。 本實驗結果證明, 南瓜葉黃素是良好的天然抗氧化劑,具有廣闊的藥品、食品等產業開發的前景,為其抗氧化活性相關研究提供了科學依據。

