熱重分析法在高考化學試題中的考查
福建 洪茲田 新疆 張新芹
熱重分析法(簡稱熱重法)為大學無機化學內容,但近年來高考熱重分析法與中學內容相結合的定量考查方式悄然興起。熱重法常以熱重(TG)曲線呈現實驗數據。此類曲線表征類試題旨在考查學生分析圖象、獲取信息、數據處理以及文字表述的能力。通過分析熱重曲線,我們可以知道樣品及其可能產生的中間產物的組成、熱穩定性、熱分解情況及生成的產物等與質量相聯系的信息。
一、熱重法及TG曲線簡介
1.熱重法
熱重法(Themogravimetry,簡稱TG),是指在程序控制溫度下測量物質的質量與溫度或時間的關系的方法。熱重分析所用的儀器是熱天平,它的基本原理是將樣品質量變化所引起的天平位移量轉化成電磁量,這個微小的電量經過放大器放大后,送入記錄儀記錄,而電量大小正比于樣品的質量變化量。當被測物質在加熱過程中有升華、汽化、分解產生氣體或失去結晶水時,被測物質質量就會發生變化。
2.熱重(TG)曲線
理想的TG曲線是一些直角臺階。臺階大小表示質量變化量,一個臺階表示一個熱失重,兩個臺階之間的水平區域代表試樣穩定存在的溫度范圍。通常橫坐標表示溫度或時間,縱坐標表示試樣質量或殘留率。
例如,草酸鈣晶體(CaC2O4·H2O)在N2氛圍中的熱重曲線如圖1所示:
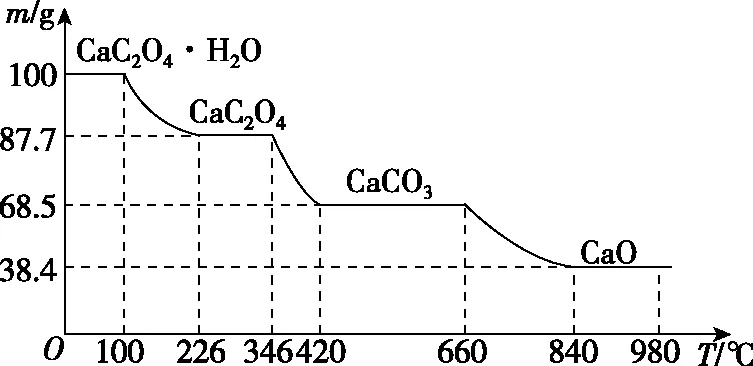
圖1 草酸鈣晶體在N2氛圍中的熱重曲線
①熱重曲線中第一個平臺在100℃以前,固體組成為CaC2O4·H2O。此階段沒有發生化學反應。



二、熱重曲線的線段類型和表示意義
1.熱重曲線中的基本線段類型(如圖2)
圖2 熱重曲線中的基本線段類型
2.基本線段所表示的意義(見表1)
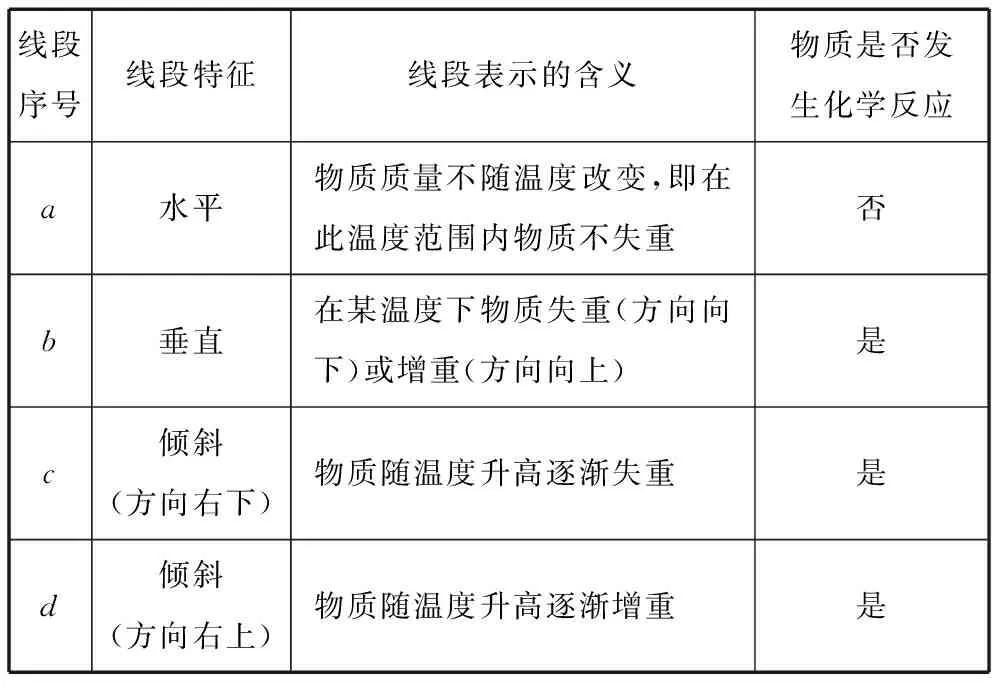
表1 線段所表示的意義
三、熱重曲線試題的解題模式
熱重曲線中試樣變化基本集中在脫水、分解、氧化、還原等方式。不同的試樣重量變化方式可能是一種或多種組合,有的熱重實驗僅存在一種反應類型,相對簡單,較多的實驗試樣存在兩種或兩種以上的反應類型,導致熱重曲線試題難度增加,需要分步解答。以水合物脫水、氫氧化物分解和氧化物氧化為例,對熱重曲線試題的解題模式進行歸納(如圖3)。
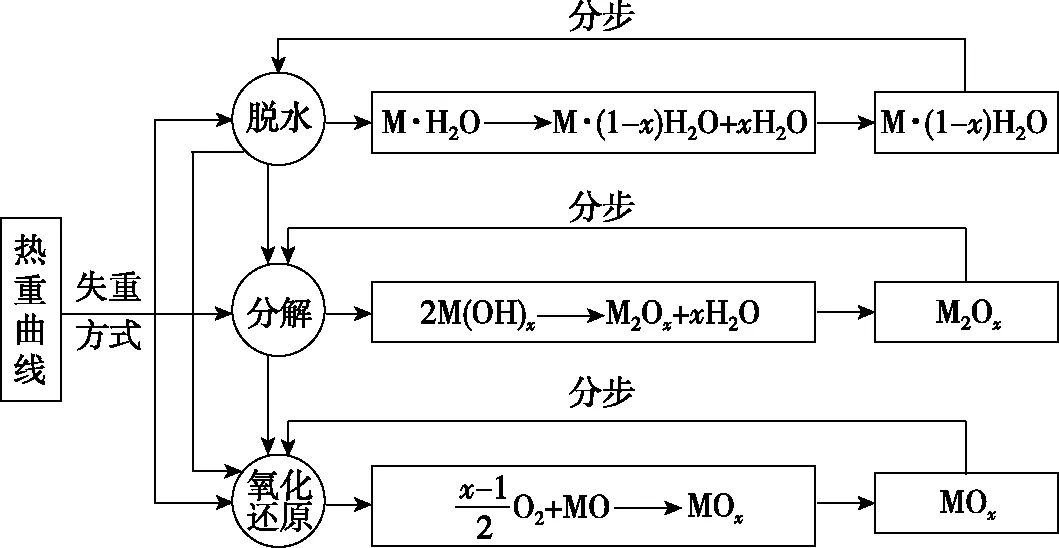
圖3 熱重曲線試題的解題模式
四、熱重曲線問題的常用解題方法
含有結晶水的固體樣品在加熱過程中,首先考慮的是失去部分(或全部)結晶水。當失去全部結晶水時可能會進一步分解釋放出氣體物質(例如,對氫氧化物常進一步釋放出水蒸氣,對草酸鹽常進一步釋放出CO、CO2等)得到金屬氧化物。若生成的金屬氧化物具有較強還原性,則可能會進一步被熱重實驗中的空氣氧化。不管是哪種情況,受熱過程中,金屬元素會殘留在最終的固體中,即金屬元素質量守恒。熱重曲線試題的解題方法有差量法、元素守恒法、相對原子質量法(摩爾質量法)、假設法、公式法等。本文重點介紹最常用的差量法和元素守恒法。
1.利用差量法分析
(1)【例1】(2011·全國卷·26節選)0.80 g CuSO4·5H2O樣品受熱脫水過程的熱重曲線(樣品質量隨溫度變化的曲線)如圖4所示。請回答下列問題:
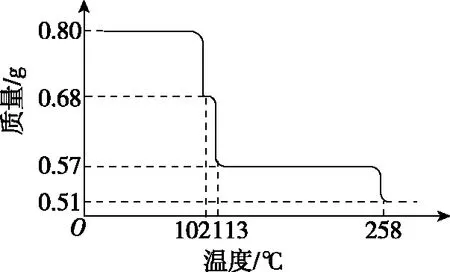
圖4 CuSO4·5H2O的熱重曲線
(1)試確定200℃時固體物質的化學式________(要求寫出推斷過程)。
(2)取270℃所得樣品,于570℃灼燒得到的主要產物是黑色粉末和一種氧化性氣體,該反應的化學方程式為______________________________;把該黑色粉末溶解于稀硫酸中,經濃縮、冷卻,有晶體析出,該晶體的化學式為________,其存在的最高溫度是________。
【答案】(1)CuSO4·H2O
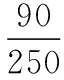
250 18n
0.80 g 0.23 g

200℃時產物為CuSO4·H2O晶體。
【解析】CuSO4·5H2O受熱到102℃時開始脫水分解,113℃時可得到較穩定的一種中間物,到258℃時才會繼續分解。分析CuSO4·5H2O受熱過程的熱重曲線:
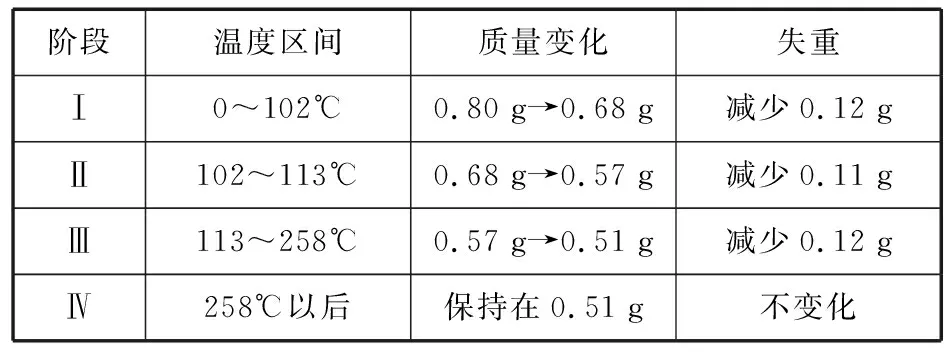
階段溫度區間質量變化失重Ⅰ0~102℃0.80 g→0.68 g減少0.12 gⅡ102~113℃0.68 g→0.57 g減少0.11 gⅢ113~258℃0.57 g→0.51 g減少0.12 gⅣ258℃以后保持在0.51 g不變化
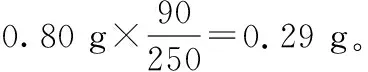
250 18n
0.80 g 0.23 g

(2)解題關鍵
根據物質性質初步猜測固體受熱失重的可能原因。分析熱重曲線中不同溫度區間內固體失重的質量,結合化學方程式運用差量法列式求算。
(3)【練習1】(2019·全國卷Ⅰ·27節選)硫酸鐵銨[NH4Fe(SO4)2·xH2O]是一種重要鐵鹽。采用熱重分析法測定硫酸鐵銨晶體樣品所含結晶水數,將樣品加熱到150℃時失掉1.5個結晶水,失重5.6%。硫酸鐵銨晶體的化學式為________。
【答案】NH4Fe(SO4)2·12H2O
【解析】本題雖無熱重曲線,但用直接描述的形式給出失去1.5個結晶水和失重率為5.6%的關鍵數據。取1 mol硫酸鐵銨晶體樣品[NH4Fe(SO4)2·xH2O],則150℃時樣品失重的質量為(266+18x) g×5.6%,即為生成H2O的質量,即(455+18x)×5.6%=18×1.5,解得x=12。故硫酸鐵銨晶體化學式為NH4Fe(SO4)2·12H2O。
2.利用元素守恒法分析

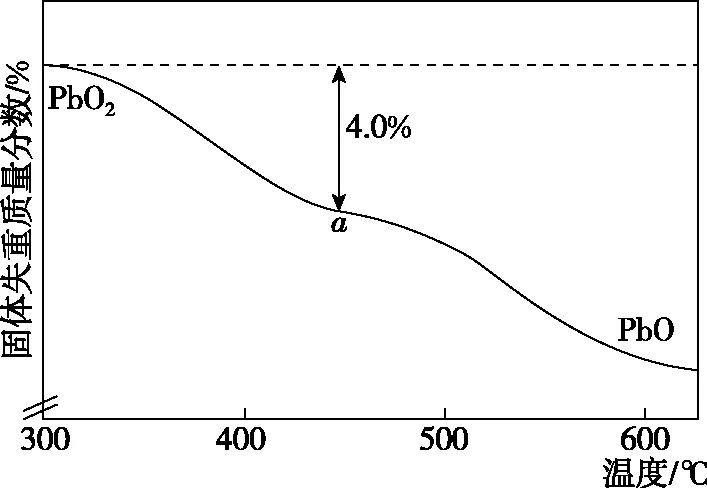
圖5 PbO2的熱重曲線
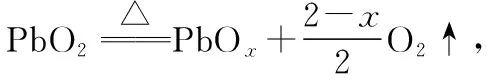
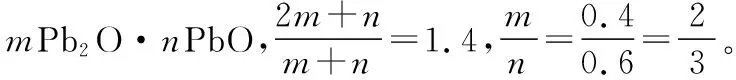
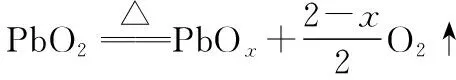
(2)解題關鍵
抓住受熱過程中,金屬元素全部會殘留在最終的固體產物中。圍繞反應前后,金屬元素的質量守恒進行相關計算。
(3)【練習2】稱取3.60 g草酸亞鐵晶體(FeC2O4·2H2O,相對分子質量是180)用熱重法對其進行熱分解,得到剩余固體的質量隨溫度變化的曲線如圖6所示,請回答下列問題:
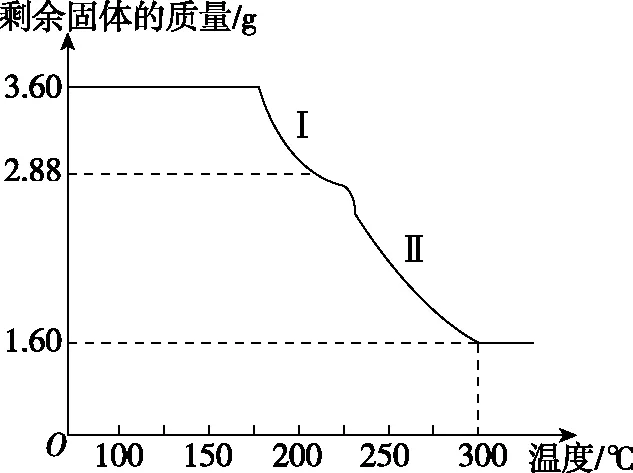
圖6 草酸亞鐵晶體的熱重曲線
(1)過程Ⅰ發生反應的化學方程式為_________________
(2)300℃時剩余固體只有一種且是鐵的氧化物,試通過計算確定該氧化物的化學式________。
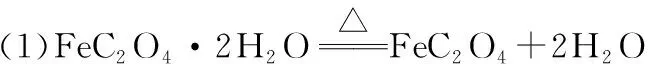
(2)Fe2O3
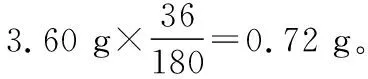
根據Fe守恒,草酸亞鐵晶體中鐵元素的質量即為300℃時鐵的氧化物中鐵元素的質量,
鐵的氧化物中,m(Fe)=1.12 g,m(O)=1.60 g-1.12 g=0.48 g。
即鐵的氧化物的化學式為Fe2O3。
五、熱重曲線問題命題趨勢預測
隨著近幾年高考對信息獲取與加工能力要求的逐步提高,圖象分析試題已成為高考化學試卷中備受青睞的熱點題型。熱重分析法作為大學內容與中學定量分析方法的重要結合點,既能考查學生的曲線表征和數據處理能力,又能考查學生的證據識別與推理能力。因此,預測在2020年的全國卷高考中,以熱重曲線為載體的熱重分析法的考查應引起足夠重視。該類題型的考查可能出現在選擇題(尤其是后兩題)中,也可能出現在大題(實驗綜合題、工業流程題、化學反應原理題)中物質成分的定量測定中。

