背角無齒蚌過氧化氫酶基因的克隆及多溴聯苯醚對其轉錄的影響
劉慶春,華春秀,薛士鵬,管翠翠,夏西超,,,*,代紅梅,王雯,張科,姚倫廣
1. 南陽醫學高等專科學校基礎醫學部,南陽 473007 2. 南陽師范學院生命科學與技術學院,南陽 473061 3. 平頂山學院醫學院,平頂山 476000
多溴聯苯醚(PBDEs)是一類廣泛應用于電子設備、塑料、紡織品和建筑材料中的阻燃劑,已被列入具有生態危害性的持久性有機污染物[1-2]。隨其應用的不斷增加,大量PBDEs隨降雨進入池塘、河流和湖泊等地表水,并在環境中呈現持久性累積,且在生物體內大量蓄積,現已成為威脅淡水生物的重要有機污染物[3]。PBDEs很難被環境中微生物降解,容易在脂肪組織中累積下來,隨整個食物鏈呈現放大效應[4]。PBDEs在生物體中能夠催化活性氧(ROS)生成,干擾線粒體呼吸作用,導致ROS過量產生,三磷酸腺苷(ATP)合成減少,最終誘發細胞死亡[5]。在PBDEs家族中,PBDE-47和PBDE-209應用較為廣泛,在多種食品和動物組織中被檢測到[5]。
過氧化氫酶(catalase, CAT)是一種廣泛存在于原核生物和真核生物體內的活性酶,CAT能夠將H2O2分解為H2O和O2,而H2O2作為一種有害的活性氧造成細胞損傷和病變[6-7]。目前,CAT廣泛應用于食品、環保和紡織業等,作為一種生物標記來檢測污染物的含量。同時,CAT參與炎癥反應、細胞增生和細胞凋亡及免疫細胞的激活等活動[6-7]。
雙殼類是軟體動物一個重要類群,常年棲息在海洋、河流和湖泊底部,以濾食生活為主,是檢測環境污染的重要指示性生物[8-9]。背角無齒蚌(Anodontawoodiana)是雙殼類軟體動物主要類群之一,在農藥、重金屬和持久性有機污染物檢測中發揮積極作用,常作為淡水污染的指示性生物[10-11]。為了更好揭示PBDEs環境毒性,保護淡水資源和淡水生物,本研究以背角無齒蚌為研究對象,克隆出AwCAT全基因序列,分析PBDE-47和PBDE-209對AwCAT時空表達的影響,為揭示PBDEs毒理效應提供理論參考。
1 材料與方法(Materials and methods)
1.1 背角無齒蚌處理
背角無齒蚌購自南陽市水產市場,PBDE-47、PBDE-209和二甲亞砜(dimethyl sulfoxide, DMSO),純度≥99.7%,購自Sigma-Aldrich公司,TRIzol試劑、M-MLV反轉錄酶、菌株DH5α、克隆載體pMDl9-T、連接酶、PCR產物回收純化試劑盒和RACE試劑盒均購自TaKaRa公司。其余常規藥品均為進口或國產分析純。
背角無齒蚌(殼長(6.5±0.5) cm)處理之前,置于實驗室自動水循環系統中適應養殖2周,停止進食。PBDE-47和PBDE-209溶解于DMSO中制備儲備液。處理實驗在長方形塑料盒(40 cm×25 cm,10 cm高)中進行,飼養采用人工模擬池塘水(每1 L去離子水中含48 mg NaHCO3、33 mg CaCl2·2H2O、60 mg MgSO4·7H2O和0.5 mg KCl),喂食小球藻,處置溫度(24±2) ℃[12]。為了確定AwCAT組織分布,對來自同一塑料盒5只動物進行解剖,取斧足、鰓、肝胰臟、閉殼肌、心臟和外套膜等組織。根據上述動物處理方法,動物分為對照組、PBDE-47處理組(6.25、12.5、25、50和100 μg·L-1)和PBDE-209處理組(10、20、40、80和160 μg·L-1),對照組用同體積DMSO處理,水中DMSO濃度不超過3‰。分別在0、6、12、24和48 h每組中取出5只河蚌,解剖肝胰腺和鰓,液氮速凍,于-80 ℃保存。
1.2 總RNA提取和cDNA第一鏈的合成
總RNA提取采用TRIzol試劑,用1.2%瓊脂糖凝膠電泳檢測RNA質量,分光光度法測定RNA濃度,具有完整rRNA條帶的RNA用于合成cDNA,用M-MLV試劑盒合成第一鏈cDNA,用作PCR反應模板。
1.3 背角無齒蚌AwCAT核心片段的擴增
用簡并引物AwCAT1和AwCAT2分離AwCATcDNA保守區域片段,PCR產物連接至pMDT-19載體,3個樣品雙向測序。確定AwCAT部分cDNA序列后,根據部分cDNA序列設計的特異性引物(表1),按照試劑盒要求,采用巢式PCR擴增AwCATcDNA 5’和3’區域序列,對3個5’RACE和3’RACE的PCR產物進行測序,拼接。

表1 實驗過程中的引物Table 1 Description of the primes used in this study
1.4 序列和系統發育分析
通過GenBank數據庫搜索(www. ncbi.nlm.nih.gov/blast)進行BLAST程序比對,分析AwCAT序列;根據SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP)預測信號肽;采用Simple Modular Architecture Research Tool(http://smart.embl-heidelberg.de/)預測蛋白質結構域;使用DANMEN分析程序對AwCAT基因進行多序列比對;通過Swiss-model(http://swissmodel.expasy.org/)預測AwCAT的蛋白質三維結構;使用MEGA5.0軟件構建系統進化樹。
1.5 AwCAT mRNA水平定量檢測
為了確定AwCAT轉錄水平,采用SYBR Premix Ex TaqTM試劑盒并按照要求進行定量分析。β-actin作為內參基因,根據AwCAT-F和AwCAT-R引物,用PCR儀中分離靶基因(表1),瓊脂糖凝膠電泳僅檢測出一個條帶,PCR產物測序,序列鑒別。篩選β-actin和AwCAT最佳擴增溫度,采用兩步法,使用ABI7500實時檢測系統(Applied Biosystems,美國)進行實時定量PCR,構建標準曲線,通過2-△△CT分析AwCAT表達水平。
1.6 統計學處理

2 結果(Results)
2.1 背角無齒蚌AwCAT 分子結構
背角無齒蚌AwCATcDNA全長由1 784個核苷酸組成(GenBank NO, KU363383),包含14 bp的5’非翻譯區(UTR)和234 bp的3’UTR。開放閱讀框由1 536 bp核苷酸組成,編碼512個氨基酸的多肽鏈,分子量為58.05 kDa,理論等電點為7.23(圖1)。終止信號(AATAAA)在3’UTR的1 743~1 748位點處。AwCAT具有CAT家族2個特征性標簽序列,一個是高度保守催化位點序列(61FDRERIPERVVHAKGAGA77)和一個是血紅素配體信號序列(351RLFSYSDTH358)(圖1)。多序列比對結果顯示,保守氨基酸His72、Asn145和Tyr355存在于AwCAT和其他CAT序列中(圖2);氨基酸序列比對結果表明,AwCAT含有NADPH結合殘基(N145、H191、F195、S198、R200、Y212、K234、W300、Q302和Y355)和血紅素結合殘基(R69、H72、R109、N145、F150、R351、Y355和R362)(圖2)。AwCAT中NFS(殘基436~438)為糖基化作用位點。

圖1 背角無齒蚌AwCAT 基因的cDNA序列和推導的氨基酸序列注:粗體部分為起始和終止密碼;波浪線部分為終止信號“AATAAA”;下劃線部分為潛在的活性位點序列(61FDRERIPERVVHAKGAGA77)和血紅素配體信號序列(351RLFSYSDTH358);灰色陰影部分為糖基化位點。Fig. 1 The nucleotide acid sequence and the deduced amino acid sequence of AwCAT in Anodonta woodianaNote: The start codon (ATG) and stop codon (TAA) are indicated in bold; putative polyadenylation signal “AATAAA” is showed with wavy line; the highly conserved catalytic site motif (61FDRERIPERVVHAKGAGA77) and proximal heme-ligand signature motif (351RLFSYSDTH358) are underlined; the potential N-glycosylation residues are marked with shadow.

圖2 背角無齒蚌AwCAT與其他物種CAT序列多重比對注:高度保守的催化位點序列用單下劃線標記,近端血紅素配體標記序列用雙下劃線標記;NADPH結合位點(N145、H191、F195、S198、R200、Y212、K234、W300、Q302和Y355)用粗體標記;保守氨基酸(His72、Asn145和Tyr355)用陰影標記。Fig. 2 Multiple alignment of AwCAT in Anodonta woodiana with other CATNote: The highly conserved catalytic site motif and proximal heme-ligand signature motif are respectively marked in singe underline and double underline; the putative NADPH-binding residues (N145, H191, F195, S198, R200, Y212, K234, W300, Q302 and Y355) are marked with bold; the conserved catalytic amino residues (His72, Asn145 and Tyr355) are indicated with shadow.
AwCAT與其他物種CAT序列具有高度的相似性,包括12個β-折疊和23個α-螺旋(圖3(a))。AwCAT三維結構排列和其物種CAT序列三維結構排列有很高的相似性(圖3(b))。
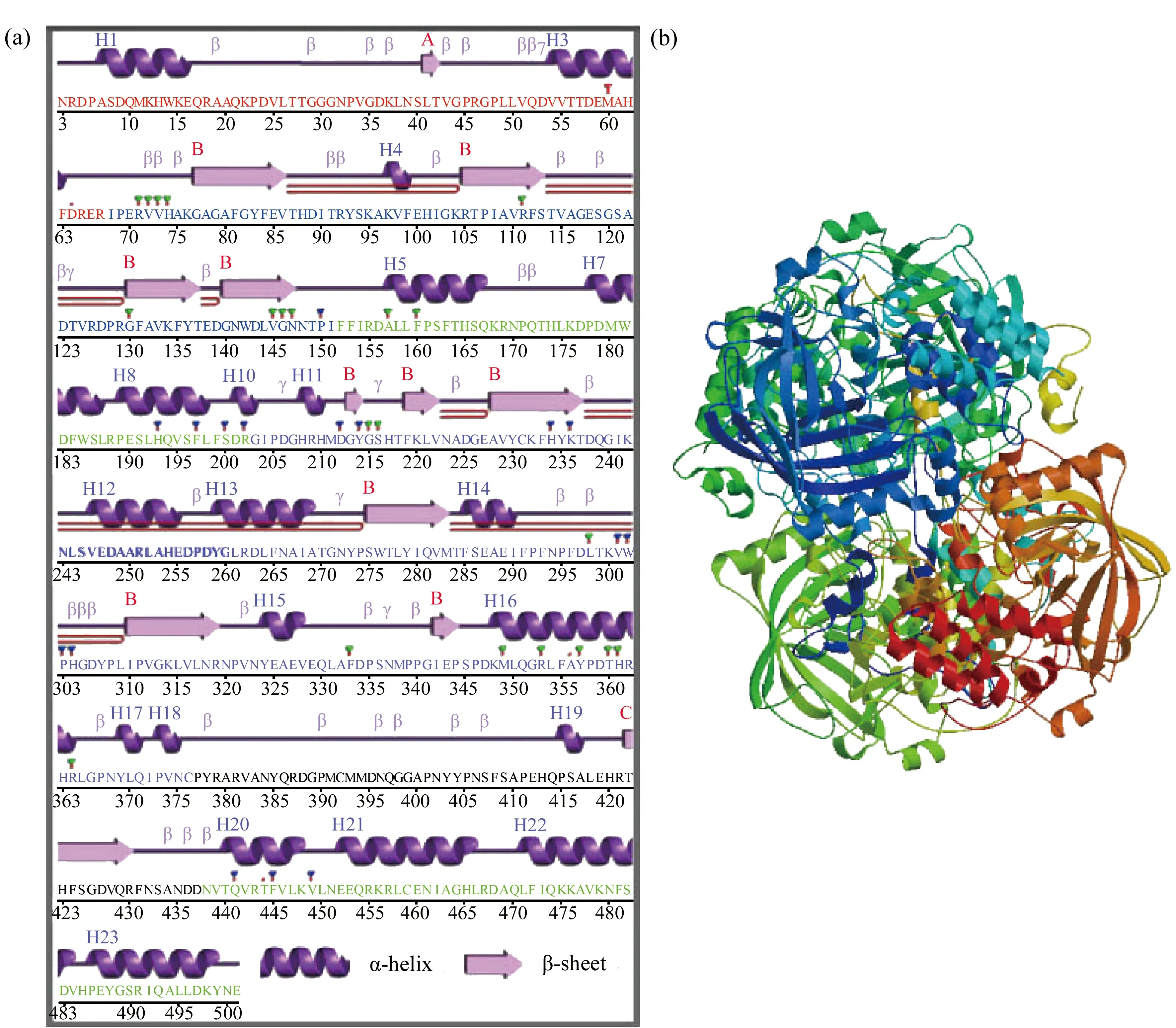
圖3 背角無齒蚌AwCAT二級和3D結構預測注:(a)AwCAT二級結構;(b)AwCAT的3D結構。Fig. 3 Predicted secondary and 3D structures of AwCAT deduced amino acidsNote: (a) the secondary structure of AwCAT; (b) the 3D structure of AwCAT.
2.2 系統發育分析
BLAST分析結果表明,AwCAT的氨基酸序列與其他物種CAT具有較高的同源性,與褶紋扇貝(Cristariaplicata)的同源性為91.99%,與加州夜蛾(Aplysiacalifornica)的同源性為73.88%,與家蠶(Bombyxmori)的同源性為66.09%,與斑馬魚(Daniorerio)的同源性為65.21%,與褐家鼠(Rattusnorvegicus)的同源性為66.98%,與人類(Homosapiens)的同源性為66.98%。系統發育分析表明,與AwCAT親緣關系最近是淡水雙殼類,其次是腹足類和海洋雙殼類,最后是脊椎動物、昆蟲和甲殼類動物(圖4)。
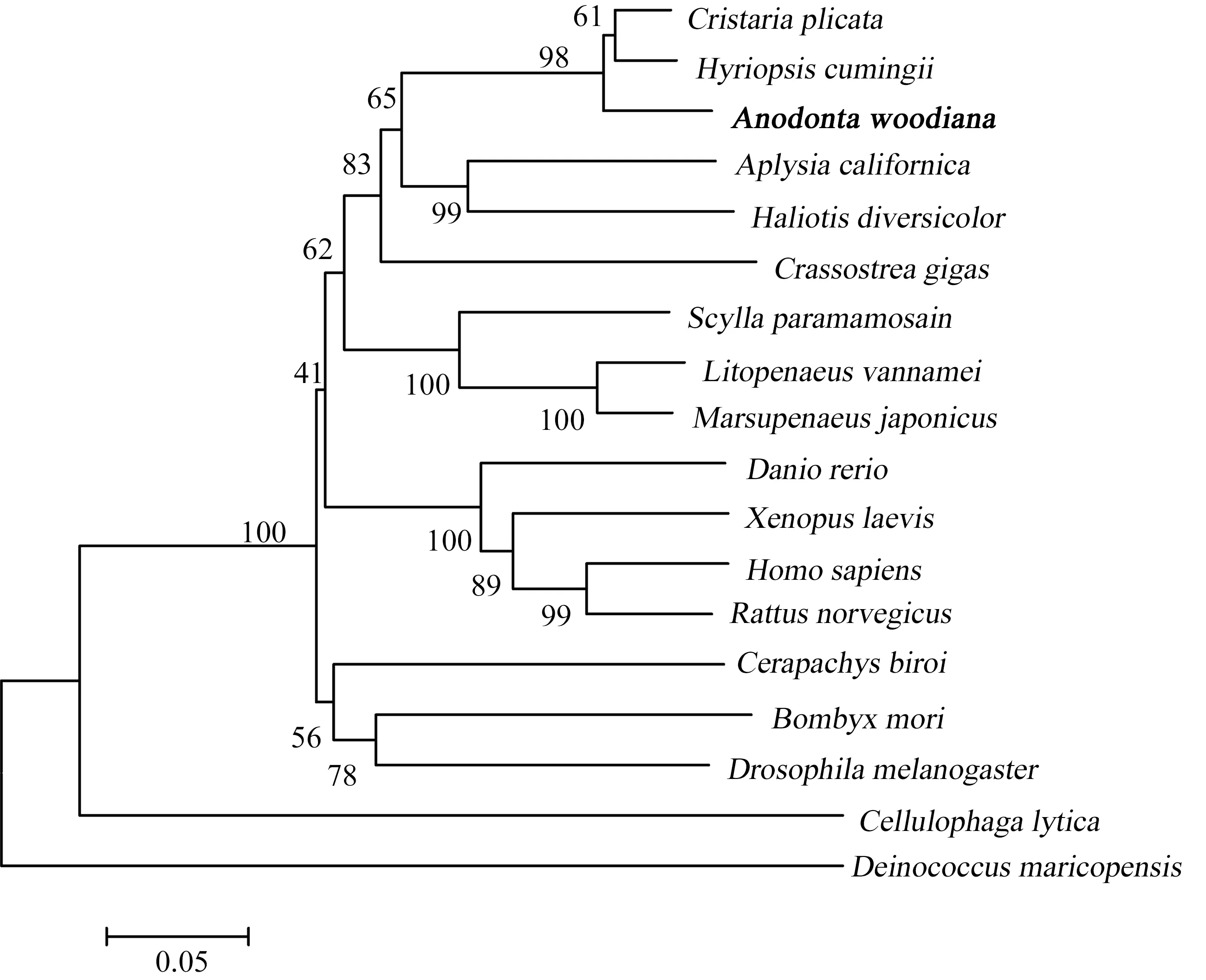
圖4 根據背角無齒蚌AwCAT氨基酸序列使用鄰接法構建的系統進化樹Fig. 4 Phylogenetic relationship of AwCAT of Anodonta woodiana according to neighborhood-joining method
2.3 AwCAT的組織分布
實時定量PCR結果顯示,背角無齒蚌AwCAT在斧足、鰓、肝胰臟、閉殼肌、外套膜和心臟殼中廣泛表達(圖5)。AwCATmRNA在肝胰臟和鰓中表達水平最高,閉殼肌、外套膜和斧足為中等水平表達,心臟中表達水平較低(圖5)。
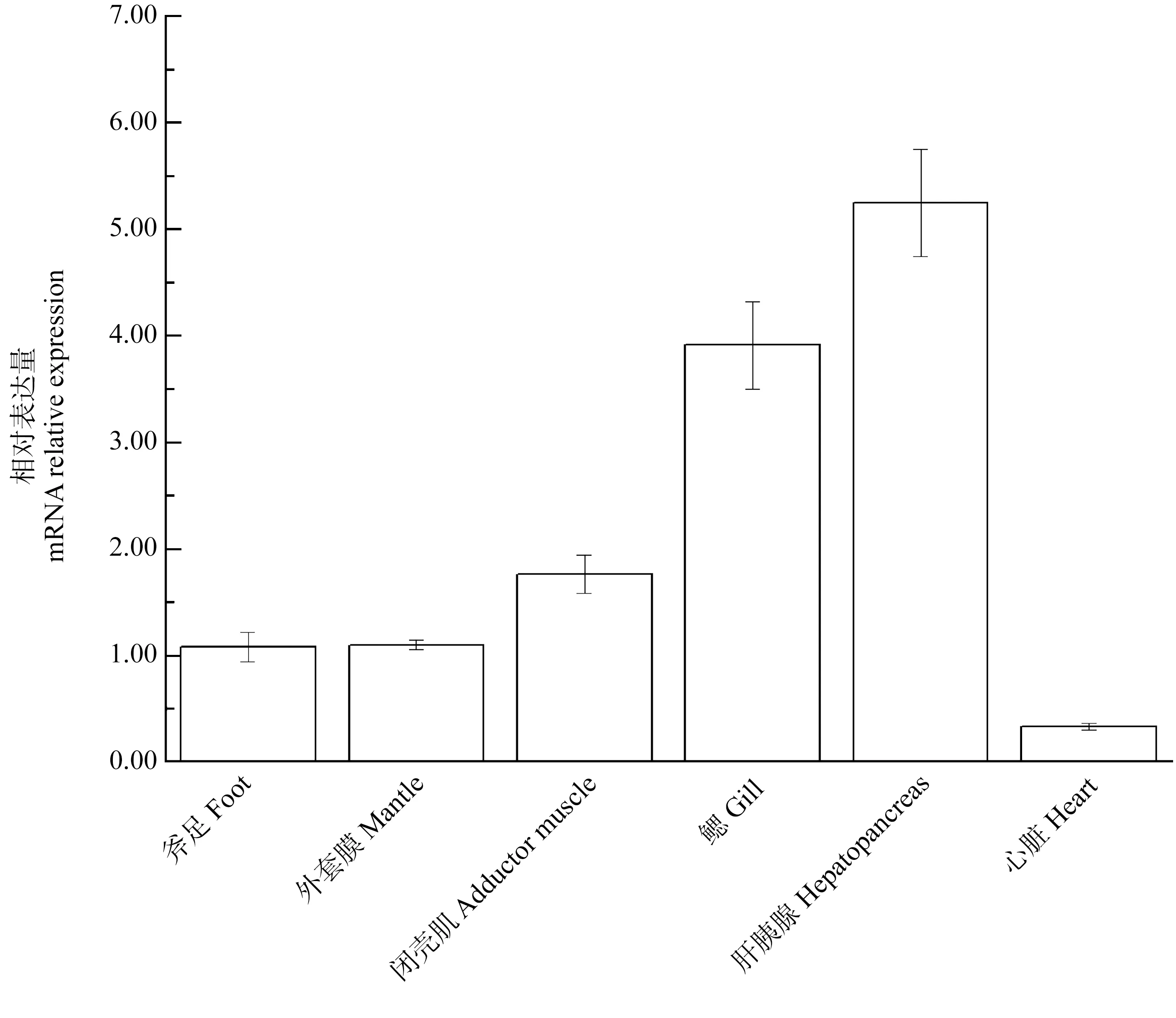
圖5 背角無齒蚌AwCAT基因的空間表達注:每組數據來源于5只動物,重復3次。Fig. 5 Real-time PCR analysis of AwCAT transcript from different tissuesNote: The data of each group were from 5 animals, and tests were repeated 3 times.
2.4 急性毒性實驗
背角無齒蚌48 h急性毒性試驗結果表明,PBDE-47對背角無齒蚌的半數致死濃度(LC50)為33.36 μg·L-1(表2)。最高濃度PBDE-209(160 μg·L-1)對背角無齒蚌的存活沒有顯著影響(表2),因此,本實驗中PBDE-209對背角無齒蚌的LC50值不能確定。

表2 PBDE-47和PBDE-209對背角無齒蚌的48 h急性毒性實驗Table 2 The 48 h acute toxicity experiments for Anodonta woodiana exposed to PBDE-47 and PBDE-209
2.5 PBDE-47和PBDE-209對肝胰腺AwCAT表達的影響
在濃度為6.25、12.5、25、50和100 μg·L-1的PBDE-47處理組中,肝胰腺中AwCATmRNA水平顯著增加,并且這種上調效應呈現時間和劑量依賴模式。與對照組相比,整個實驗觀察過程中AwCATmRNA水平在6.25、12.5、25、50和100 μg·L-1的PBDE-47處理組中分別增加了66.66%(P<0.05)、1.35倍(P<0.05)、1.54倍(P<0.05)、1.97倍(P<0.01)和2.39倍(P<0.01)以上(圖6)。
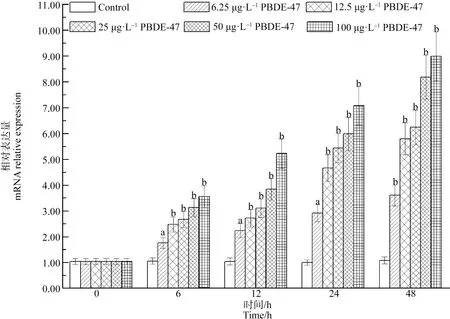
圖6 PBDE-47對背角無齒蚌肝胰腺AwCAT基因表達的影響注:數據表示為平均值±標準差;n=5/組/時間點;a(P<0.05)、b(P<0.01)表示與相應對照組相比有顯著差異;下同。Fig. 6 Temporal expression of AwCAT in the hepatopancreas of Anodonta woodiana after PBDE-47 exposureNote: Data are represented as means±SE; n=5/each group/each time point; a (P<0.05), b (P<0.01) mean significant difference vs control group at the same time; the same below.
與對照組相比,PBDE-209處理組AwCATmRNA水平呈現增加趨勢。在10、20、40、80和160 μg·L-1的處理組中,AwCAT表達水平分別增加了7.84%、35.38%、61.53%(P<0.05)、1.03倍(P<0.05)和1.09倍(P<0.05)以上(圖7)。
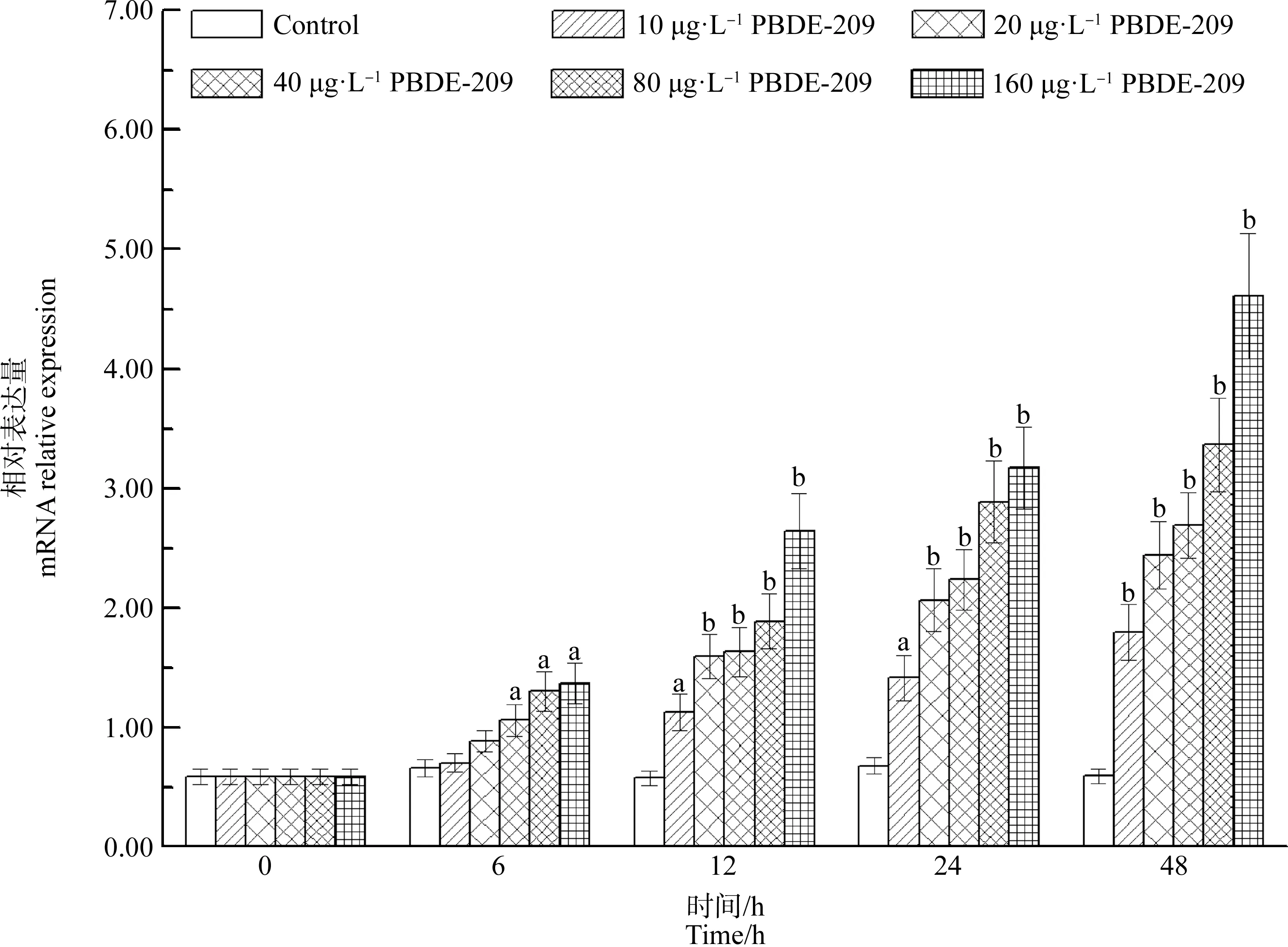
圖7 PBDE-209對背角無齒蚌肝胰腺AwCAT基因表達的影響Fig. 7 Temporal expression of AwCAT in the hepatopancreas of Anodonta woodiana after PBDE-209 exposure
2.6 PBDE-47和PBDE-209對鰓AwCAT表達的影響
與對照組相比,PBDE-47處理組鰓中AwCATmRNA水平在第6小時顯著升高,隨后隨時間呈降低的趨勢。在濃度為6.25、12.5和25 μg·L-1的PBDE-47處理組中,鰓中AwCATmRNA水平顯著增加;與對照組相比,整個實驗觀察過程中AwCATmRNA水平在6.25、12.5和25 μg·L-1的PBDE-47處理組中分別增加了1.97倍(P<0.01)、58.68%(P<0.05)和52.77%(P<0.05)以上(圖8)。50 μg·L-1和100 μg·L-1的PBDE-47處理組中,鰓中AwCATmRNA水平在第48小時低于正常水平,分別減少了24.31%和58.68%(P<0.05) (圖8)。
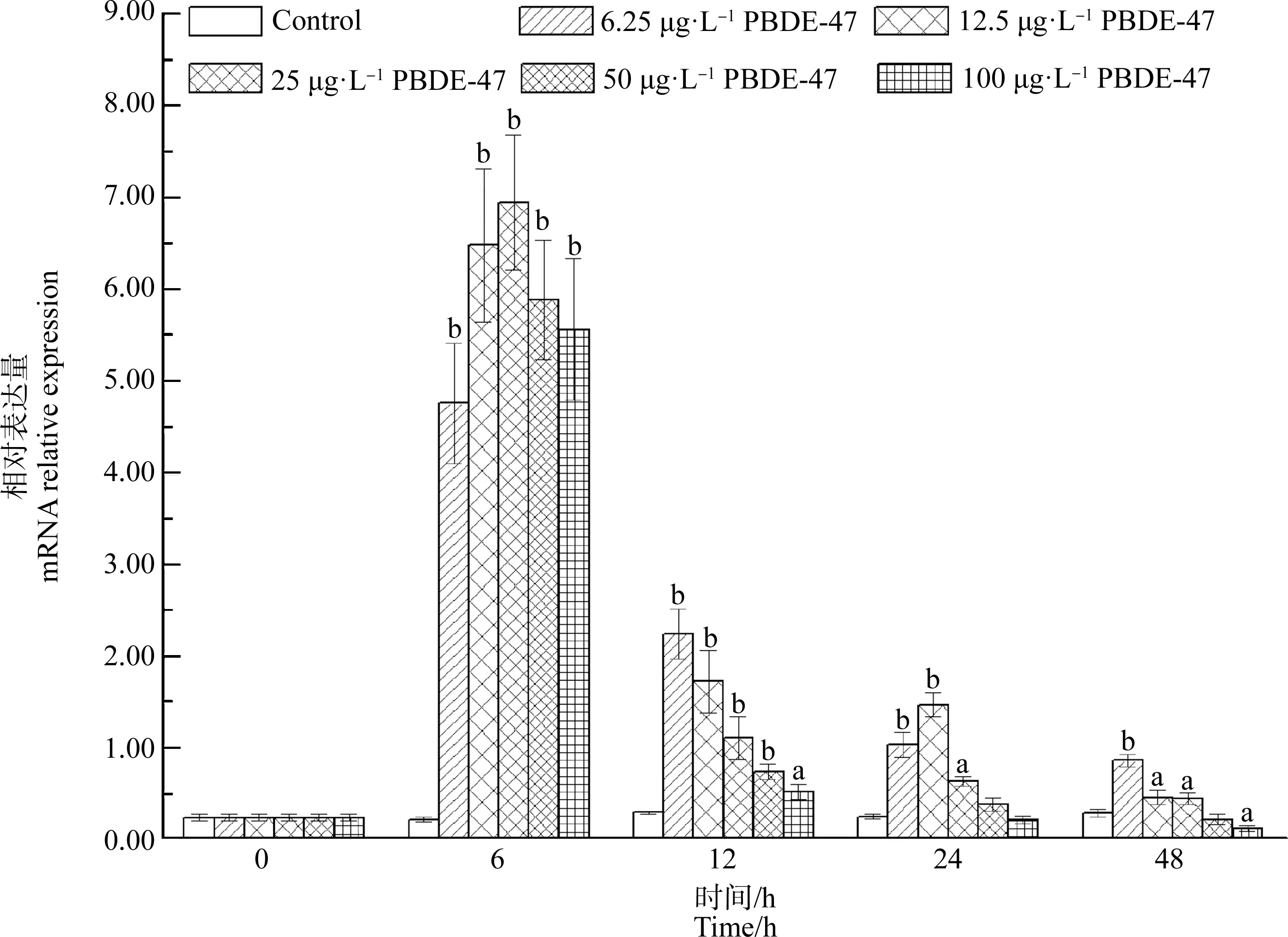
圖8 PBDE-47對背角無齒蚌鰓AwCAT基因表達的影響Fig. 8 Temporal expression of AwCAT in the gill of Anodonta woodiana after PBDE-47 exposure
與對照組相比,PBDE-209處理組鰓中AwCATmRNA水平顯著增加。在10、20、40、80和160 μg·L-1的處理組中,AwCAT表達水平分別增加了85.71%(P<0.05)、1.52倍(P<0.05)、1.76倍(P<0.05)、2.02倍(P<0.01)和2.38倍(P<0.01)以上(圖9)。
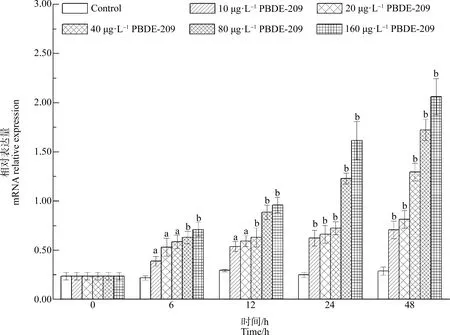
圖9 PBDE-209對背角無齒蚌鰓AwCAT基因表達的影響Fig. 9 Temporal expression ofAwCAT in the gill of Anodonta woodiana after PBDE-209 exposure
3 討論(Discussion )
AwCAT序列包含一個是高度保守催化位點序列(61FDRERIPERVVHAKGAGA77)和一個是血紅素配體信號序列(351RLFSYSDTH358),提示AwCAT屬于CAT家族的成員。多數CAT屬于單功能過氧化氫酶,是一種高度保守的含有4個同源性亞基的酶類,每個亞基能夠分別結合1個血紅素輔基和還原型輔酶[13-14]。血紅素是一種含鐵的輔基,常以鐵卟啉的形式存在,是CAT分子上的主要活性位點,它不僅參與催化H2O2形成無毒的H2O和O2,還能夠抑制脂質過氧化作用,保護機體免受損傷[13-14]。多序列比對結果顯示,AwCAT和其他物種CAT均擁有保守的氨基酸殘基,如His72、Asn145和Tyr355。AwCAT的C端過氧化物酶體靶向信號ANL與人類、小鼠和大鼠CAT典型信號一致,提示AwCAT可能與脊椎動物CAT家族大多數成員一樣具有過氧化物酶體糖蛋白的功能。哺乳動物中,NADPH一般認為與CAT緊密結合,并將底物(H2O2)提供給CAT,這一過程是通過CAT表面NADPH結合位點與血紅素基團之間電子通道來完成和實現的[15-16]。AwCAT序列中12個氨基酸殘基與NADPH結合位點形成有關,其中,10個保守殘基(N145、H191、F195、S198、R200、Y212、K234、W300、Q302和Y355)發揮關鍵作用。AwCAT蛋白序列二級結構和三級結構結果顯示,AwCAT中α-螺旋和β-折疊數量與脊椎動物數量相同,具有共同的保守殘基和空間結構,提示AwCAT這些結構特征與清除H2O2有關。
AwCAT在不同組織中具有不同的表達模式。肝胰腺中AwCATmRNA的表達水平最高,這與肝胰臟作為主要代謝場所和主要防御器官對氧化應激的作用有關。類似的結果也在凡納濱對蝦和擬穴青蟹研究中發現[12]。肝胰腺相當于哺乳動物的肝臟和昆蟲的脂肪體,被認為在非特異性免疫中發揮著重要的作用。由于其具有較高的代謝活性并且機體不斷產生活性氧,AwCAT基因高表達量表明它可能作為一種重要的肝胰腺解毒酶。在其他組織中AwCAT廣泛分布與不同器官中H2O2的氧化應激效應有關[12]。
在選定PBDE-47實驗濃度時,PBDE-47的LC50為33.36 μg·L-1,但未檢測到PBDE-209的LC50,提示在相同的處理濃度下背角無齒蚌對PBDE-47脅迫效應比對PBDE-209更為敏感。48 h急性毒性試驗結果表明,PBDEs對水蚤的48 h-LC50大小順序為:PBDE-28 研究發現,PBDE-47和PBDE-209處理后背角無齒蚌肝胰腺和鰓中AwCAT表達水平顯著增加,提示這與AwCAT增加機體H2O2和提高脅迫耐受性有關。白斑綜合征病毒感染后,日本囊對蝦肝胰腺CAT基因表達水平逐漸升高,48 h達到最高水平,以維持機體穩態和抗氧化防御能力[18]。重金屬鉛(Pb2+)處理后,鯽魚血清乳酸脫氫酶和CAT活性明顯升高,以增強機體對重金屬的脅迫效應和抗氧化能力[19]。Pb2+處理后太平洋牡蠣消化腺、鰓和閉殼肌中CAT表達呈現誘導效應,以提升機體耐受力[20]。隨著進入體內的PBDE-47和PBDE-209增多,逐漸誘導產生大量活性氧自由基,進而誘導超氧化物歧化酶活性不斷攀升,導致H2O2不斷升高。CAT作為H2O2濃度調節器,H2O2的升高,刺激體內CAT表達釋放和水平升高,用于分解H2O2。由此可知,PBDE-47和PBDE-209處理后背角無齒蚌肝胰腺和鰓AwCAT表達水平顯著增加與增強動物抗氧化能力和耐受性有關。 與對照組相比,不同濃度PBDE-47暴露后,前期AwCAT表達水平顯著上調,后期出現下調現象,提示這與PBDE-47在背角無齒蚌體內累積和代謝有關。正常情況下,動物體內ROS保持相對較低的水平,ROS生成后將迅速被一系列抗氧化酶清除,以維持ROS水平與抗氧化酶活性之間的平衡[21-22]。抗氧化酶是機體內穩態的重要標志之一。鰓作為貝類重要免疫器官,鰓絲直接接觸PBDE-47,并通過鰓絲呼吸作用迅速進入機體,產生大量ROS,相對與肝胰腺而言,PBDE-47對鰓氧化應激效應更為直接和明顯。持續高劑量長時間的PBDE-47暴露,將會導致進入體內PBDE-47超過鰓的解毒極限,鰓會受到損傷,鰓組織中大量細胞凋亡[23]。由此,處理后期AwCAT呈現表達水平下調的現象。在PBDE-209處理組中,鰓AwCAT表達呈時間和劑量依賴效應,與所選擇的PBDE-209濃度未達到臨界值有關,動物在這種濃度可以產生足夠的抗氧化能力,從而保持機體ROS生成和抗氧化酶還原作用之間的平衡。 由PBDE-47和PBDE-209對AwCAT時空表達誘導作用的特異性可以看出,PBDEs對背角無齒蚌脅迫是一個綜合的效應,其產生氧化應激后抗氧化系統啟動,經歷不同的暴露劑量和時間后產生損傷或修復。與相同濃度的PBDE-209相比,PBDE-47對這些非目標生物的危害更大。 ◆

