人體腸道耐藥基因組的研究進展
段宇婧,吳新顏,陳則友,陳穎,4,李林云,祝思源,毛大慶,羅義,2,*
1. 南開大學環境科學與工程學院,環境污染過程與基準教育部重點實驗室,天津 300350 2. 南京大學環境學院,污染控制與資源化國家重點實驗室,南京 210093 3. 南開大學醫學院,天津 300071 4. 遼寧大學環境學院,沈陽 110036
腸道微生物是人體最復雜的微生態系統,據估計人體腸道菌群數量是人體細胞總數的10倍之多[1-2]。作為20世紀最重要的醫學發現之一,抗生素在治療疾病、延長人類壽命方面發揮了重要作用,但是目前因抗生素濫用引發的耐藥性問題已十分嚴重。抗生素選擇性壓力能促進耐藥細菌和耐藥基因(antibiotic resistance genes, ARGs)不斷被篩選和富集,耐藥基因還可以通過可移動遺傳元件(mobile genetic elements, MGEs)在相同種屬或不同種屬的細菌之間進行水平轉移,使更多的敏感菌成為耐藥菌[3-4]。人體服用的抗生素進入腸道后形成的選擇性壓力可作用于腸道微生物并引起腸道菌群的改變。近年來,耐藥基因組(resistome)的概念應運而生,包括所有耐藥基因及其前體(隱匿性或原耐藥基因),這反映出耐藥基因的復雜性[5-8]。腸道是耐藥基因的“儲存庫”,研究發現人體腸道中存在上千種耐藥基因,相較其他環境樣品,人類腸道耐藥基因組擁有較高的豐度和多樣性,并且與人體健康息息相關,具有非常重要的研究意義[9-10]。本文首先介紹了人體腸道耐藥基因組的研究方法,系統總結了腸道耐藥基因組的組成和來源以及傳播和進化方面的最新進展,在此基礎上對今后的研究重點提出了建議與展望,以期為腸道耐藥基因組的研究提供新思路,同時為臨床抗生素的合理使用提供理論依據。
1 人體腸道耐藥基因組的研究方法(The research methods of human gut resistome)
傳統的微生物培養技術對于獲得耐藥菌株并闡明其表型和基因型具有不可替代的作用,但目前近80%的腸道細菌仍不可體外培養,該技術無法全面研究腸道耐藥基因組(圖1)[11-13]。一些分子生物學手段包括傳統PCR技術、實時熒光定量PCR技術(qPCR)、高通量熒光定量PCR技術、基因芯片技術(又稱DNA微陣列)和測序技術克服了分離培養技術存在的缺陷。其中,PCR技術和基因芯片技術可快速檢出樣品中耐藥基因并測得其豐度高低,但也存在一定的缺陷,這些技術不能提供耐藥基因的遺傳背景和宿主信息,同時常出現的假陽性結果也會影響人們對真實情況的認知[13]。基因測序技術可有效避免上述缺點,其中,二代測序技術(Next Generation Sequencing, NGS)憑借低成本和高通量,逐漸發展為目前的主流技術,但其存在序列讀長較短且拼接過程較為復雜等缺陷。三代測序無需模板擴增,耗時較短并且讀長更長,但是因其高錯配率、高成本和低通量的局限性而難以得到廣泛應用,現今仍處于發展和完善階段。基因組測序、擴增子測序、轉錄組測序和宏基因組測序等技術發展迅速,已得到廣泛應用,并衍生出相應的組學研究如基因組學和轉錄組學。宏基因組學(metagenomics)運用基因組學的研究策略來分析全部微生物的遺傳信息,被廣泛應用于探究環境或人體的微生物多樣性、種群結構和功能基因等方面。可以通過比對數據庫來分析測序結果,考察耐藥基因的存在情況,目前可選用的相關數據庫主要有CARD數據庫(The Comprehensive Antibiotic Resistance Database)[14]、ARDB數據庫(Antibiotic Resistance Gene Database)[15]、MvirDB[16]、ARGO數據庫(Antibiotic Resistance Gene Online)[17]、Resfinder數據庫[18]、Resfams數據庫[19]和ARG-ANNOT數據庫等[13,20]。
近年來,一些新興的耐藥基因組研究技術和方法也不斷誕生,如基質輔助激光解析電離-飛行時間質譜技術(MALDI-TOF-MS)、微流控(microfluidic strategies)、拉曼光譜、單細胞測序和HiC-Meta技術等。基于貝葉斯算法建立的Source Tracker機器學習方法可以進行耐藥基因溯源分析,如分析嬰兒的腸道菌群和耐藥基因是否來源于母體的腸道、陰道和皮膚菌群[21]。功能宏基因組(functional metagenomics)和培養組學(culturomics)的發展為深入探究腸道中耐藥基因的存在、傳播、機制、功能和健康風險提供了有效手段。功能宏基因組通過整合穩定同位素標記技術(DNA-SIP)或微流控技術來綜合探究耐藥基因的功能、活性和代謝產物,能夠用于發掘新型的耐藥基因[22-23]。但該技術也存在一定的缺陷,文庫構建過程會發生基因丟失,宿主菌也不可能正確地表達全部插入的基因片段(圖1)[13]。隨著研究的不斷深入,對于未知腸道細菌的探究需求日益迫切,準確獲取腸道耐藥菌株后,可繼續開展菌種鑒定、體外實驗或者模式生物實驗等,這對于耐藥基因的后續研究十分必要,而單純的測序技術無法滿足這一要求。目前,微生物培養技術整合基因測序技術經過發展和改良逐步形成了培養組學,已經將人體可培養細菌數目增加了上百種,為人類腸道細菌的培養和鑒定做出了巨大貢獻。培養組學通過多種培養條件來進行大規模細菌培養,并結合MALDI-TOF-MS以及16S rRNA基因測序等技術來鑒定細菌物種[12]。MALDI-TOF-MS能夠快速進行細菌物種鑒定,可以用于鑒定攜帶耐藥基因的細菌,并且該技術能夠進行細菌耐藥表型的檢測,如檢測β-內酰胺酶的產生[24]。
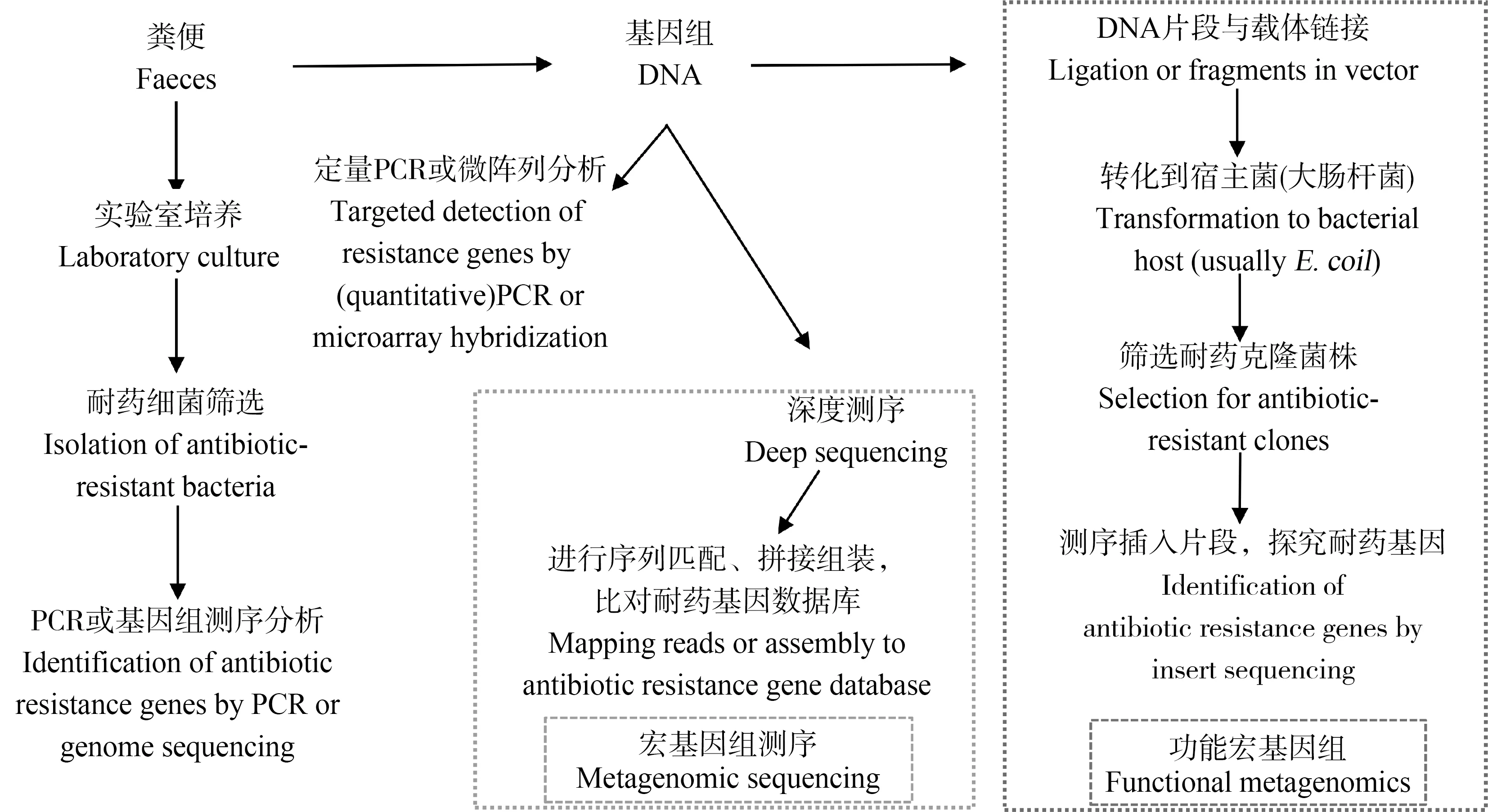
圖1 腸道耐藥基因研究的主要技術路線[13]Fig. 1 Major technical routes for the study of gut resistome[13]
2 人體腸道耐藥基因組的組成和來源(The composition and origin of human gut resistome)
2.1 人體腸道耐藥基因組的組成及影響因素
作為耐藥基因的“儲存庫”,腸道菌群的結構與耐藥基因的組成密切相關[10]。人體腸道菌群和耐藥基因的組成是一個由少到多、由簡單到復雜、由不穩定到穩定的定植過程,二者都受年齡的影響[25-26]。Lu等[26]通過對124份4個不同年齡段的健康人群糞便樣本研究發現,耐藥基因的多樣性和檢出數目隨著年齡升高而增加,依次為:學齡前兒童(3~5歲)<學齡期兒童(10~11歲)<高中青少年(15~17歲)<成年人(26~55歲)。成年人腸道耐藥基因組的種類較為豐富,有研究通過蛋白質同源建模的方法預測人類腸道中存在6 095種耐藥基因[27]。Hu等[9]在來自3個國家的共162份成人糞便樣本中檢測到1 093種耐藥基因,分別屬于149種耐藥基因類型,并且同其他環境介質如土壤、海洋和湖泊相比,成人腸道耐藥基因的豐度更高。據文獻報道,四環素類、β-內酰胺類、大環內酯類、氨基糖苷類、萬古霉素類和桿菌肽類耐藥基因在全世界不同國家的人體腸道中均廣泛存在,耐藥基因tetW、tetM、tetO、tet32、ermF、aadE、acrB和vanS等在健康人群腸道中普遍檢出并且相對豐度較高[9,28-29]。四環素類耐藥基因是腸道細菌中最常見的類型,研究表明,腸道厭氧共生菌中普遍存在tetW,擬桿菌門中普遍能檢出tetQ[30]。
除年齡影響外,研究者發現腸道耐藥基因的組成還會受到藥物、國家或地區、飲食及生活方式、經濟收入和環境等多種因素的影響[25,31-32]。很多藥物尤其是抗生素對腸道菌群以及耐藥基因有顯著影響。大量的研究證明,抗生素可降低腸道菌群的豐度和多樣性,增加耐藥基因豐度和數目,導致腸道菌群失調甚至難以完全恢復[11,33-36]。抗生素引起腸道菌群結構的改變是引起耐藥基因組成發生變化的直接原因[29,34-35]。Palleja等[34]分析了12名健康成年男性在短期服用混合抗生素后的腸道菌群和耐藥基因的變化,發現腸道菌群多樣性變低,檢出攜帶β-內酰胺類耐藥基因的細菌,并且在隨后的6個月恢復期內仍有多種腸道細菌未能恢復。Raymond等[35]的研究證明,口服頭孢丙烯后,腸道β-內酰胺類耐藥基因blacfx-6的突變增多,并且導致一些條件致病菌如陰溝腸桿菌的豐度增加。根據全球抗生素的消費情況與細菌耐藥數據的統計分析發現,人類腸道中,豐度最高的耐藥基因往往對應著使用歷史更長久的抗生素,甚至一些獸用抗生素,這些獸用抗生素可能是通過食物鏈進入人體來影響腸道耐藥基因組[37]。此外,非抗生素類藥物也會改變腸道菌群和耐藥基因,體外實驗研究表明,許多藥物能夠像抗生素一樣抑制腸道細菌,并可能促進細菌獲得抗生素抗性[38]。抗癲癇藥卡馬西平能促進攜帶多重耐藥基因的質粒在同屬和不同屬水平細菌間的水平轉移,抗菌劑三氯生可以通過誘導基因突變來使大腸桿菌獲得多重耐藥性[39-40]。
國家或地區的差異對人群的腸道耐藥基因也有影響,研究證實,不同國家的健康人群腸道耐藥基因組的組成和豐度存在區別。Feng等[28]分析發現,來自相同國家的人群腸道耐藥基因會傾向于相似,且不同國家人群擁有自己的代表性耐藥基因(representative/discriminative ARGs)。例如,ermF和tetQ是中國人群的代表性耐藥基因,萬古霉素類耐藥基因可同時作為奧地利、瑞典、日本和美國的代表性耐藥基因。目前,已有多個研究證實,同西班牙、丹麥、法國、德國、瑞典和美國等歐美國家相比,中國人群腸道擁有更高豐度的耐藥基因[9,28]。H?sler等[41]研究發現,2015年德國境內來自敘利亞、阿富汗和伊拉克的難民人群腸道中耐藥基因與德國本地人群的腸道耐藥基因存在差異,耐藥基因vanC1、qnrB、blaOXA-1和blaCTX-M group 1在三國難民腸道中檢出較多,而在德國本地人群腸道中耐藥基因vanB普遍存在,qnrB和blaOXA-1則沒有檢出。
飲食及生活方式、經濟收入和環境等因素也可能對腸道耐藥基因組的組成與多樣性有一定的影響[11]。非洲坦桑尼亞地區的哈扎人過著原始的生活,拒絕現代社會的生活方式,他們以狩獵采集為生,食譜包括猴面包樹果實、各種肉類、漿果和蜂蜜等,幾乎從未攝入過加工食品和抗生素。研究者發現,他們擁有更為豐富的腸道菌群,并且腸道中耐藥基因多樣性相較美國人要偏低,反映出飲食及生活方式對腸道耐藥基因的影響[42]。來自低收入國家和工業化程度較低國家的人群與西方工業化國家相比,腸道耐藥基因豐度傾向于更高,這說明,經濟收入可能作為一種因素影響人體腸道耐藥基因組組成[43]。如今,環境污染對人體健康的影響備受關注,一些環境污染物如重金屬和抗生素等可通過食物鏈進入人體腸道,影響腸道菌群和耐藥基因組的組成。此外,耐藥基因在水環境、土壤和大氣等介質中普遍存在,形成一個天然的耐藥基因儲存庫,并且可能通過食物鏈進入人體腸道進一步影響腸道耐藥基因組[44-48]。
2.2 人體腸道耐藥基因組的來源
人體腸道微生物的來源與母體密切相關,從腸道、口腔、陰道和母乳來源的母體微生物可能通過母嬰傳播到達胎兒或新生兒的腸道并參與子代腸道菌群的早期定植,這些微生物也是子代腸道耐藥基因的來源[49-50]。研究表明,在正常妊娠過程中,胎盤屏障并不能阻止微生物在母-胎之間的垂直傳播[49]。長期以來人們認為子宮是一個無菌環境,以保障胎兒的健康發育,因此,前期觀點認為胎兒是在生產過程中以及出生后開始獲得腸道細菌的。近年來,隨著分子生物學的不斷發展以及測序技術的廣泛應用,已開始有證據表明,孕婦子宮、羊水和胎盤中存在細菌,并且會直接影響胎兒腸道菌群的獲得與定植,然而這些細菌對孕婦及胎兒生理健康的影響仍有待探究[50-51]。胎兒在妊娠16周時就可以吞入羊水,經過吸收后再通過尿液和胎便排出到宮腔中,胎便成分主要包括羊水、胎毛和掉落的細胞等。相關研究證實,胎便中存在細菌,并且有耐藥基因的檢出,如葡萄球菌、鏈球菌、腸球菌以及四環素類耐藥基因和β-內酰胺類耐藥基因等[49,50,52]。目前,胎便菌群的具體來源還未能完全確定,已報道的來源主要有母體的腸道菌群、陰道菌群以及口腔菌群,這些菌群可能通過胎盤屏障進入子宮和胎兒腸道中,其中,母體的腸道微生物可能是子代腸道菌群最重要的來源。研究表明,人類胎便中檢出的埃希氏菌屬和腸球菌屬就是腸道常駐菌群[50,53]。此外,一些免疫細胞如樹突狀細胞能夠攜帶微生物穿過腸道屏障進入腸道淋巴系統并進入血液當中,使得母體一些腸道微生物可能傳播至胎盤和胎兒腸道中[54]。Jiménez等[50]將一株從人體獲得的屎腸球菌熒光標記后讓孕鼠口服攝入,在剖宮產后的羊水和子代的胎便中能夠分離出該標記菌,進一步說明母體腸道中的細菌能夠通過胎盤屏障進入子宮和胎兒腸道中。
新生兒的腸道菌群和耐藥基因除了前期從母體子宮內獲得外,還受到分娩過程和母乳喂養的影響[32,55-56]。順產的新生兒在分娩過程中可以獲得母親的陰道菌群,如乳酸桿菌屬、雙歧桿菌屬和普氏桿菌屬等,剖宮產的新生兒腸道菌群與母體腸道菌群相似性較低,并且同順產嬰兒相比,剖宮產嬰兒的腸道菌群傾向于攜帶更大比例的耐藥基因,在醫院出生的新生兒還可能受到周圍環境中耐藥細菌的威脅[32,56]。在新生兒成長過程中,母乳喂養也會影響嬰兒的腸道菌群、耐藥基因組和可移動遺傳元件。母乳中有檢出乳桿菌屬、葡萄球菌屬、腸球菌屬和鏈球菌屬,以及mecA和ermB等耐藥基因,并且可移動遺傳元件的存在可能會促進耐藥基因在母嬰之間的傳播擴散[55,57]。
3 人體腸道耐藥基因組的傳播和進化(The propagation and evolution of human gut resistome)
3.1 腸道耐藥基因組的傳播
人體腸道微生物及其攜帶的耐藥基因可以通過城市污水處理廠出水排放進入環境,從而影響環境中的耐藥基因組[10,58-59]。傳統的糞便污染指示菌如大腸桿菌、擬桿菌屬和雙歧桿菌屬可以用來探究水環境的糞便污染。近期有文獻報道,噬菌體crAssphage也可以作為環境中人類糞便污染的示蹤標記,借助該標記的研究證明人類糞便的排放能夠影響環境中耐藥基因的組成[59]。此外,耐藥基因也可以通過動物攜帶傳播、河流和風力等自然作用傳播以及醫院和社區的人際傳播等途徑進入人體[10]。一些在北極生活的候鳥遷徙路徑可橫跨六大洲,耐藥基因可能借助這些動物進行遠距離傳播[4]。已有研究表明,在食品、飲用水和霧霾樣品中都檢出了耐藥基因,這些耐藥基因可能通過食物鏈和呼吸等暴露途徑進入人體[44-48]。2016年,我國在零售肉類、養殖場及環境中發現分離的大腸桿菌質粒上攜帶多粘菌素耐藥基因mcr-1,這是首次被發現的可以通過質粒在不同菌屬之間傳播擴散的多粘菌素耐藥基因[46]。目前,已證實該基因在全球35個不同國家和地區的人、動物和環境源等的多種腸桿菌中廣泛傳播,引起世界范圍的廣泛關注。
在微觀分子水平上,耐藥基因的傳播方式可以分為垂直基因傳遞和水平基因轉移。垂直基因轉移是由親代將遺傳信息傳遞給下一代,水平基因轉移可以在同種屬和不同種屬之間交換遺傳物質。細菌耐藥性可以分為固有耐藥/天然耐藥(intrinsic resistance)和獲得性耐藥(acquired resistance)。固有耐藥是由細菌染色體上位置保守的固有耐藥基因決定,賦予細菌對抗生素天然耐藥的特性,可以通過垂直基因傳遞將耐藥基因傳遞給子代[60-61]。獲得性耐藥是由于敏感菌發生基因突變或者獲得外源性耐藥基因而產生的。敏感菌可以通過質粒(plasmid)、轉座子(transposon)、整合子(integron)和噬菌體(phage)等可移動遺傳元件(MGEs)以轉化(transformation)、接合(conjugation)和轉導(transduction)等水平基因轉移的方式獲得外源性耐藥基因,從而成為耐藥細菌來抵抗外界抗生素的脅迫,給臨床抗感染治療帶來巨大的困難和挑戰(圖2)[3-4,62]。轉化是受體細菌可以從周圍環境中直接獲取DNA片段,并整合表達從而獲得耐藥性;接合是通過供體菌和受體菌的性菌毛接觸形成通道來進行基因交流,接合轉移的載體多為可自主轉移的質粒或接合性轉座子;轉導是噬菌體在脫離原宿主菌并重新組裝成子代噬菌體時,會攜帶部分原宿主菌基因如耐藥基因,在侵染新宿主菌同時將耐藥基因整合到宿主菌上,使其表現出耐藥性[62]。有報道指出,在哺乳動物腸道中,耐藥基因更傾向于通過接合和轉導來進行水平基因轉移,而不是轉化[13,63]。研究證明,腸道厚壁菌門的厭氧菌可以通過接合的方式將萬古霉素類耐藥基因vanB傳給條件致病菌[64-65]。擬桿菌屬腸道細菌能通過接合性轉座子CTnDOT傳播耐藥基因使得其他細菌獲得四環素和紅霉素耐藥性,并且低濃度四環素暴露可以進一步促進該轉座子對耐藥基因的接合轉移[66]。近年來,學者們發現噬菌體也是腸道微生物生態系統的重要組成部分,與人類疾病和健康存在密切聯系,并且是耐藥基因水平轉移的重要元件[67]。針對80位健康志愿者的糞便樣品的研究證實,>70%的樣品中的噬菌體攜帶至少一種耐藥基因如blaTEM、blaCTX-M-1和qnrA等[68]。此外,研究者發現,口服抗生素能夠增高小鼠腸道噬菌體中耐藥基因的豐度,并促進噬菌體對耐藥基因的水平轉移[69]。
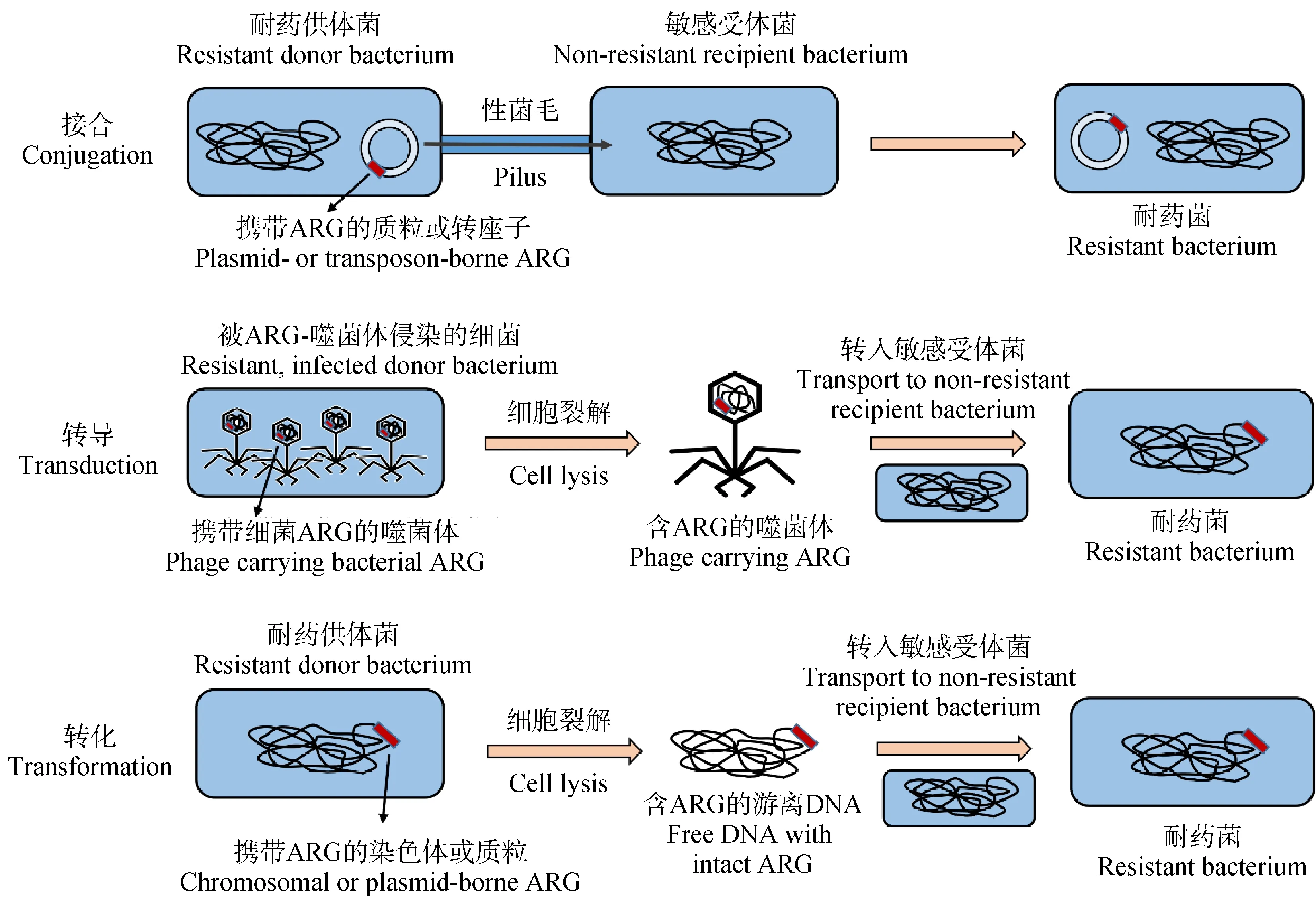
圖2 水平基因轉移的3種主要方式[3,62]注:ARG表示耐藥基因。Fig. 2 Three main mechanisms of horizontal gene transfer [3,62]Note: ARG stands for antibiotic resistance genes.
3.2 腸道耐藥基因組的進化
在1928年Alexander Fleming發現青霉素前,具有耐藥性的細菌早已在地球上出現,在距今約400萬年的洞穴斷層樣品和3萬年前的永久凍土中檢出了耐藥細菌和耐藥基因[8,70-71]。同時,Santiago-Rodriguez等[72]在11世紀的木乃伊腸道中發現了β-內酰胺類、四環素類、氯霉素類和氨基糖苷類等耐藥基因,證明細菌耐藥現象在人類腸道中早已存在,腸道耐藥細菌并非都是因服用抗生素形成的選擇壓力而篩選出來的。綜合眾多人體腸道、土壤和冰川等不同生態系統中耐藥基因的研究成果,學者們推測所有耐藥基因都起源于遠古時期環境中產抗生素細菌攜帶的前體耐藥基因(precursor-resistant genes),這些基因在自然條件下不斷進化和傳播,是一個緩慢并隨機的過程[5-7,73]。抗生素本身就是一些細菌和真菌等微生物的次級代謝產物,這些微生物同時也演化出相應的耐藥機制來避免自身受到抗生素的脅迫,從而在生存競爭中具備一定的優勢,這種耐藥性是自然界固有的一種特性[74]。固有耐藥基因可能是一些獲得性耐藥基因的來源,已有研究表明,固有耐藥基因能夠被可移動遺傳元件捕獲進而傳播至其他細菌中[75]。此外,獲得性耐藥也可以通過基因突變產生,當耐藥基因編碼的蛋白發生個別氨基酸位點變化時,就可能導致新的變體(variants)出現,使酶的水解底物范圍產生差異。β-內酰胺類抗生素為臨床最常用的一類抗菌藥物,到如今β-內酰胺類耐藥基因的很多亞型已擁有眾多變體,如TEM(>200種)、SHV(>160種)和CTX-M類(>130種) (http://www.lahey.org/studies/webt.htm)。TEM-1在1960年首次被發現可以通過質粒攜帶傳播,該酶可以水解青霉素和初代頭孢菌素,之后陸續發現該酶基因點突變后形成的變體,如TEM-2和TEM-3等[76]。TEM-3最初于1989年發現,并作為第一個可歸為超廣譜β-內酰胺酶(extended-spectrumβ-lactamases, ESBLs)的TEM耐藥基因。
雖然,細菌耐藥性并非因現代抗生素的應用而產生,但近年來抗生素的濫用顯著加速了腸道耐藥基因的進化和傳播。目前,抗生素在臨床和養殖業中都存在不合理使用及持續濫用的情況,大部分抗生素不能夠被人類或動物充分吸收[77]。剩余抗生素形成選擇性壓力,一方面能殺滅或抑制敏感細菌,降低其對耐藥細菌的生存競爭,促進耐藥基因和耐藥細菌不斷被篩選和富集;另一方面抗生素促進了耐藥基因在不同細菌間的水平轉移和傳播,水平基因轉移不僅發生在同種細菌中,甚至發生在不同種屬的細菌中,使得部分敏感細菌獲得耐藥性,這在細菌耐藥性的進化過程中起到重要作用。同自然環境相比,醫院中抗生素的使用劑量更高,加劇了腸道耐藥基因的進化速度,在諸多壓力的“層層選拔”下,多重耐藥細菌的生存優勢更為明顯,它們能夠對幾種抗生素同時耐藥,給臨床治療造成巨大的風險。研究者發現,超廣譜β-內酰胺酶的大量出現與1980年后頭孢菌素在臨床上的普遍應用有關,該類酶能夠對青霉素類及初代、二代和三代頭孢菌素耐藥,產ESBLs菌已經成為醫院感染的重要因素[78-79]。通過對23個歐洲國家的抗生素使用與耐藥細菌分析后發現,歐洲的細菌耐藥情況與醫療中β-內酰胺類抗生素和大環內酯類抗生素廣泛使用有關[80]。對美國在1950—2002年間從人體和食用動物的糞便、血液和尿液等中分離得到的大腸桿菌的耐藥性進行分析后發現,耐藥性進化與臨床新型抗生素市場化有直接關系[81]。
4 人體腸道耐藥基因組的研究展望(The future prospect of human gut resistome)
人類與病原微生物的斗爭是一場永恒的博弈,抗生素的濫用加速了腸道微生物耐藥基因組的進化,導致了對多種抗生素耐藥的“超級細菌”的催生與傳播,其同埃博拉病毒、SARS冠狀病毒和最新發現的新型冠狀病毒(SARS-CoV-2)等都對人類生命健康構成嚴重威脅。如今細菌耐藥形勢已經非常嚴峻,人體腸道耐藥基因組及耐藥細菌研究的學術意義和應用價值不言而喻,未來的研究重點應集中在以下幾個方面:
(1)統一實驗操作流程、實現人體腸道耐藥基因組的標準化分析對于該領域的研究具有非常重要的意義,相關分子生物學和生物信息學方法以及技術平臺也有待提升。
(2)有關人類腸道耐藥基因組的組成分布和影響因素的研究尚未完善,還有待全面深入的探究,新型耐藥基因仍在不斷被發現,耐藥基因數據庫仍需不斷補充和完善。全球人群類型眾多,加之影響腸道耐藥基因組的因素非常復雜,該領域大規模、多種類的人群樣品尤其是人群隊列樣品的研究數據仍十分缺乏,亟待建立大數據研究平臺。
(3)對腸道耐藥基因的具體傳播途徑仍缺乏足夠的認識,耐藥基因在腸道菌群尤其是致病菌間的傳播機制、在母嬰之間的遷移規律以及在環境—動物—人體多介質之中傳播擴散的研究還有待新的進展,只有了解各個環節的傳播途徑,才能有效遏制全球細菌耐藥性的傳播。
(4)關于人體腸道耐藥基因組健康風險的量化評估有待深入研究,從而為臨床耐藥菌感染的診治提供參考依據。在精準醫療的推動下,基于腸道耐藥基因組和耐藥細菌的個性化診療是未來的發展趨勢。
(5)為了應對細菌耐藥性的威脅,在臨床耐藥監測體系基礎上,進一步加強全球環境耐藥性監控體系建設是防控細菌耐藥危機和評估細菌耐藥性風險的重要手段。
(6)應用“One Health”策略探究腸道耐藥基因是未來的研究重點,隨著腸道耐藥基因組研究規模的不斷擴大,開展跨領域合作顯得愈加重要。全球生態環境在病原體的傳播中不容忽視,“One Health”的理念旨在建立一個跨學科、跨地區交流的全球合作策略,關注人類、動物和環境三者的相互影響,從而讓全球更好地應對新發傳染病、細菌耐藥、食品安全和環境污染等問題[82-84]。在面對世界公共衛生問題和生態環境問題時,沒有一個國家能獨善其身,我們應當樹立“人類命運共同體”意識,人類只有一個地球,全球的利益也是自身的利益。
◆

