化療對肺癌患者營養及免疫功能的影響
胡 琴,殷 飛,張 濤,黃 浩,王可武
(蕪湖第二人民醫院腫瘤內科,安徽 蕪湖 241000)
肺癌是臨床工作中最常見的惡性腫瘤之一,其發病率及死亡率一直居高不下,目前仍為全球惡性腫瘤死因分類統計的第一位[1]。化療仍為肺癌不可或缺的治療手段,患者在化療前后營養狀況可能會發生不同程度的變化,從而對患者的生活質量和病情的預后造成一定的影響。選擇合適的營養評價方法可及時了解患者營養狀況,及早的營養干預可改善營養不良,減少化療不良反應,提高患者化療的耐受性。有研究表明合理有效的營養支持可顯著降低惡性腫瘤患者的疾病并發癥及感染性并發癥的發生率[2-3]。有研究認為,腫瘤患者因化療導致的長期營養不良可使患者免疫功能出現不同程度的降低,嚴重者產生口炎、咽喉炎、胃腸道黏膜炎性反應等疾病,從而使營養不良發生惡性循環[4]。免疫功能的穩定依賴于輔助性 T 細胞和抑制性 T 細胞之間的平衡,CD4+細胞具有促進效應細胞抗腫瘤的作用,CD8+細胞主要起免疫抑制作用,CD4+/CD8+比值能反映二者之間的平衡,也可作為衡量腫瘤患者免疫抑制程度的指標,低CD4+、CD4+/CD8+水平對機體免疫狀態不利[5]。外周血檢測T淋巴細胞亞群是觀察機體細胞免疫的方法之一。本研究以我院初次入住腫瘤科的非終末期肺癌患者為研究對象,運用PG-SGA進行化療前后營養評價及T細胞亞群檢測,觀察化療對營養風險及免疫功能的影響。
1 資料與方法
1.1研究對象:收集本院2017年6月~2019年3月期間初次入住我科經病理證實為肺癌并有明確化療指征的待化療患者資料,共計52例,男27例,女24例,年齡31~75歲,平均(56.11±9.12)歲;腺癌28例,鱗癌15例,小細胞癌9例。所有患者在接受本次治療前1個月內未接受放化療及其他影響免疫功能的治療手段。
1.2納入標準:所有患者均有病理學診斷依據并預計生存期超過3個月,按我國衛生部診療規范進行術后輔助或者一線化療,患者KPS評分≥70分;血常規、肝腎功能、心電圖均無明顯化療禁忌;無嚴重基礎疾病;經溝通后簽署化療知情同意書。
1.3化療方案:本研究中所選化療方案:鱗癌患者選擇吉西他濱1.0 g/m2,第1天、第8天,順鉑 75 mg/m2第1天、第2天或卡鉑AUC=5,腺癌患者選擇培美曲塞600 mg/m2第1天順鉑 75 mg/m2第1天、第2天或卡鉑AUC=5,小細胞癌患者選擇依托泊甙100 mg/m2第1~3天+順鉑25~30 mg/m2第1~3天,每3周重復,化療期間嚴密觀察化療副反應。治療前均行基線檢查,化療每2周期療效評價。
1.4研究方法:PG-SGA專門為腫瘤患者所設計,內容包括營養篩查和營養評估兩部分,優點是使用簡便、臨床易操作實施,既可用于存在營養風險的患者,也可用于已經發生營養不良的患者。對于存在營養風險的患者通過PG-SGA進行營養評估、將患者的營養狀況分為 A組(0~3分) (營養良好)、B組(4~8分)(可疑或中度營養不良)、 C組(≥9分)(重度營養不良)三個等級,≥9分則需要給予營養干預或改善癥狀的治療。C組患者予以營養治療改善后達到B組后再進行化療,化療前所有患者測定外周血T淋巴細胞亞群 (CD3+、CD4+、CD8+);于化療2周期后重復上述內容,比較化療前后營養狀況及免疫功能影有無影響。

2 結果
2.1患者化療前后營養狀況PG-SGA分組構成比:52例患者中均至少完成化療2周期,化療前PG-SGA評分≥9 分2 例,予以營養干預后重新評分低于8分后行化療。化療前PG-SGA評分≥9 分6 例。見表1。

表1 研究組化療前和化療后PG~SGA分組構成比
2.2患者化療前后免疫指標比較:52例患者化療前、后免疫功能檢測結果見表2,所有患者化療后CD8+表達均升高,NK細胞表達均下降,與化療前相比差異無統計學意義(P>0.05);28例化療有效患者化療后CD4+、CD4+/CD8+表達升高,化療前相比有差異有統計學意義(P<0.05),CD8+表達與化療前相比明顯升高,NK細胞表達下降,但與化療前比差異無統計學意義(P>0.05)。24例化療無效病例化療后NK細胞、CD4+、CD4+/CD8+表達下降,與化療前相比,差異有統計學意義(P<0.05),CD8+化療后表達無顯著性差異(P>0.05),NK細胞表達下降,與化療前相比,差異有顯著統計學意義(P<0.01)。見表2。
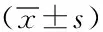
表2 患者化療前后免疫指標比較
3 討論
惡性腫瘤患者通常存在營養風險,營養風險會潛在影響并發癥發生率、感染發生率、住院時間等[6],化療副反應又會進一步影響患者的營養狀況,進而可能影響患者的生活質量[7]。化療在營養篩查的指導下針對性早期腸內營養可以提高患者的營養狀況,減少化學治療并發癥,增強免疫功能,提高患者對化療的耐受能力[8]。因此,目前對腫瘤患者圍化療期行營養支持,已成為研究的熱點及重點[9]。腫瘤化療患者普遍存在營養不良或營養代謝紊亂,與以往研究結果一致[10-11]。對于腫瘤患者如果發現有營養風險并存在營養不良,應及時營養治療給予糾正,否則機體對化學治療的耐受性將會降低。PG-SGA可以較好地反映常見消化道惡性腫瘤患者的營養狀況,中國抗癌協會腫瘤營養與支持治療專業委員會推薦使用[12]。本組資料對于行PG-SGA發現營養評分≥9分的患者先予以營養治療,改善后直至低于8分再行化療。患者化療前PG-SGA A組的比例73.1% ,而化療后PG-SGA A組的比例為61.5%,且重度營養不良發生率高,經統計學處理,差異有統計學意義(P<0.05),結果顯示化療后比化療前營養不良發生率高。腫瘤患者營養不良的原因有心理因素、抗腫瘤治療、腫瘤本身的消耗、能量消耗異常等。T 細胞及NK 細胞在抗腫瘤免疫中具有極其重要的作用。T 淋巴細胞亞群是具有特殊標志的人胸腺輸出細胞,執行細胞免疫功能及免疫調節功能,其中CD3+細胞代表成熟淋巴細胞,是細胞免疫中主要的活性細胞。 根據 CD 表型可分為CD4+和CD8+兩大亞群。在T 細胞網絡中,CD4+和CD8+細胞處于調節樞紐地位,其數量和比值變化反映機體免疫功能狀態[13]。本組資料結果顯示,所有患者化療后CD8表達均升高,NK細胞表達均下降,與化療前相比差異無統計學意義(P>0.05);33例化療有效患者化療后CD4、CD4+/CD8+表達升高,與化療前相比,差異有統計學意義(P<0.05),CD8表達與化療前相比明顯升高,NK細胞表達下降,但與化療前比差異無統計學意義(P>0.05)。19例化療無效病例化療后NK細胞、CD4+、CD4+/CD8+表達下降,與化療前相比,差異有統計學意義(P<0.05),CD8+化療后表達無顯著性差異(P>0.05),NK細胞表達下降,與化療前相比,差異有顯著統計學意義(P<0.01)。該結果提示對于惡性腫瘤患者,合理有效的治療方案因減少腫瘤負荷可能會降低腫瘤對機體免疫系統的抑制作用,通過增強T淋巴細胞的免疫效應,改善機體的免疫功能狀態。有研究認為化療后CD3+、CD4+均明顯增高,與化療前比較,差異有統計學意義(P<0.05)。NK細胞又稱自然殺傷細胞,除具有殺傷功能外,還對細胞免疫應答具有重要的調節作用。從本組資料來看,NK細胞在化療后呈明顯下降趨勢,尤其在化療無效組表達明顯,提示對化療無效的患者,化學治療可能會抑制NK細胞的活性,而對于化療有效的患者,這種抑制作用較輕。由于本資料樣本量較少,還有待于臨床進一步觀察。
綜上所述,肺癌患者存在一定的營養風險,且化療反應可能會加重消化系統負擔,對營養產生一定影響,另一方面雖然化療藥物可能對免疫系統有抑制作用,但只要選擇合理有效的治療,不但不會影響腫瘤患者營養狀況,還有可能提高其免疫系統功能,從而有助于增強機體的抗腫瘤能力,改善患者生活質量,以期延長患者生存時間。

