豬肺炎支原體山西株的分離與鑒定
張欣榮,岳偉東,張警文,任高雅,孫 錚,岳美杉,劉怡慧,范小瑞,賀俊平
(山西農業大學動物醫學學院,山西太谷030801)
豬支原體肺炎(Mycoplasma pneumonia ofswine,MPS)俗稱豬氣喘病[1],是由豬肺炎支原體(Mycoplasma hyopneumoniae,Mhp)引起的慢性消耗性呼吸道傳染病。豬被感染后呼吸系統免疫力下降,會繼發感染豬繁殖與呼吸綜合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、豬圓環病毒 2 型(Porcine circovirus type 2,PCV2)或豬流感病毒(Swine influenza virus,SIV)[2],豬的出欄率、生長率和飼料轉化率降低,大大影響養豬業的經濟效益。目前,主要通過飼料飲水添加抗生素來控制豬肺炎支原體對呼吸道的感染,但抗生素使用不當會使多種病原產生耐藥性,同時會存在獸藥殘留問題,導致豬肉品質降低[3]。病豬康復后可以產生自身免疫保護力,提示治療MPS 有效的措施是注射疫苗[4],但目前國內市場上的滅活疫苗均是進口疫苗,其與山西地方病原存在差異,而且滅活疫苗以體液免疫為主,免疫效力較低,需多次注射才能產生預期的保護效果[5],而多次注射又會增加養豬業的經濟成本,免疫所產生的經濟效益還需考慮[6]。國產疫苗168 弱毒苗“支必寧”使用范圍最廣,但其對一些支原體敏感的豬品種不適用[7],因為其原始菌株來自太湖豬中的二臉花豬,可能存在地域局限并不適用于對北方地方菌株的治療。Mhp 在全國各地區均為高感染率,而山西地區感染較為嚴重。在對新疆北部地區16 個規模化豬場的456 份豬血清樣品中檢測出Mhp 抗體陽性率為50.4%,感染陽性率為68.75%[8]。對山東地區豬支原體流行性調查發現,該地區Mhp 抗體檢測陽性率為56.48%[9]。對山西境內非免疫豬群抽檢發現,豬肺炎支原體血清抗體陽性率為36.5%以上[10],在山西省太原和晉中2 個區域7 個200 頭基礎母豬規模以上的豬場,發現各豬場母豬血清陽性率高達100%[11]。Mhp 有組織嗜性,能在活體豬肺中長期滯留,難以根除[12]。目前,缺乏山西豬肺炎支原體地方株有效菌株信息和相關病原學研究。
本研究對豬肺炎支原體山西地方株進行分離與鑒定,在晉中市進行流行病學調查,并采集病料,從采集到具有典型病理特征的肺臟中分離出豬肺炎支原體山西地方株,以期補充豬肺炎支原體山西地方株的菌株信息,同時為后續相關研究提供物質基礎和方法。
1 材料和方法
1.1 材料
1.1.1 病料采集 2019 年在晉中市各豬場進行流行病學調查,并進行PCR 鑒定。隨機抽取出現咳嗽、氣喘、腹式呼吸等典型豬支原體肺炎臨床癥狀的豬,病理解剖呈“蝦肉樣”、“胰樣”,經 PCR 鑒定患有豬支原體肺炎的豬肺臟,其中,一部分放到Bouin's 液中固定,一部分放入液氮中保存。
1.1.2 主要試劑及儀器 豬肺炎支原體168 活疫苗(乾元浩生物股份有限公司),KM2 培養基(江蘇省農業科學院),支原體固體平板培養基及輔助液(北京中海生物科技有限公司),細菌基因組提取試劑盒(天根生化科技(北京)有限公司),2×PCR Mix(康為世紀生物科技有限公司)和DNA Marker(中科瑞泰(北京)生物科技有限公司),孔徑為0.22 μm和 0.45 μm 的濾菌器(美國 Millipore),瑞氏染色液(北京索萊寶科技有限公司),組織基因組提取試劑盒(北京聚合美生物科技有限公司),石蠟(上海華申康復器材有限公司)。
組織包埋機(浙江省益迪醫療設備廠),切片機(浙江省益迪醫療設備廠),展片機(浙江省益迪醫療設備廠),烤片機(浙江省益迪醫療設備廠),光學顯微鏡(德國 Leica),PCR 儀(美國 Bio-RAD)。
1.2 方法
1.2.1 臨床癥狀與組織病理變化觀察 將具有典型臨床癥狀的豬剖殺,取其肺組織進行PCR 鑒定,為陽性的肺組織經Bouin's 液固定后制作石蠟切片(厚度為6 μm),肺組織切片通過HE 染色觀察組織病理變化。
1.2.2 病原體分離 其按照參考文獻[13]進行。無菌采集肺臟病健交界處組織1~2 g,剪成米粒大小,放入KM2 液體培養基中,于37 ℃恒溫培養;對培養基變色明顯的進行PCR 檢測,陽性結果立即傳代,陰性結果放棄培養,待其生長滴度穩定后接種至固體培養基上。
1.2.3 形態學觀察 將固體平板培養基置于倒置顯微鏡下,觀察菌落的形態,取液體培養物12 000 g離心5 min,將沉淀物制成涂片進行瑞氏染色。
1.2.4 生化特性鑒定 將臨床分離株進行尿素酶活性測定、葡萄糖水解試驗、精氨酸水解試驗、七葉苷水解試驗、甘露醇分解試驗,生化試驗按參考文獻[14]的方法進行。
1.2.5 分離株PCR 鑒定
1.2.5.1 16S rRNA 基因PCR 擴增 根據GenBank中Mhp 16S rRNA 基因的保守序列設計1 對特異性引物 F:5′-GGGTGAGTAACACGTACCTAAC-3′,R:5′-ACCGCGGCTGCTGGCACATAGT-3′。預期擴增片段436 bp,擴增體系為:2×Taq PCR Master Mix 5 μL,上游引物(10 μmol/L)0.4 μL,下游引物(10 μmol/L)0.4 μL,DNA 模板 1 μL,ddH2O 3.2 μL,總體系 10 μL。反應條件為:95 ℃ 5 min;95 ℃ 30 s,42 ℃ 30 s,72 ℃ 1 min,共 30 個循環;72 ℃ 8 min,4 ℃保存。產物經1%瓊脂糖凝膠電泳分析。
1.2.5.2 P36 基因 PCR 擴增 根據 GenBank 中報道的P36 全基因序列設計2 條擴增引物P1:5′-TT AGTGTCTCCCGTTATG-3′,P2:5′-GAAATCCGTAT TCTCCTC-3′。預期擴增大小為 621 bp,PCR 擴增反應體系為:2×Taq PCR MasterMix 5 μL,引物 P1(10 μmol/L)0.4 μL,引物 P2(10 μmol/L)0.4 μL,DNA 模板 1.5 μL,ddH2O 2.7 μL,總體系 10 μL。反應條件:95 ℃ 5 min,95 ℃ 30 s,42 ℃ 30 s,72 ℃ 1 min,共30 個循環;72 ℃8 min,4 ℃保存。產物經1%瓊脂糖凝膠電泳分析。
1.2.6 菌落PCR 鑒定 用槍頭蘸取數個平板培養基上的支原體菌落,代替1.2.5.2 反應體系中的DNA 提取物進行菌落P36 基因PCR 擴增,其中,ddH2O 用量改為7 μL,反應條件同1.2.5.2。產物經1%瓊脂糖凝膠電泳分析。
1.2.7 測序及序列分析 將電泳產物送至華大公司進行測序,并同GeneBank 和現有的其他菌種進行序列同源性分析和比對,利用MEGA 5.2 軟件對其進行分子進化上的親緣關系分析。
2 結果與分析
2.1 組織病理變化結果
病豬體型消瘦,出現明顯的腹式呼吸,被毛粗亂,精神沉郁,生長發育遲緩,消瘦少食(圖1);剖殺后眼觀病肺兩側有不同程度腫大,病健界限明顯,病變部位組織對稱性實變,實變區大小不一,呈斑塊形分布,質度硬實,缺乏彈性,呈典型的“蝦肉樣變”(圖2);鏡檢可見細支氣管周圍大量淋巴細胞,巨噬細胞浸潤,形成“管套”,管腔內纖毛脫落,有大量的炎性細胞和脫落的上皮細胞,肺泡腔可見巨噬細胞、淋巴細胞、脫落的肺泡上皮細胞和少量的漿液,肺泡隔因增生,炎性浸潤而增厚,呈典型的間質性肺炎特征。病肺組織損傷程度提示豬肺中的豬肺炎支原體毒力較強,嚴重影響豬的呼吸功能(圖3)。
2.2 分離培養結果
培養基在3~5 d 后由紅色變為淡黃色,提示變色后的培養物中含有豬肺炎支原體。變色后液體培養基顏色由紅色變為淡黃色,培養液澄清透亮,無沉淀,不渾濁,提示培養基中含有豬肺炎支原體、且無雜菌污染(圖4)。
2.3 形態學觀察結果
固體培養基上可見多數呈圓形以及中間暗、邊緣光滑的菌落(圖5),與支原體菌落相符。液體培養物涂片用瑞氏染色后,經油鏡觀察到點狀、兩極狀等大小在0.2 μm 左右的菌體(圖6),與支原體大小相符。
2.4 生化特性分析
本試驗的分離菌株生化特性符合支原體特性,與標準菌株168 相同,提示分離株為豬肺炎支原體(表 1)。
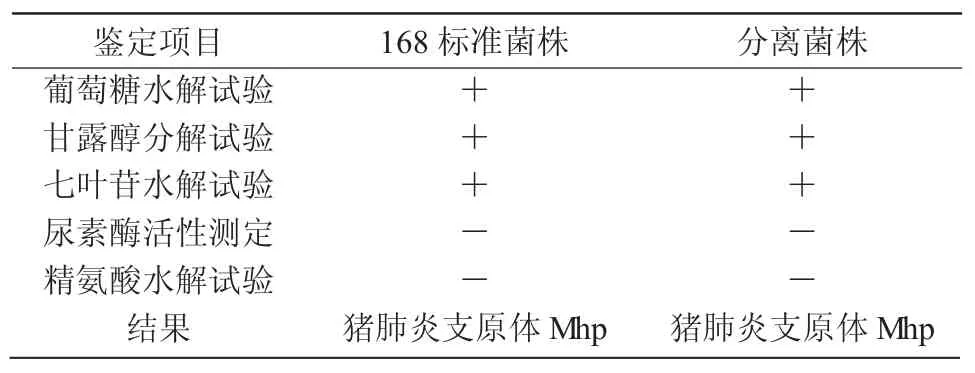
表1 分離菌株生化試驗結果
2.5 PCR 鑒定結果
16S rRNA PCR 擴增結果提示,分離物中含有支原體;1%瓊脂糖凝膠電泳結果顯示,標準菌株168 基因擴增出與預計大小一致的片段,證明該引物有效,同時分離株基因擴增出的條帶大小與陽性對照 168 株一致(圖 7)。
物種特異性P36 基因擴增結果提示,培養物中含有豬肺炎支原體,培養物基因擴增出與預計大小一致的特異性條帶,與陽性對照一致(圖8)。
2.6 序列比對結果
測序結果通過與GenBank 中登錄的168 株(中國江蘇)、168-L 株(中國江蘇)、NCTC10127 株(瑞士)、J 株(巴西)、F7.2C 株(比利時)、7422 株(巴西)、7448 株(巴西)進行比對,使用 MEGA 5.2 構建NJ(Neighbor Jioning)樹,采用 Bootstrap 檢驗方法,重復次數為1 000,得到進化樹如圖9 所示,該分離株與J 株、NCTC10127 株同源性較高,從分子水平上證明了分離株為豬肺炎支原體。
3 結論與討論
本研究從豬支原體肺炎典型病理特征的豬肺中通過液體培養基盲傳培養獲得1 株支原體,瑞氏染色結果顯示,該菌株大小在0.2 μm 左右,菌落形態呈典型的“煎蛋樣”,邊緣光滑。P36 基因PCR 測序結果與 168 株(中國江蘇)、168-L 株(中國江蘇)、NCTC10127 株(瑞士)、J 株(巴西)、F7.2C 株(比利時)、7422 株(巴西)、7448 株(巴西)進行比對,確認分離的支原體菌株為豬肺炎支原體,命名為JZ01 株。
本研究開展普查時對具有消瘦、氣喘、明顯的腹式呼吸、食欲不振等臨床癥狀的豬群中體型偏小的“僵豬”進行剖殺,選取經PCR 鑒定為陽性及病理組織學檢查為間質性肺炎的肺臟作為病料來源,在培養的過程中,3~5 d 培養基顏色變黃。培養基中的酚紅起到指示劑的作用,培養液由紅色變為淡黃色,其可作為觀察有無支原體生長的一種直觀簡便的方法[15]。由于臨床病肺中含有多種病原,Mhp 對生長環境要求苛刻,生長速度慢,在分離過程中不屬于生長優勢菌極易被其他雜菌干擾,研磨后的濾液通過0.45 μm 濾器,但仍有部分細菌可透過濾膜[16]。本試驗采用多點取樣,用液體培養基連續盲傳的方法,培養液通過0.22 μm 濾器過濾不但能使分離株適應人工培養,而且能達到富集的目的,并利用物理方法有效去除細菌性病原。
16S rRNA 是所有原核生物蛋白質合成必需的核糖體RNA,可以用來標志生物的進化距離和親緣關系,其具有高度穩定的保守區和可變區,根據保守區設計通用引物可以有效區別豬肺炎支原體和其他細菌[17]。本研究使用16S rRNA 保守序列設計引物對分離株的基因進行擴增,確認了分離菌株為支原體。
P36 基因控制Mhp 產生乳酸脫氫酶,其表面存在種屬特異性抗原決定簇,因此,P36 蛋白產生的抗體也具有種屬特異性[18],采用Mhp 的P36 基因設計引物對豬肺炎支原體J 株、豬鼻支原體、絮狀支原體和雞毒支原體進行檢測,結果顯示,只有豬肺炎支原體被擴增出來[10],Mhp 感染后產生針對P36蛋白特異的抗體,與其他支原體無交叉反應[19],提示P36 基因用于區分Mhp 和其他病原微生物具有高度的特異性。P36 基因PCR 擴增在檢測典型豬支原體肺炎的病變肺臟中陽性率為100%,檢測豬氣管拭子敏感性為100%,特異性為93.3%[15]。本研究使用P36 基因序列設計引物對分離株的基因進行擴增,確認了分離株為豬肺炎支原體;通過對P36基因PCR 陽性產物測序并與NCBI GenBank 數據庫登錄的豬肺炎支原體菌株進行序列比對,結果顯示,JZ01 株與J 株同源性較高但存在差異,提示目前豬肺炎支原體山西地方株發生變異,已對豬支原體肺炎滅活疫苗(J 株)產生免疫耐受性,滅活疫苗(J 株)無法提供全面的免疫保護。同時JZ01 株與國外致病株7448 株、7422 株的同源性比與國內168株高,提示JZ01 株可能由國外毒株進化而來,豬場在引進豬群時要提高檢測水平,自繁自養是凈化豬肺炎支原體的有效策略[20]。P36 基因序列含有大量的腺嘌呤和胸腺嘧啶,測序結果的突變堿基以A 和T 為主,堿基A、T 可能影響JZ01 株的毒力大小。
綜上所述,本試驗從最近發病的豬場成功分離到豬肺炎支原體山西地方株JZ01 株,一定程度上補充了山西地方株的菌株信息,并為深入研究豬肺炎支原體的致病機制奠定了基礎。

