雌激素對Min6細胞線粒體自噬的影響
李思怡,白博文,張媚,王雨佳,周鑫宇,趙玉巖
(中國醫科大學附屬第一醫院內分泌與代謝病科,沈陽 110001)
糖尿病是一種并發癥眾多,病程長的慢性疾病。胰島β細胞數量減少和功能受損從而導致胰島素分泌減少是糖尿病患者血糖升高的重要原因,因此,雌激素能夠降低糖尿病患病風險可能與其對胰島β細胞的保護作用有關。雌激素可以防止胰島β細胞凋亡,維持胰島素分泌,延緩糖尿病發病[1]。流行病學調查發現,絕經后婦女的糖尿病發病率比絕經前婦女高。多個研究[2-3]證實,雌激素替代療法可以顯著降低絕經后婦女的糖尿病患病風險。線粒體自噬既可以維持線粒體結構與功能穩定,又可以減少線粒體數量從而影響細胞存活,關于線粒體自噬對胰島β細胞影響的研究目前較為少見。本文通過研究雌激素對胰島β細胞 (Min6細胞) 線粒體自噬的影響,探討雌激素對胰島β細胞的保護作用。
1 材料與方法
1.1 材料
1.1.1 細胞:實驗用Min6細胞購自北京協和細胞庫。
1.1.2 試劑:RPMI 1640培養基 (美國Gibco公司),胎牛血清 (美國Gibco公司),0.25%胰蛋白酶 (美國Gibco公司),雌二醇 (美國Sigma公司),二甲基亞砜(DMSO,美國Sigma公司),Beclin-1 Antibody (英國Abcam公司),LC3B Antibody (英國Abcam公司),HSP60 Antibody(英國Abcam公司),TOM20 Antibody (英國Abcam公司),GAPDH Antibody (英國Abcam公司),辣根酶標記山羊抗兔IgG (中國中杉金橋生物技術有限公司),BCA 蛋白定量試劑盒 (中國弗德生物科技有限公司),ECL化學發光試劑盒 (中國碧云天生物技術公司)。
1.1.3 儀器:細胞培養箱 (美國Thermo公司),超凈工作臺 (中國蘇州凈化設備有限公司),透射電子顯微鏡 (日本JEOL公司),全自動酶標儀/熒光酶標儀 (瑞士Tecan公司),電泳儀 (美國Bio-Rad公司),電轉膜裝置 (美國Bio-Rad公司),圖像分析軟件 (美國Scoin Corporration)。
1.2 方法
1.2.1 細胞培養與分組:Min6細胞培養于含有10%胎牛血清的RPMI 1640培養基中,使用25 cm2培養瓶并在37℃,5%CO2的細胞培養箱中培養。待細胞長至80%~90%生長密度時,用0.25%胰蛋白酶消化獲得單細胞懸液,按1 ∶2~1 ∶3的比例傳代。根據前期實驗發現E2的最適作用濃度為10-7mol/L,最適作用時間為24 h,將同時段培養的處于對數生長期的細胞分為對照組 (培養基培養細胞24 h) 和E2組(10-7mol/L E2處理細胞24 h)。
1.2.2 透射電子顯微鏡觀察:細胞按照分組處理后用胰蛋白酶消化成細胞懸液收集離心,棄上清,沿管壁緩慢滴入預冷過的2.5%戊二醛,4 ℃固定1 h,PBS洗滌2次。1%鋨酸4 ℃固定1 h后PBS再次洗滌3次,進行電鏡標本脫水、包埋、切片 (厚度70~90 nm),檸檬酸鉛溶液和醋酸雙氧鈾50%乙醇飽和溶液分別染色15 min。透射電鏡觀察,收集圖像。
1.2.3 Western blotting:細胞按照分組處理后棄培養基,PBS清洗2次,用刮板收集細胞;RIPA裂解液冰上提取蛋白,采用BCA試劑盒蛋白定量;將定量好的蛋白與樣品用移液槍移至事先配置好的濃縮膠和分離膠中,開始電泳 (濃縮膠中電壓70 V,分離膠中電壓改為120 V);將蛋白通過轉膜 (200 mA) 從分離膠中轉至PVDF膜上,5%BSA溶液封閉1 h,TBST洗膜10 min×3次,一抗4 ℃孵育過夜;去除一抗,TBST洗膜10 min×3次,二抗搖床上孵育1 h,TBST洗膜10 min×3次,ECL發光,熒光成像儀曝光成像,Image J分析條帶灰度值。
1.3 統計學分析
采用SPSS 22.0軟件進行統計分析,計量資料用表示,組間比較采用t檢驗。P< 0.05為差異有統計學意義。
2 結果
2.1 E2減少Min6細胞中線粒體自噬體形成
電鏡結果顯示,與對照組相比,E2組中線粒體自噬體數量較少,見圖1。
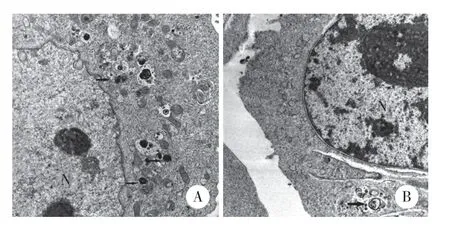
圖1 E2減少Min6細胞中線粒體自噬體的形成 ×20 000Fig.1 E2 reduces the formation of mitochondrial autophagosomes in Min6 cells ×20 000
2.2 E2對Min6細胞線粒體自噬的影響
與對照組 (0.82±0.09,0.63±0.03) 相比,E2組HSP60 (1.32±0.07) 和TOM20 (0.83±0.01) 表達水平升高,差異有統計學意義 (P=0.001 8和P=0.000 4)。與對照組 (1.30±0.10,1.14±0.09,1.04±0.08) 相比,E2組Beclin-1 (0.99±0.13)、LC3Ⅱ (0.79±0.08) 和LC3Ⅱ/LC3Ⅰ (0.78±0.09) 的表達水平降低,差異有統計學意義 (P=0.033 3,P=0.009 6和P=0.023 4),見圖2。
3 討論
糖尿病是由遺傳因素和環境因素共同作用引發的一種慢性疾病,隨著社會發展與人們生活方式的變化,糖尿病的發病率在近幾十年呈上升趨勢。根據國際糖尿病聯合會發布的數據,2017年全球糖尿病患病率已有8.4%,據估計,2045年糖尿病患病率將上升至9.9%[4]。與同齡男性相比,絕經后女性糖尿病的發病率更高,且并發癥發生速度更快,可能與體內雌激素水平降低有關。雌激素是人體內一種已經被證明對胰島功能具有保護作用的類固醇激素[5-6],現有研究[7-8]證實Min6細胞中存在雌激素經典受體ERα和新型受體GPER表達,但相關文獻較少,團隊的前期研究已經證實了GPER在Min6細胞中表達,提示雌激素可能通過與受體結合參與Min6細胞的生理過程。
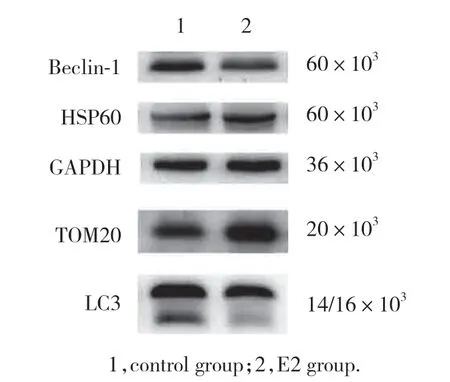
圖2 Western blotting檢測線粒體自噬相關蛋白的表達水平Fig.2 Expression levels of mitochondrial autophagy-related proteins measured using western blotting
自噬是細胞內發生的一種過多或異常蛋白質自我降解過程[9],而過度的自噬會引起胰島β細胞的功能損害[10],進而增加糖尿病發生的風險。線粒體存在于真核細胞中,具有雙模結構,是細胞的供能細胞器。其過氧化磷酸化生成的能量貨幣ATP通過參與多種代謝途徑,為細胞正常活動提供大量能量,維持細胞內環境的穩態[11]。線粒體自噬有助于維持線粒體的健康和能量來源[12],而過度的自噬會損害線粒體功能并誘導細胞死亡[13]。目前關于雌激素對胰島β細胞的保護機制尚不清楚,推測可能與雌激素對線粒體自噬的調控有關,為證實這一推測本研究檢測了線粒體自噬體數量、線粒體相關蛋白和自噬相關蛋白。
線粒體相關蛋白表達量的變化可以反映線粒體總量的改變,從而進一步反映細胞線粒體自噬的發生。同時選取線粒體基質蛋白HSP60、線粒體膜蛋白TOM20進行檢測,可以更全面地反映線粒體總量的變化。HSP60是由線粒體損傷引起的線粒體應激蛋白,主要定位于線粒體基質,在線粒體基質內的蛋白質折疊中發揮作用[14],是一種典型的線粒體分子伴侶。TOM20是一種線粒體外膜的轉位酶,通過其N端疏水片段錨定于線粒體外膜上,其親水域暴露于胞質側[15]。在檢測線粒體蛋白表達量時,同時選用線粒體基質蛋白HSP60和內膜蛋白TOM20來反映線粒體自噬活性更具有嚴謹性。Beclin-1通過調節PI3K生成和促進自噬體形成的ATG蛋白質來控制自噬過程[16],是自噬的關鍵調節因子。LC3與自噬體的發育和成熟相關,對自噬的發生至關重要,因此是公認的自噬活性評估標志蛋白,用于監測自噬活性[17]。自噬發生時,LC3從細胞質形式 (LC3Ⅰ) 轉化為磷脂酰乙醇胺綴合形式 (LC3Ⅱ),并隨后被募集至自噬體膜[18],因此可以用LC3Ⅱ/LC3Ⅰ來表示自噬的水平。本研究結果顯示,在E2處理過的Min6細胞中Beclin-1和LC3Ⅱ/LC3Ⅰ減少,提示E2組自噬被抑制。同時E2組HSP60與TOM20蛋白相比對照組有所增加,說明E2組細胞內線粒體總量增多,線粒體自噬被抑制。電鏡下E2組Min6細胞內線粒體自噬體數量比對照組有所減少也證實了這一結果。因此,本研究證實了雌激素對胰島β細胞的線粒體自噬起抑制作用,其具體的作用機制與途徑仍有待進一步研究。
綜上所述,雌激素可能通過抑制線粒體自噬發揮對胰島細胞的保護作用,從而降低糖尿病的發病風險。這一結論可以為絕經后婦女的糖尿病治療與研究提供新的思路和理論依據。

