針刺調控miR-128-3p對卒中大鼠神經功能及Nrf2表達影響
黃秀容,張子強,賴名殷,余瑾,袁青
(1.深圳市人民醫院,深圳 518001;2.廣州中醫藥大學針灸康復臨床醫學院,廣州 510405)
卒中在臨床中又被稱為中風,是神經系統主要疾病之一,其中 80%以上為缺血性卒中,該病致死率及致殘率高,治療周期長,預后差,多數患者會留下活動及語言功能喪失、偏癱等后遺癥,使患者生活信心喪失,造成極大的身心損傷,并給其家庭和社會帶來沉重的經濟負擔[1-2]。針灸治療卒中具有良好的療效,一直是臨床研究的重點,其與高壓氧、康復訓練聯合綜合治療,可協同改善卒中患者吞咽障礙[3];與PNF康復技術聯合治療卒中偏癱患者,可有效促進其上肢運動功能恢復,提高患者的生活質量[4],但其具體作用機制目前還未闡釋清楚。小膠質細胞激活誘導的神經炎癥是局灶性缺血性卒中的主要致病基礎[5],miR-128-3p可調控炎癥反應,下調 miR-128-3p表達,可通過抑制核因子-κB(nuclear factor-κB,NF-κB)通路活性而顯著減弱炎癥反應[6],且 miR-128b在腦梗死患者血清中高表達,與患者腦梗死嚴重程度呈正相關,是腦梗死的危險因素[7]。另外,紅系衍生的核轉錄相關因子(nuclear factor erythroid-derived 2-like 2,Nrf2)是炎癥及氧化應激的負調控因子,上調 Nrf2表達,可抑制小膠質細胞激活,減輕腦損傷[8]。然而針刺是否通過調控miR-128-3p改善卒中大鼠的神經功能及對Nrf2表達的影響目前還未見研究,本文通過建立腦缺血再灌注大鼠模型,對此進行探討。
1 材料與方法
1.1 實驗動物
SD大鼠(康美華大基因技術有限公司),清潔級,動物生產許可證號 SCXK(粵)2019-0027,動物使用許可證號 SYXK(粵)2019-0137,動物質量合格證號0019012317,雄性,體質量(200±20)g,所有大鼠在本院動物房中飼養,適應 1周后進行實驗。飼養條件為12 h/12 h交替照明,大鼠自由飲食、飲水,動物房環境應清潔、安靜、通風良好,溫度為(25±1)℃,相對濕度為(50±5)%。
1.2 主要試劑及儀器
華佗牌針灸針(0.25 mm×15 mm,190617,蘇州醫療用品有限公司);miR-128-3p agomir、miR-128-3p agomir陰性對照(C0719、C0811,上海吉瑪制藥技術有限公司);大鼠S100β ELISA試劑盒(YS04063B,上海雅吉生物科技有限公司);NSE ELISA試劑盒(SBJ-R0081,南京森貝伽生物科技有限公司);大鼠IL-6 ELISA試劑盒、TNF-α ELISA試劑盒、GAPDH一抗、兔源Nrf2一抗、羊抗兔二抗(ab100772、ab100785、ab181602、ab137550、ab150077,Abcam公司);RNAiso Plus、逆轉錄試劑盒、熒光定量PCR試劑盒(9108、RR037Q/A/B、639519,Takara公司);蛋白提取試劑盒(C006325-0150,上海生工生物工程股份有限公司);BCA試劑盒、蘇木素-伊紅(hematoxylin-eosin,HE)染色試劑盒(P0011、C0105,上海碧云天生物技術有限公司);光學顯微鏡(SMZ745,尼康公司);切片機(CM3050S,Leica公司,德國);酶標儀(XElx800,Perkin Elmer公司);高通量DNA合成儀(3900,應用生物系統公司);凝膠成像系統(2500,上海天能公司)。
1.3 模型制備及分組
參考文獻中方法[9]制備 MACO模型,具體為腹腔注射45 mg/kg劑量的2.5%戊巴比妥鈉溶液麻醉大鼠,仰臥固定在操作臺后,消毒、頸部備皮、鋪巾,逐層打開頸部,鈍性分離大鼠左側頸總動脈(common carotid artery,CCA)、頸外動脈(external CA,ECA)、頸內動脈(internal CA,ICA),并以縫合線結扎 CCA、ECA近心端,同時以動脈夾夾閉ICA,于CCA分叉部4 mm處剪一小口,將一根直徑為 0.24 mm栓線插入 CCA直到ICA,使大腦中動脈血流受阻,將拴線尾端部分固定于皮膚外后逐層縫合切口,2 h后抽出栓線即完成模型制備。觀察大鼠活動情況,根據Longa分級法[10]對其神經功能缺損進行評分,標準如下,無神經功能缺損,0分;不能完全伸展對側前爪,1分;行走向對側轉圈,2分;行走向對側傾倒,3分;意識喪失,不能自發行走,4分;死亡,5分。當評分達到1~3分時表示模型制備成功[10],共制備65只,成功60只,隨機分為模型組、激動劑組、激動劑陰性對照組、針刺組、針刺+激動劑組,每組12只。另取12只大鼠僅分離CCA、ECA、ICA后縫合傷口,其他操作相同,設為假手術組。
參照文獻[11]針刺組、針刺+激動劑組大鼠于雙側陽陵泉穴及曲池穴行針(參照《實驗針灸學》“動物針灸穴位圖譜”及解剖學方法進行大鼠穴位定位),每10 min行針1次,捻轉角度180°,頻率每分鐘80次,力度均勻適中,每次行針持續 1 min,共留針 30 min,每日1次,持續治療7 d。參照說明書及文獻[12],以生理鹽水溶解miR-128-3p agomir、miR-128-3p agomir陰性對照配制為終濃度 20 μM的溶液,以 5 mL/kg劑量對激動劑組、激動劑陰性對照組、針刺+激動劑組大鼠進行尾靜脈注射,假手術組、模型組和針刺組尾靜脈注射等劑量生理鹽水,每日1次,持續7 d。
1.4 指標檢測
1.4.1 大鼠神經功能損傷檢測及標本收集
末次給藥24 h后,對各組大鼠進行神經功能缺損評分,然后尾靜脈取血 4 mL,靜置后離心,取上清液即為血清,儲存在﹣80℃備用。將大鼠麻醉后處死,解剖后獲得腦皮質組織,部分分裝為0.5 g/管,置于液氮中速凍10 min后,移至﹣80℃保存備用;部分腦皮質組織以生理鹽水漂洗干凈,置于 4%多聚甲醛溶液中固定,使用低濃度到高濃度梯度乙醇依次處理脫水,經二甲苯透明、石蠟包埋后,采用切片機做病理切片備用。
1.4.2 大鼠腦皮質組織病理損傷檢測
選取完整的腦皮質切片,經脫蠟、高濃度到低濃度梯度乙醇浸泡處理后,參照HE試劑盒說明書的步驟進行HE染色,再次脫水、透明后封片,使用光學顯微鏡觀察大鼠腦皮質組織病理變化,任選5個視野進行拍照。
1.4.3 大鼠血清S100β、NSE、IL-6、TNF-α水平檢測
血清置于4℃冰箱中解凍,以大鼠ELISA試劑盒檢測其中 S100β、NSE、IL-6、TNF-α水平,具體操作如下。將梯度稀釋的標準品及樣品分別加入酶標板孔內,每孔 100 μL,封孔后置于 37℃孵育 90 min,洗板 3次;然后分別添加生物素抗體溶液,每孔 100 μL,置于37℃孵育45 min,洗板3次;再分別添加酶反應底物溶液,每孔100 μL,37℃避光孵育15 min;加入反應終止液 50 μL,采用酶標儀檢測各孔在 450 nm下吸光值(optical density,OD),繪制標準品濃度與OD值曲線圖,根據樣品OD值計算其濃度。
1.4.4 大鼠腦皮質組織miR-128-3p、Nrf2 mRNA水平檢測
取腦皮質組織 0.5 g粉碎后,加入 RNAiso Plus混勻后,參照其說明書的操作步驟提取總 RNA,然后以逆轉錄試劑盒、熒光定量PCR試劑盒將其逆轉錄后進行熒光定量PCR反應,反應體系如下。SYBR? Premix EX Taq TMⅡ(2×)10 μL,上下游引物各 1 μL,cDNA 1.5 μL,無菌水6.5 μL,總計20 μL。反應條件為95℃ 30 s,1個循環;95℃ 5 s,60℃ 30 s,40個循環。miR-128-3p、U6、Nrf2、GAPDH引物由上海生工生物工程股份有限公司合成。以U6為miR-128-3p的內參,以GAPDH為Nrf2的內參,采用 2﹣ΔΔ3)t算法對所得實驗數據進行計算分析,進而得到各組大鼠 miR-128-3p、Nrf2 mRNA相對表達量,各基因引物序列見表1。
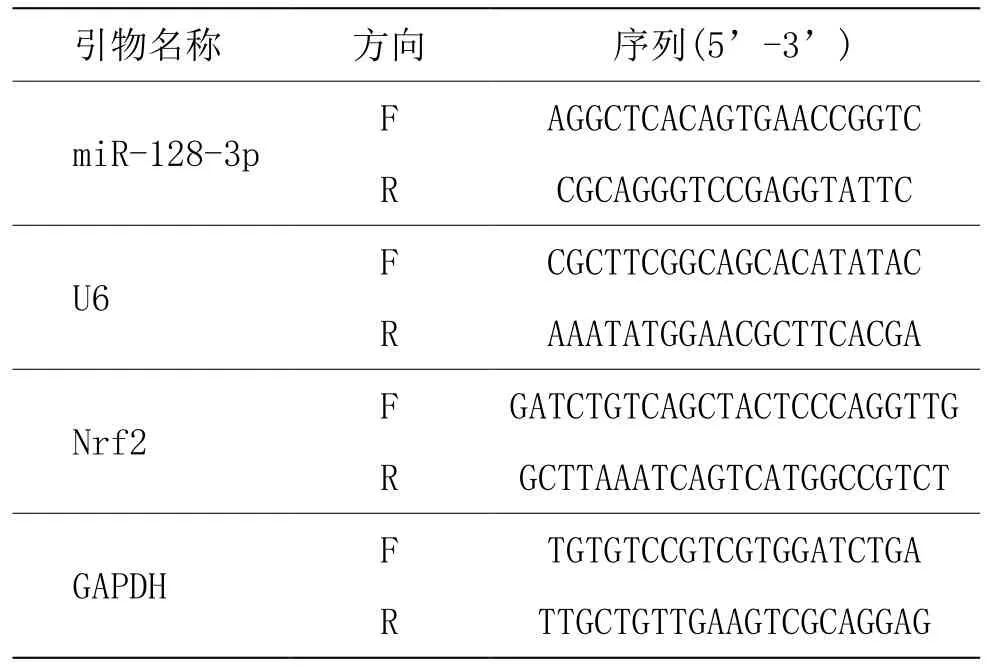
表1 RT-qPCR引物序列
1.4.5 大鼠腦皮質組織Nrf2蛋白表達檢測
取0.5 g腦皮質組織粉碎后,加入蛋白裂解液混勻制備為勻漿液,離心后取上清液,獲得總蛋白樣品液,采用BCA試劑盒測量蛋白總濃度,煮沸變性后,各組取含相同質量總蛋白的樣品液上樣,進行電泳使蛋白分離,然后將其轉移至PVDF膜上,置于5%脫脂奶粉溶液中室溫封閉,根據目的蛋白分子量截取蛋白條帶置于孵育盒中,分別加入兔源一抗 GAPDH(1:1000)、Nrf2(1:500),于 4℃冰箱中孵育過夜,經 TBST漂洗 3次,加入羊抗兔二抗(1:2000),于搖床上室溫孵育2 h,經TBST再次漂洗3次,采用增強化學發光法顯色,使用凝膠成像系統對蛋白條帶進行拍照,并以 Quantity One軟件分析圖像,得到各組蛋白相對表達量。
1.5 統計學方法
實驗數據采用SPSS24.0軟件進行統計分析。符合正態分布的計量資料采用均數±標準差表示。符合正態分布和方差齊性的計量資料,組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗;若不符合則采用Kruskal-Wallis檢驗。以P<0.05表示差異有統計學意義。
2 結果
2.1 各組大鼠神經功能比較
與假手術組相比,模型組大鼠神經功能缺損評分明顯升高(P<0.05)。與模型組相比,激動劑組大鼠神經功能缺損評分升高(P<0.05),激動劑陰性對照組大鼠無明顯變化(P>0.05),針刺組大鼠神經功能缺損評分降低(P<0.05)。與針刺組比較,針刺+激動劑組大鼠神經功能缺損評分升高(P<0.05)。與激動劑組比較,針刺+激動劑組大鼠神經功能缺損評分降低(P<0.05)。詳見表2。
表2 各組大鼠神經功能缺損評分比較 (±s,分)
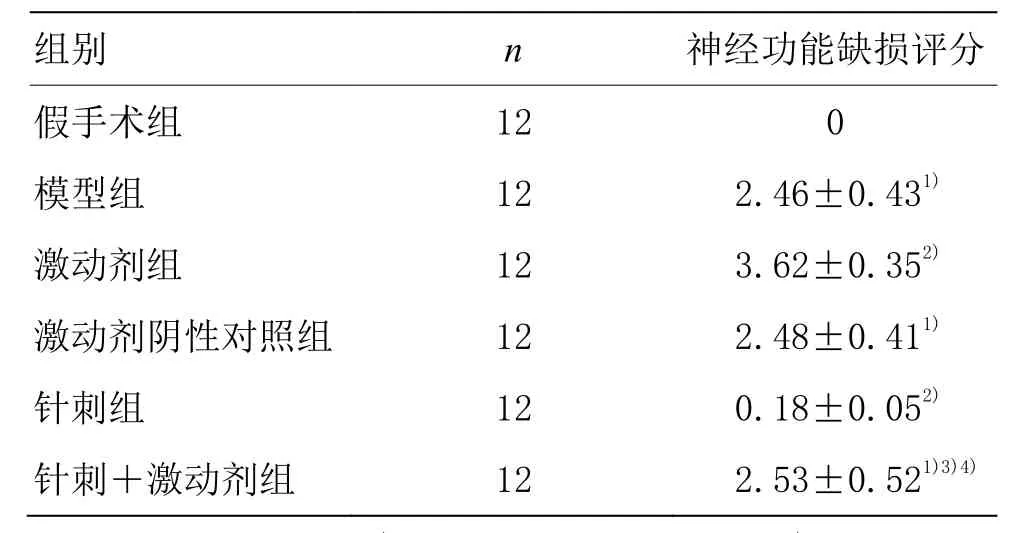
表2 各組大鼠神經功能缺損評分比較 (±s,分)
注:與假手術組比較 1)P<0.05;與模型組比較 2)P<0.05;與針刺組比較3)P<0.05;與激動劑組比較4)P<0.05
組別 n 神經功能缺損評分假手術組 12 0模型組 12 2.46±0.431)激動劑組 12 3.62±0.352)激動劑陰性對照組 12 2.48±0.411)針刺組 12 0.18±0.052)針刺+激動劑組 12 2.53±0.521)3)4)
2.2 各組大鼠腦皮質組織病理學形態
假手術組大鼠腦皮質中神經元無病理損傷。模型組大鼠腦皮質中神經元呈現細胞核收縮變小、細胞壞死、數量減少等病理損傷。與模型組相比,針刺組大鼠腦皮質中神經元病理損傷減輕,激動劑組大鼠腦皮質中神經元病理損傷加重,激動劑陰性對照組大鼠無明顯變化。與針刺組比較,針刺+激動劑組大鼠腦皮質中神經元細胞核皺縮、細胞壞死等病理損傷加重。與激動劑組比較,針刺+激動劑組大鼠腦皮質中神經元上述病理損傷減輕。詳見圖1。
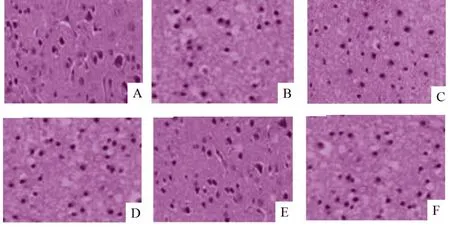
圖1 各組大鼠腦皮質組織HE染色結果(×200)
2.3 各組大鼠血清 S100β、NSE、IL-6、TNF-α水平比較
與假手術組相比,模型組大鼠血清 S100β、NSE、IL-6、TNF-α水平明顯升高(P<0.05)。與模型組相比,針刺組大鼠血清 S100β、NSE、IL-6、TNF-α水平降低(P<0.05),激動劑組大鼠血清 S100β、NSE、IL-6、TNF-α水平升高(P<0.05),激動劑陰性對照組大鼠無明顯變化(P>0.05)。與針刺組比較,針刺+激動劑組大鼠血清 S100β、NSE、IL-6、TNF-α水平升高(P<0.05)。與激動劑組比較,針刺+激動劑組大鼠血清S100β、NSE、IL-6、TNF-α水平降低(P<0.05)。詳見表3。
表3 各組大鼠血清中S100β、NSE、IL-6、TNF-α水平比較 (±s)
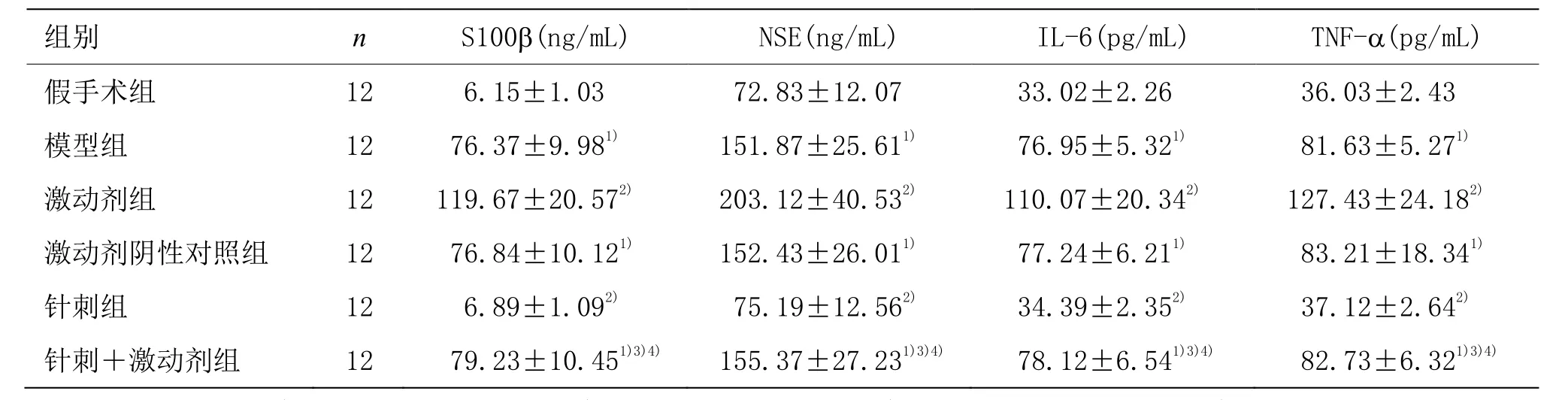
表3 各組大鼠血清中S100β、NSE、IL-6、TNF-α水平比較 (±s)
注:與假手術組比較1)P<0.05;與模型組比較2)P<0.05;與針刺組比較3)P<0.05;與激動劑組比較4)P<0.05
組別 n S100β(ng/mL) NSE(ng/mL) IL-6(pg/mL) TNF-α(pg/mL)假手術組 12 6.15±1.03 72.83±12.07 33.02±2.26 36.03±2.43模型組 12 76.37±9.981) 151.87±25.611) 76.95±5.321) 81.63±5.271)激動劑組 12 119.67±20.572) 203.12±40.532) 110.07±20.342) 127.43±24.182)激動劑陰性對照組 12 76.84±10.121) 152.43±26.011) 77.24±6.211) 83.21±18.341)針刺組 12 6.89±1.092) 75.19±12.562) 34.39±2.352) 37.12±2.642)針刺+激動劑組 12 79.23±10.451)3)4) 155.37±27.231)3)4) 78.12±6.541)3)4) 82.73±6.321)3)4)
2.4 各組大鼠腦皮質組織 miR-128-3p、Nrf2 mRNA水平比較
與假手術組相比,模型組大鼠腦皮質組織 miR-128-3p水平明顯升高(P<0.05),Nrf2 mRNA水平明顯降低(P<0.05)。與模型組相比,針刺組大鼠腦皮質組織miR-128-3p水平降低(P<0.05),Nrf2 mRNA水平升高(P<0.05);激動劑組大鼠腦皮質組織 miR-128-3p水平升高(P<0.05),Nrf2 mRNA水平降低(P<0.05);激動劑陰性對照組大鼠無明顯變化(P>0.05)。與針刺組比較,針刺+激動劑組大鼠腦皮質組織 miR-128-3p水平升高(P<0.05),Nrf2 mRNA水平降低(P<0.05)。與激動劑組比較,針刺+激動劑組大鼠腦皮質組織miR-128-3p水平降低(P<0.05),Nrf2 mRNA水平升高(P<0.05)。詳見表4。
2.5 各組大鼠腦皮質組織中Nrf2蛋白表達
與假手術組相比,模型組大鼠腦皮質組織中 Nrf2蛋白表達明顯降低(P<0.05)。與模型組相比,針刺組大鼠腦皮質組織中 Nrf2蛋白表達升高(P<0.05),激動劑組大鼠腦皮質組織中 Nrf2蛋白表達降低(P<0.05),激動劑陰性對照組大鼠無明顯變化(P>0.05)。與針刺組比較,針刺+激動劑組大鼠腦皮質組織中Nrf2蛋白表達降低(P<0.05)。與激動劑組比較,針刺+激動劑組大鼠腦皮質組織中 Nrf2蛋白表達升高(P<0.05)。詳見圖2、表5。
表4 各組大鼠腦皮質組織miR-128-3p、Nrf2 mRNA水平比較 (±s)
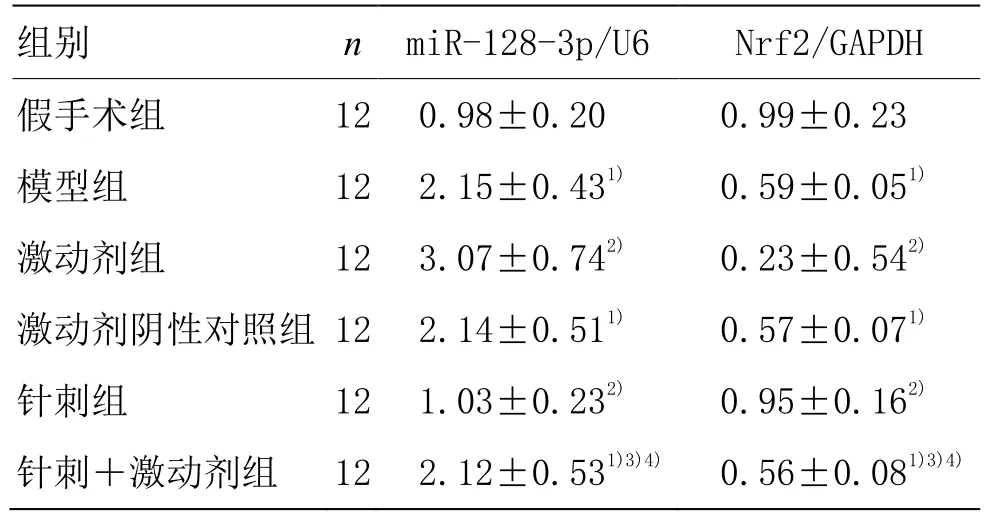
表4 各組大鼠腦皮質組織miR-128-3p、Nrf2 mRNA水平比較 (±s)
注:與假手術組比較 1)P<0.05;與模型組比較 2)P<0.05;與針刺組比較3)P<0.05;與激動劑組比較4)P<0.05
組別 n miR-128-3p/U6 Nrf2/GAPDH假手術組 12 0.98±0.20 0.99±0.23模型組 12 2.15±0.431) 0.59±0.051)激動劑組 12 3.07±0.742) 0.23±0.542)激動劑陰性對照組 12 2.14±0.511) 0.57±0.071)針刺組 12 1.03±0.232) 0.95±0.162)針刺+激動劑組 12 2.12±0.531)3)4) 0.56±0.081)3)4)
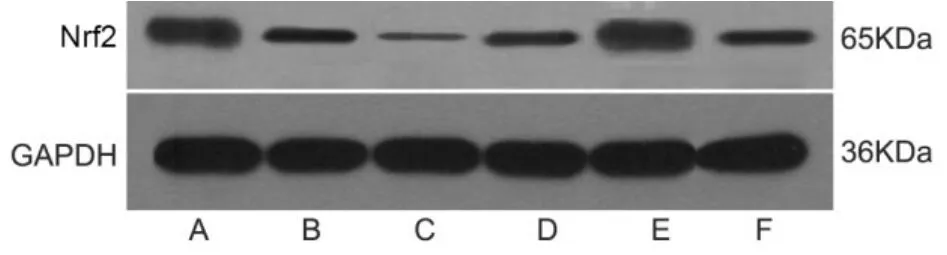
圖2 各組大鼠腦皮質組織中Nrf2蛋白表達
表5 各組大鼠腦皮質組織中Nrf2蛋白相對表達比較 (±s)
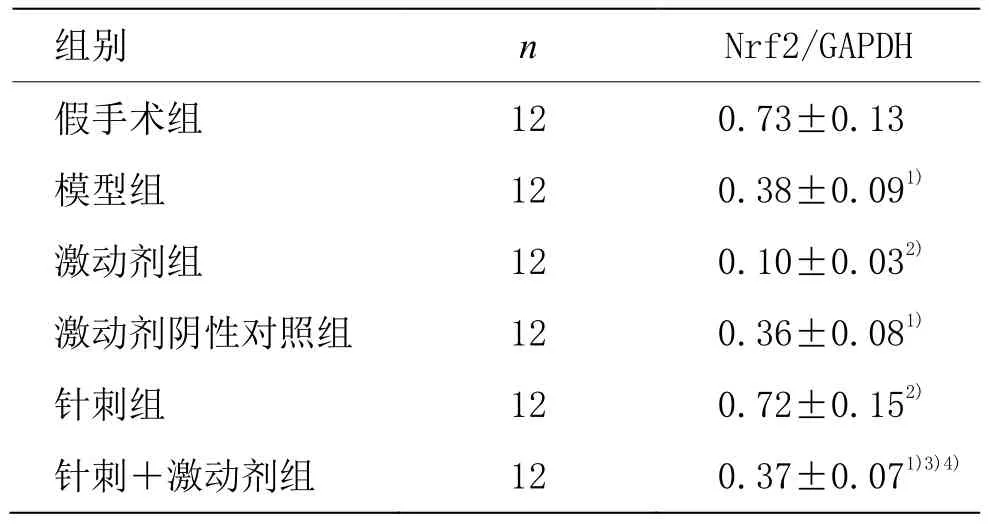
表5 各組大鼠腦皮質組織中Nrf2蛋白相對表達比較 (±s)
注:與假手術組比較 1)P<0.05;與模型組比較 2)P<0.05;與針刺組比較3)P<0.05;與激動劑組比較4)P<0.05
組別 n Nrf2/GAPDH假手術組 12 0.73±0.13模型組 12 0.38±0.091)激動劑組 12 0.10±0.032)激動劑陰性對照組 12 0.36±0.081)針刺組 12 0.72±0.152)針刺+激動劑組 12 0.37±0.071)3)4)
3 討論
近年隨著社會的發展,卒中發病率逐年升高,并趨于年輕化,然而患者治愈率低,且大多存在各種后遺癥,其中約 33.3%的患者會遺留永久殘疾,一直是臨床研究的熱點及難點[13-14]。研究發現,興奮性毒性、炎癥反應、氧化應激是缺血性卒中的主要病理過程,缺血缺氧及血液再灌注可激活神經膠質細胞,大量合成促炎因子白介素(interleukin,IL)-6、腫瘤壞死因子(tumor necrosis factor,TNF)-α釋放進入血液,引發機體炎癥反應,影響卒中發生發展[15-18]。另外,缺血再灌注可致血腦屏障受損,進一步導致星形膠質細胞標志蛋白S100β及神經組織中神經元特異性烯醇化酶(neuronspecific enolase,NSE)進入血液,因而血清S100β、NSE水平可作為反映腦損傷的敏感指標[19]。本研究以大腦中動脈線栓法建立腦缺血再灌注大鼠模型,結果顯示,模型組大鼠腦皮質神經元呈現細胞核收縮變小、細胞壞死等病理損傷,且神經功能缺損評分顯著高于假手術組,表明模型建立成功。本研究還發現,與假手術組比較,模型組大鼠血清中 S100β、NSE、IL-6及TNF-α水平明顯升高,提示模型組大鼠存在一定程度炎癥反應。
針刺是中醫常規治療方法,目前已成為臨床治療卒中的常用手段,針刺可降低急性缺血性卒中患者血清炎性因子水平,抑制其炎癥反應,改善卒中后上肢痙攣等臨床癥狀[20-21]。檢索文獻發現,陽陵泉穴、曲池穴被用于卒中治療較多,《針灸大成》:“陽陵泉穴主膝股內外廉不仁,偏風半身不遂。”《醫宗金鑒》:“曲池主治卒中,手攣急痛痹風。”現代醫學研究發現,針刺卒中患者陽陵泉穴可顯著降低執行控制網絡功能連接度,有利于患者腦功能及運動功能恢復[22]。針刺缺血再灌注大鼠曲池穴可抑制大腦皮質中神經細胞凋亡,改善神經功能評分[23]。因此,本研究對缺血性卒中大鼠雙側陽陵泉穴、曲池穴進行針灸,結果顯示,與模型組比較,針刺組大鼠腦皮質病理損傷減輕,神經功能缺損評分及血清中S100β、NSE、IL-6及TNF-α水平顯著降低,表明針刺可減輕缺血性卒中大鼠腦組織損傷,降低大鼠炎癥反應,恢復神經功能,然而其具體的分子機制不清楚。
miR-128-3p可參與調控機體炎癥、氧化應激等生理過程[24-27],風濕性關節炎患者血清 miR-128-3p及IL-6等炎癥因子水平顯著升高,下調miR-128表達可抑制T細胞釋放炎癥因子[6]。Shyamasundar S等[28]發現,miR-128過度表達可增強腎臟細胞促炎因子表達,促使腎組織炎癥進展。Nrf2介導抗氧化信號通路,上調其表達可抑制氧化應激損傷,促使成人神經干細胞成活及增殖,增強成人神經干細胞替代療法對卒中患者腦組織的保護作用[29-31]。Zhou F等[32]研究發現,五味子甲素可通過激活Nrf2通路降低IL-6、TNF-α等促炎因子表達,抑制氧化應激反應,從而保護缺血再灌注腦損傷。本研究發現,與模型組比較,針刺組大鼠腦皮質組織miR-128-3p水平降低,Nrf2 mRNA及蛋白水平升高,表明針刺可能通過下調 miR-128-3p表達,上調Nrf2表達,抑制炎癥發生,從而減輕缺血再灌注所致腦損傷。為進一步探討miR-128-3p在針刺治療卒中的作用,本研究采用激動劑過表達 miR-128-3p,結果發現,與針刺組比較,針刺+激動劑組大鼠腦皮質組織miR-128-3p水平升高,Nrf2 mRNA及蛋白水平降低,大鼠腦皮質病理損傷加重,神經功能缺損評分及血清中S100β、NSE、IL-6、TNF-α水平顯著增高,表明針刺對miR-128-3p表達的下調作用及對缺血再灌注大鼠腦損傷的保護作用可被miR-128-3p激動劑逆轉,進一步提示針刺可能通過下調 miR-128-3p表達改善缺血性卒中大鼠神經功能。
綜上所述,針刺可能通過下調 miR-128-3p表達,促進 Nrf2表達,抑制炎癥反應,從而減輕缺血性卒中大鼠腦損傷,改善其神經功能,為采用針刺療法改善缺血性卒中患者神經功能提供一定參考依據。但本文只對其進行了初步探討,關于針刺對Nrf2信號通路下游分子的調控作用及miR-128-3p是否可靶向調節Nrf2表達均未涉及,將在后續進行更深入研究,以進一步闡釋針刺治療卒中的具體機制。

