DEHP脅迫下蘿卜的亞顯微結構及應答轉錄組分析
冉詠蘭,闞建全
(西南大學 食品科學學院,重慶, 400715)
蘿卜(Raphanussati usL.)為十字花科蘿卜屬作物,是我國重要的大眾化蔬菜,其肉質根富含植物蛋白、維生素C、膳食纖維和多種微量元素,具有很高的食用和藥用價值。2017年我國蘿卜種植面積達130萬hm2,總產量達4501萬t[1]。地膜因其保溫保墑、抑制雜草等功能,在蘿卜種植中被廣泛使用,2015年我國地膜用量145.5萬t,覆蓋面積1831.8萬hm2[2],鄰苯二甲酸酯類化合物(phthalic acid easters,PAEs)作為增塑劑被添加到塑料中,由于在環境中具有性質穩定,半衰期長,生物蓄積毒性較強等特性[3],美國國家環保局已將鄰苯二甲酸二(2-乙基)己酯(diethylhexyl phthalate,DEHP)、鄰苯二甲酸二丁酯(di-n-butyl ortho-phthalate ,DBP)、鄰苯二甲酸丁基芐基酯(benzyl-n-butyl ortho-phthalate ,BBP)、鄰苯二甲酸二甲酯(dimethyl ortho-phthalate ,DMP) 、鄰苯二甲酸正二辛酯(di-n-octyl ortho-phthalate ,DnOP)、鄰苯二甲酸二乙酯(dicthyl ortho-phthalate ,DEP) 6種 PAEs 列為優先控制的有毒污染物[4-5]。DEHP作為一種常見的PAEs,在農業土壤中的濃度高于其他種類的 PAEs,有研究表明廣州、深圳蔬菜基地土壤中6種PAEs的總含量為3.00~45.67 mg/kg,其中DEHP含量為1.86~25.12 mg/kg[6];山東省青島市花生、棉花基地土壤DEHP含量最高達20.69 mg/kg[7];山東省萊州市農田土壤中6種PAEs的總含量為4.63~15.59 mg/kg,DEHP含量為12.46~35.77 mg/kg[8],顯著高于美國密西西比三角洲、丹麥和荷蘭等歐美國家和地區[9]。DEHP通過土壤進入農作物中,楊延杰等[10]研究發現,不同濃度的DEHP對蘿卜種子萌發和幼苗根系生長呈現低促進高抑制的機制。CHANG等[11]研究發現DEHP濃度的增加會影響蠶豆植物的DNA多態性,并對蠶豆苗造成可誘導急性氧化損傷并產生遺傳毒性作用。近年來,PAEs在土壤中的含量和成分[12-14]、在土壤-蔬菜中的遷移[15]、分配[16]、富集[17]、對蔬菜生長的影響[18-19]等方面研究較多,而對于植物對PAEs的耐逆相關功能基因組學研究較少,二代高通量測序方法-轉錄組測序(RNA sequencing,RNA-Seq)技術因其精準度高、成本低,成為探索植物體響應不同脅迫的基因網絡分析的理想工具[20],本研究利用RNA-Seq技術,對DEHP污染后的蘿卜塊根進行轉錄組測序,分析蘿卜塊根的差異表達基因和代謝通路,探究蘿卜響應DEHP脅迫的分子機制。
1 材料與方法
1.1 試驗材料
供試種子,青島蓉睦善良種有限公司“九斤王”;供試土壤,重慶市潼南區前進村綠色蔬菜基地。
1.2 試驗方法
1.2.1 盆栽試驗
分別稱取DEHP 50、150和250 mg,溶于丙酮(分析純),再加入5 kg原始土壤中拌勻,即制得3個污染濃度的土壤DEHP-l(10 mg/kg)、DEHP-m(30 mg/kg)和 DEHP-h(50 mg/kg),在陰涼通風處放置24 h,以去離子水調至最大田間持水量的70%,并將其置于溫室內平衡15 d,于2019年4月3日播種,2019年6月8日收獲,全生育期為69 d。
1.2.2 透射電鏡觀察
將蘿卜根部組織樣品切成0.1 mm3的小塊,快速放入質量分數4%的戊二醛中固定,抽真空使樣品下沉,4 ℃下固定24 h,利用0.1 mol/L磷酸緩沖液沖洗3次,用質量分數1%鋨酸固定4 h,經乙醇梯度脫水后用Epon812環氧樹脂包埋,超薄切片機切片,經醋酸雙氧鈾-梓檬酸鉛雙重染色后在透射電鏡下觀察、拍照。
1.2.3 RNA 的提取和Read文庫制備
采用Omega Plant RNA kit 試劑盒法提取蘿卜塊根中的RNA,將經不同DEHP濃度處理的蘿卜樣品的總 RNA送廣州基迪奧生物科技有限公司進行Illumina HiSeqTM測序工作。
1.2.4 測序數據處理
將原始下機數據過濾后獲得的reads比對到參考基因組上,利用Cufflinks組裝得到已知的轉錄本與新的轉錄本,并對得到的基因進行表達量分析與統計,分析差異表達基因(differentially expressed genes, DEGs)和功能富集途徑。
1.2.5 樣本間差異表達基因篩選
使用edgeR軟件對其進行DEGs分析,篩選出不同處理樣品之間的DEGs,并對其顯著性水平(P<0.05)進行分析,將未受污染的蘿卜作為對照組(CK),計算出不同濃度DEHP污染下的上調基因數(Log2ratio>2)和下調基因數(Log2ratio<2)。上調基因表明在DEHP脅迫下基因表達量大于對照組,或某些不表達的基因在DEHP脅迫下開始表達,說明這部分基因多與DEHP脅迫的耐性有關。下調基因表明在DEHP脅迫下基因表達量小于對照組,說明DEHP脅迫對植物的系統造成了傷害,使得活性下降,表達量降低,大多與生理功能相關。
1.2.6 基因本體(Gene Ontology,GO)功能注釋與分析
以P≤0.05 為閾值,將篩選到的DEGs利用GO seq軟件[21]進行GO富集分析,滿足此條件的GO term 為顯著富集的GO term,并以此來確定差異表達基因所行使的主要生物學功能。本試驗通過研究DEGs在 GO中的分布狀況,了解不同濃度DEHP污染處理下各蘿卜樣本在基因功能層面上的差異。
1.2.7 Pathway途徑分析
利用R語言軟件,篩選條件以Q值≤0.05 為閾值,滿足此條件為在DEGs中顯著富集的pathway,并在京都基因與基因組百科全書數據庫(Kyoto Encyclopedia of Genes and Genomes,KEGG)中進行注釋[22-23],通過KEGG 代謝途徑顯著性富集分析來確定DEGs參與的相關信號轉導和生化代謝途徑。
1.3 數據統計與分析
利用Excel 2013進行數據處理、統計分析和繪圖,利用 t-檢驗分析各污染濃度蘿卜的差異顯著性。
2 結果與分析
2.1 DEHP脅迫對蘿卜塊根超微結構的影響
細胞壁作為植物的特有結構,有維持細胞形狀、運輸物質和傳遞信息的作用,也是外界物質進入細胞內部的第一屏障[24],由圖1可知,對照組中的蘿卜細胞壁界限清晰,整齊平滑,厚薄均勻;在10 mg/kg DEHP處理下蘿卜細胞壁變厚;在30 mg/kg DEHP處理下蘿卜細胞壁繼續加厚,厚薄不均,并出現質壁分離的現象,細胞膜和細胞壁之間有深色顆粒沉淀物;在50 mg/kg DEHP處理下蘿卜細胞壁變形嚴重,有斷裂的現象,質壁分離現象加重,并在細胞膜和細胞壁之間有更多的深色顆粒沉積物。
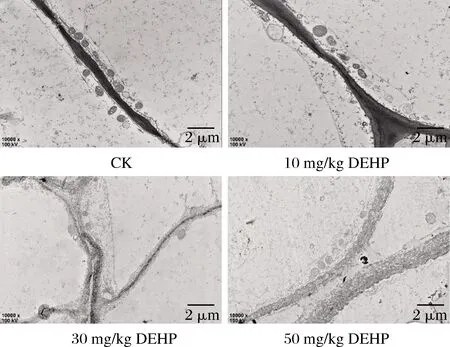
圖1 DEHP對蘿卜根部細胞壁超微結構的影響Fig.1 Effect of DEHP on cell wall ultrastructure of radish
由圖2可知,對照組中的蘿卜線粒體結構清晰,呈圓形或橢圓形,雙層被膜和內部嵴結構完整;在10 mg/kg DEHP處理下蘿卜線粒體數量減少,體膜結構變化不大;在30 mg/kg DEHP處理下蘿卜線粒體數量進一步減少,出現空泡化,內部嵴的數量變少,嵴突變得模糊;在50 mg/kg DEHP處理下蘿卜線粒體損傷更加嚴重,內部嵴斷裂,線粒體變模糊解體。線粒體結構的損傷將會影響植物體三羧酸循環,使細胞呼吸減弱,抑制信號傳遞,還會影響各種酶的活動。
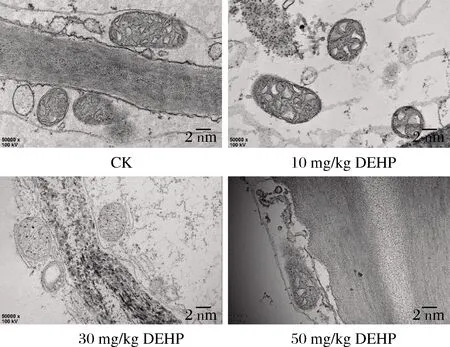
圖2 DEHP對蘿卜根部細胞線粒體超微結構的影響Fig.2 Effect of DEHP on mitochondria ultrastructure of radish
2.2 轉錄組測序結果統計與分析
2.2.1 轉錄組數據質量評估
信息分析前對下機數據進行質控與過濾,由表1可知,通過對樣品的轉錄組測序,分別獲得50 071 200、52 707 576、47 261 670和48 651 920條Clean Reads,經過整理和篩選分析,得到HQ Clean Reads,分別為49 143 966、51 612 986、46 319 318和47 567 124條,各樣本的HQ Clean Reads均有所下降,相對于Clean Reads,篩選后的HQ Clean Reads占98.15%、97.92%、98.01%和97.77%。4個樣品的Q20均大于98%,Q30均大于95%,測得序列的GC含量占47%以上,說明轉錄組測序質量較高,可以進行下一步的數據整理和分析。

表1 數據信息統計表Table 1 Statistics of RNA-Seq
2.2.2 差異表達基因分析
以P<0.05為篩選條件篩選差異表達基因后作火山圖,由圖3可知:紅色點代表上調基因,綠色點代表下調基因,黑點代表非差異基因。在10 mg/kg處理下,與CK相比,產生9 885個差異表達基因,其中上調差異表達基因5 993個,下調差異表達基因3 892個;在30 mg/kg處理下,相比CK產生9 385個差異表達基因,其中上調差異表達基因6 346個,下調表達基因3 039個,上調基因數量大于下調基因數量;在50 mg/kg處理下,相比CK產生11 880個顯著差異表達基因,其中上調差異表達基因7 336個,下調差異基因4 544個。3個濃度污染下的上調基因數量均大于下調基因數量。
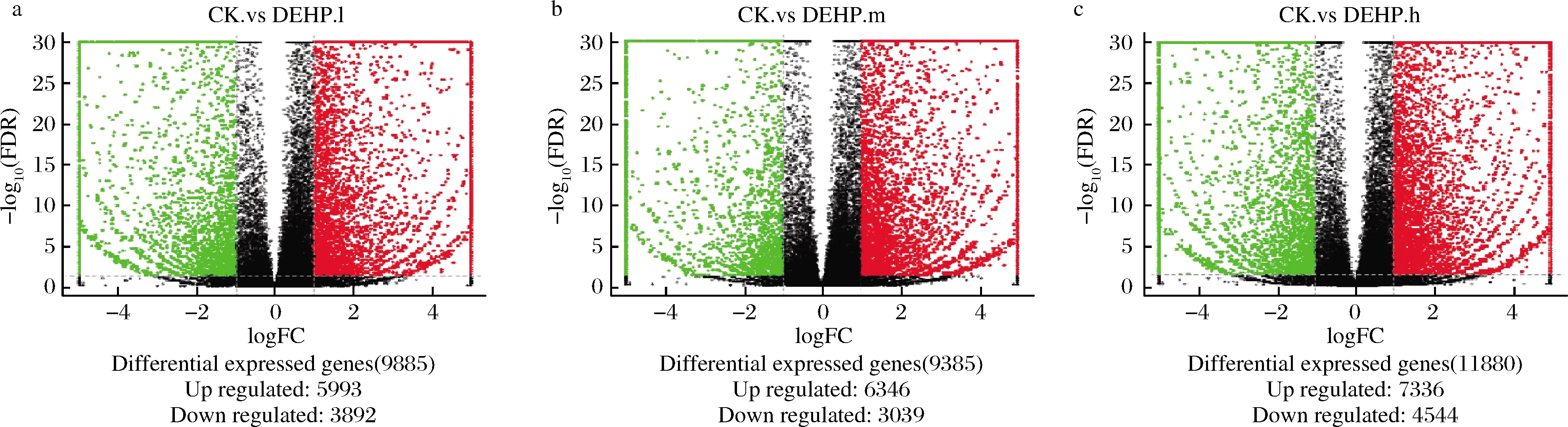
a-10 mg/kg處理;b-30 mg/kg處理;c-50 mg/kg處理圖3 差異表達基因火山圖Fig.3 Differential expressed gene olcano map
通過維恩圖(圖4)分析,在5 101個差異重疊基因中,有4 858個差異基因表達趨勢一致,243個差異基因表達趨勢不一致,不一致的基因中CK s DEHP-l上調基因86個, CK s DEHP-m上調基因129個, CK s DEHP-h上調基因153個。隨著污染濃度的加大,越來越多的下調基因變為上調,說明蘿卜為適應或抵抗DEHP脅迫,讓更多基因參與到應答反應中。CK s DEHP-l中上調的86個基因主要是與蛋白激酶、脫氫酶、調節蛋白、轉錄蛋白、結合蛋白、過氧化物酶、谷胱甘肽等相關的基因[25-29],這些基因的上調表達都與蘿卜塊根的抗性相關,說明其可以抵御一定的DEHP脅迫,但隨著污染濃度的增加,86個基因在CK s DEHP-m中有8個基因變為下調,在CK s DEHP-h有83個基因變為下調,說明隨著污染濃度的增加,DEHP脅迫會對蘿卜造成嚴重傷害,也說明了蘿卜對DEHP的抵御是有限度的。
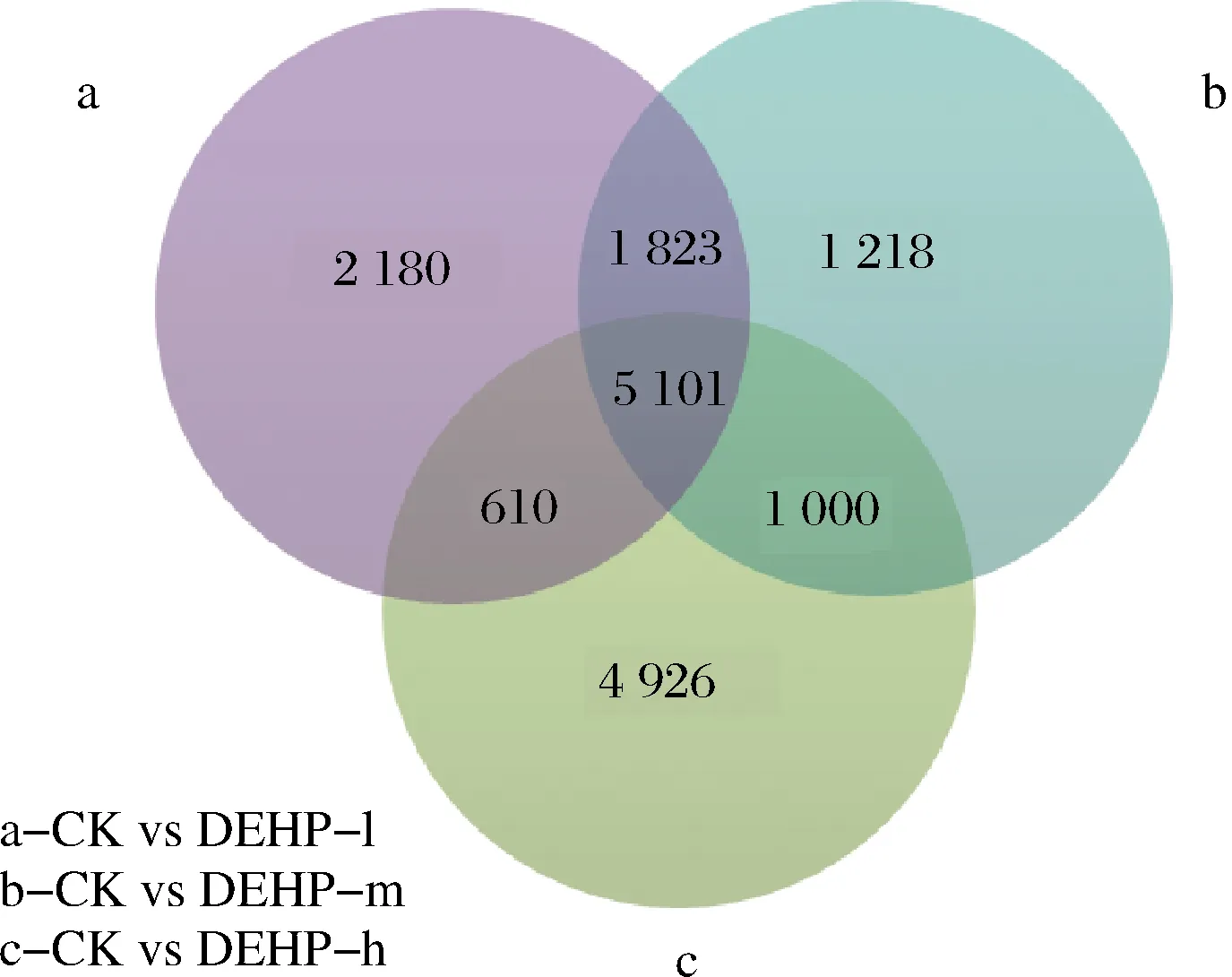
圖4 差異表達基因維恩圖Fig.4 Differential expressed gene enn diagram
2.2.3 差異表達基因的GO富集分析
研究發現,與空白組相比,3個DEHP污染濃度處理后分別有2 280、2 126和2 030個DEGs被GO注釋到生物過程(biological process,BP)、細胞組分(cellular component,CC)和分子功能(molecular function,MF)3個大類別,由圖5可知,在富集最顯著的前40個GO term中,集中在生物進程的GO term有17個,集中在細胞組分的GO term有12個,集中在分子功能的GO term有11個。其中細胞過程、代謝過程、單有機體過程和刺激響應是生物過程大類中最主要富集的通路,細胞成分、細胞區域和細胞器是細胞組分大類中最主要富集的通路,催化活性和結合是分子功能大類中最主要富集的通路。
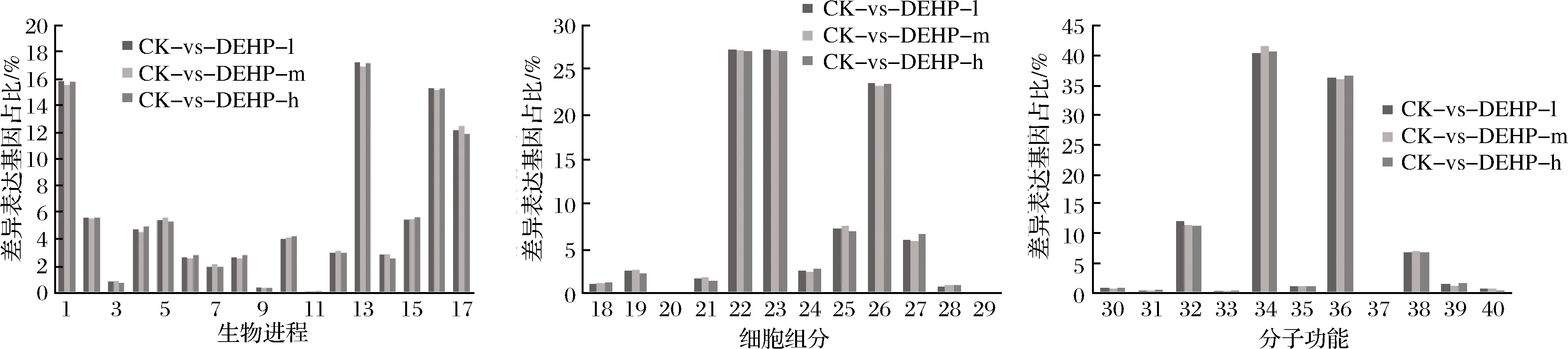
1-代謝過程;2-定位;3-生長;4-細胞成分組織或生物發生;5-生物調控;6-繁殖;7-免疫系統過程;8-生殖過程;9-節律過程;10-多細胞組織過程;11-生物粘附;12-多生物過程;13-細胞過程;14-信號系統15-發展過程;16-單有機體過程;17-刺激響應;18-膜封閉腔;19-細胞連接;20-細胞外基質;21-膜部件;22-細胞成分;23-細胞區域;24-高分子絡合物;25-膜;26-細胞器;27-細胞器部分;28-細胞外區;29-細胞外基質成分;30-信號傳感器活動;31-抗氧化活性;32-核酸結合轉錄因子活性;33-轉錄因子活性,蛋白質結合;34-催化活性;35-結構分子活性;36-結合;37-電子載流子活性;38-轉運活性;39-分子功能調節劑;40-分子換能器活性圖5 DEHP污染下蘿卜差異表達基因的GO功能分類Fig.5 Gene Ontology functional classification of differentially expressed genes after DEHP treatment
2.3 差異表達基因KEGG富集分析
由表2可知,將KEGG數據庫作為參考,與空白對照組相比,10 mg/kg污染濃度下有2 133個DEGs注釋到KEGG數據庫中的129個分類代謝途徑,顯著富集的有20個通路(P<0.05);30 mg/kg污染濃度下有1 991個DEGs注釋到KEGG 數據庫中的130個分類代謝途徑,顯著富集的有22個通路(P<0.05);50 mg/kg污染濃度下有2 641個DEGs注釋到 KEGG 數據庫中的130個分類代謝途徑,顯著富集的有20個通路(P<0.05)。
其中ko00270、ko00591、ko00592、ko00400、ko00260等通路包含的差異基因較多,這些通路主要涉及半胱氨酸與蛋氨酸代謝、亞油酸、α-亞麻酸代謝、苯丙氨酸、酪氨酸和色氨酸的生物合成和甘氨酸、絲氨酸和蘇氨酸代謝等過程。
2.4 蘿卜中半胱氨酸與蛋氨酸代謝的反應
通過KEGG注釋,分別有61、61、78條unigenes被注釋到代謝所在的半胱氨酸與蛋氨酸代謝的KEGG通路,其中支鏈氨基酸轉氨酶(2.6.1.42)、精胺合成酶(2.5.1.16)、1-氨基環丙烷-1-羧酸合成酶(4.4.1.14)和蛋氨酸γ裂解酶(4.4.1.11)在各污染處理組中均上調;丙氨酸-乙醛酸轉氨酶(2.6.1.44)在10和30 mg/kg處理下,表達基因有上調,在50 mg/kg處理下表達基因有上調/下調的趨勢;胞嘧啶-5-甲基轉移酶(2.1.1.37)和硫代硫酸鹽/3-巰基丙酮酸硫轉移酶(2.8.1.2)在各污染處理組中均下調。其中精胺合成酶(spermine synthase,SPMS)、丙氨酸乙醛酸轉氨酶與抵御外部環境脅迫相關[30-31],胞嘧啶-5-甲基轉移酶與植物生長發育相關[32]。
光呼吸是光合作用的補充反應,當受到外界脅迫時,植物會通過光呼吸消耗體內的乙醛酸,降低對細胞的傷害,提高植物抗病性和抗逆性[33-34]。光呼吸代謝時,轉氨酶作為氨基酸代謝中重要的催化劑促成乙醛酸的轉氨反應,有研究表明丙氨酸-乙醛酸轉氨酶(alanine-glyoxylate transaminase,GAT)定位于線粒體中,與乙醛酸代謝途徑相關并參與了光呼吸途徑,小麥在低溫、脫落酸、干旱和高鹽處理下GAT的表達量均隨脅迫的加大呈拋物線變化[35]。本試驗中隨著DEHP污染濃度的增加,蘿卜塊根上調GAT來加大光呼吸作用,抵御DEHP脅迫,但當濃度增加到50 mg/kg時,線粒體受到嚴重損傷甚至解體,導致GAT下降,影響蘿卜耐受性,這與透射電鏡中觀察到線粒體的變化一致。
多胺(polyamines,PAs)作為一種低分子量脂肪族的含氮堿廣泛存在于生物體中,有研究表明植物中的多胺作為可溶性物質、核苷酸和細胞膜的保護物質、活性氧清除劑等來參與細胞的抗逆過程,抵御外部環境脅迫[6,37]。SPMS在多胺合成后期將腐胺催化合成精胺,WI等[38]研究發現多胺含量的增加可以提高馬鈴薯耐非生物脅迫的能力,TANOU等[39]研究發現在鹽脅迫下柑桔通過上調PAs表達量改變其氧化狀態。本試驗中在DEHP脅迫下蘿卜中SPMS表達量增加,且中高濃度污染下參與基因多于低濃度污染,表明蘿卜可通過調節多胺含量提高逆境抗性。
DNA甲基化是生物基因組中普遍的共價修飾方式,參與了基因的表達調控、胚胎發育、細胞分化、基因組印跡、X染色體失活等,甲基化水平不足將會影響植物生長發育,胞嘧啶-5-甲基轉移酶(DNA (cytosine-5)-methyltransferase,5-MeC METI)可以識別特異DNA堿基序列并催化其進行甲基化修飾。大量研究表明,在溫度、化學試劑、金屬等脅迫下會引起植物DNA甲基化狀態和程度的變化[40-42],FINNEGAN等[43]在煙草中轉入甲基轉移酶反義基因MET1,發現其DNA甲基化水平下降,進而影響植株開花時間、生殖能力和花葉形態。本試驗中發現各污染組DEHP脅迫下5-MeC METI表達量均下調,使得DNA甲基化水平下降,同時METI表達量的下調會間接影響纖維素合成酶的表達進而導致纖維素合成下降[44],在透射電鏡觀察中,蘿卜塊根細胞壁隨污染濃度的增加而變形甚至斷裂,降低了細胞抵御外界脅迫的能力。
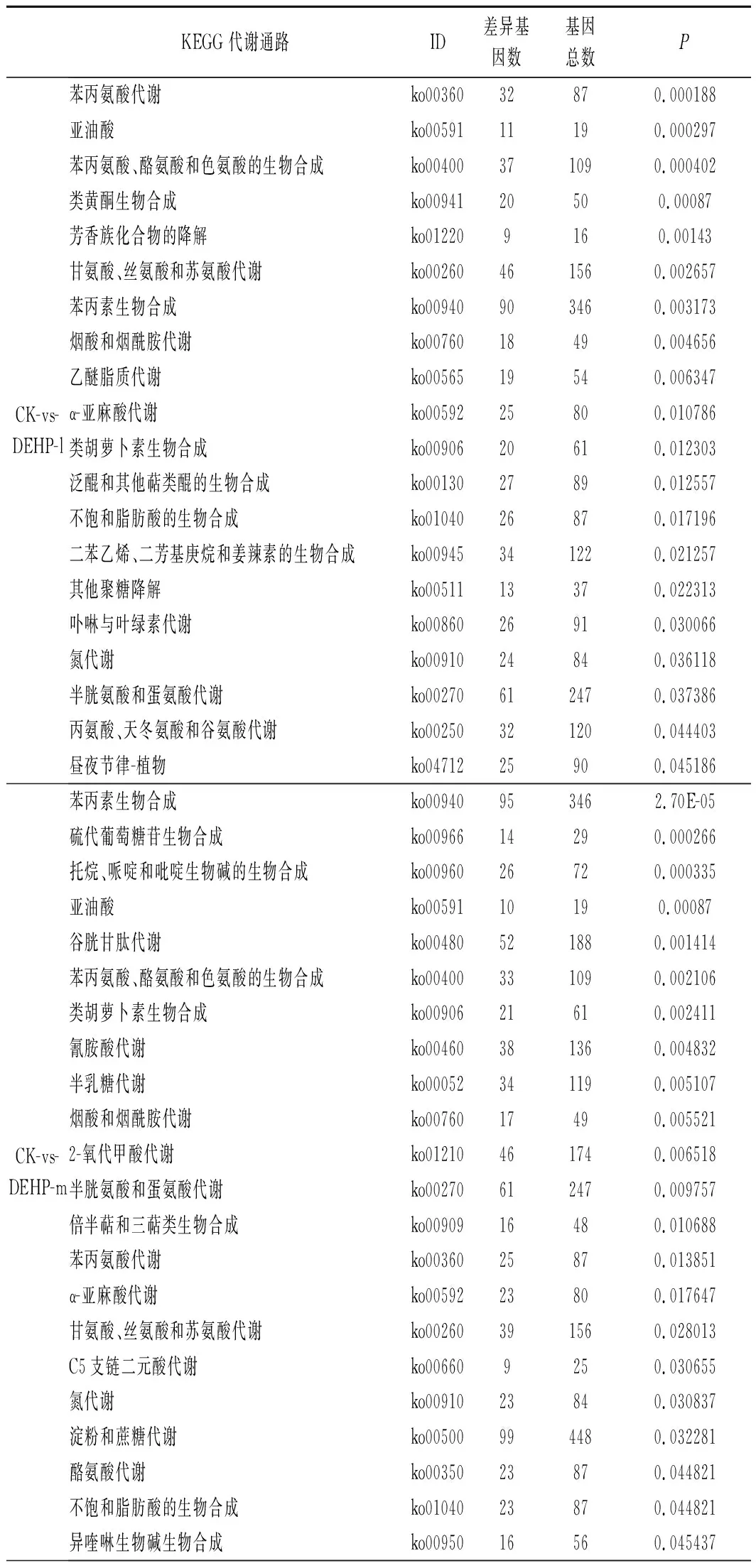
表2 DEHP差異表達基因的 KEGG 富集分析Table 2 KEGG enrichment analysis of differentially expressed genes under DEHP pollution
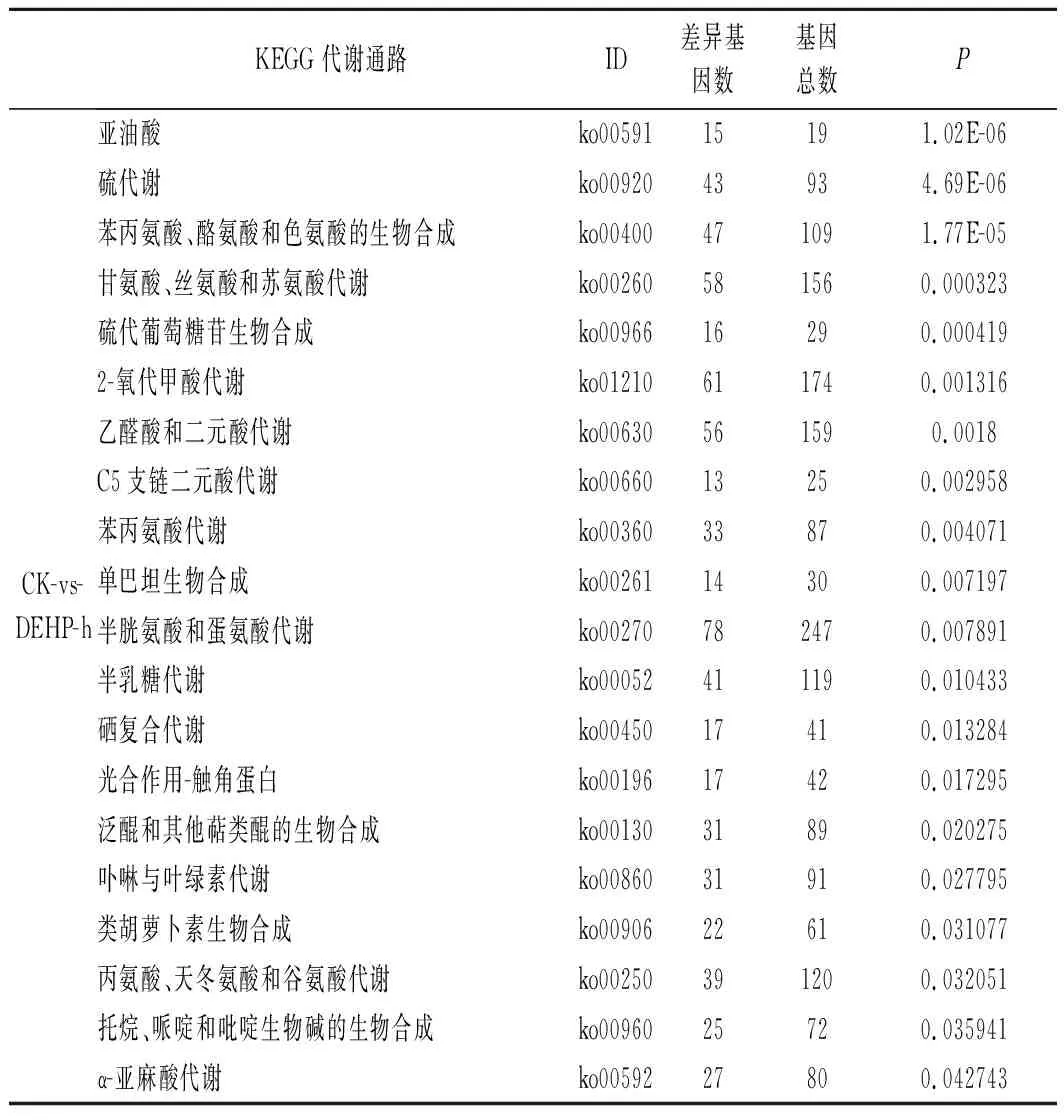
續表2
2.5 蘿卜中α-亞麻酸代謝的反應
通過KEGG注釋,各DEHP污染處理組分別有25、23、27條unigenes被注釋到代謝所在的α-亞麻酸代謝的KEGG通路,脂氫過氧化物裂解酶(HPL1)表達基因在各污染處理組中均下調;乙酰輔酶A酰基轉移酶(2.3.1.16)在10和30 mg/kg處理下,表達基因均有上調/下調的趨勢,在50 mg/kg處理下表達基因全部變為上調;12-氧-植物二烯酸還原酶(1.3.1.42)在10 mg/kg處理下表達基因上調,在30和50 mg/kg處理下,表達基因有上調/下調的趨勢。其中脂氫過氧化物裂解酶、乙酰輔酶A酰基轉移酶和12-氧-植物二烯酸還原酶均與蘿卜生長發育和品質有關。
植物在脂氧化過程中通過脂氫過氧化物裂解酶(hydroperoxide lyase,HPL)催化脂氧合酶(lipoxygenase,LOX)的反應產物脂氫過氧化物(HPOD或HPOT)裂解生成短鏈醛和含氧酸[45],HPL裂解產物不僅可以揮發出植物特殊的芬芳氣味,還參與植物抗病蟲、抗傷害和抗逆的防御響應。有研究表明HPL的催化反應與脂類代謝系統密切相關,其活性會被脂類物質的抗氧化劑所抑制,同時HPL活性基團中的Fe3+還能與脂氫過氧化物作用形成烷氧基和鐵羥絡合物,說明金屬螯合劑也能抑制其催化活性[46]。在DEHP的脅迫下,蘿卜中脂代謝活動加強,抑制了HPL活性,導致其基因表達下調,同時降低了特異氣味形成,影響蘿卜質量。
乙酰輔酶A酰基轉移酶(acetyl-CoA C-acetyltransferase,AACT)是甲羥戊酸(me alonate,M A)合成的重要酶類,通過催化蛋白質的酰基化和去酰基化來修飾植物蛋白質,調節蛋白質生物活性和基因表達,調控植物的生長發育及主要活性成分的合成[47]。本試驗中AACT表達量的變化說明DEHP脅迫誘發了蘿卜的防御反應,與低中濃度相比,高濃度處理后AACT表達量增加,加快了M A的合成,并通過M A來抵御DEHP脅迫。
茉莉酸類化合物是植物體內產生的天然植物激素,包括茉莉酸、茉莉酸甲酯及茉莉酸衍生物[48],在植物受到外界脅迫時作為信號分子調控下游相關基因的表達水平,宋云等[49]研究發現茉莉酸不僅可以調控植物生長發育,還在植物受到機械傷害、病蟲害等脅迫下作出防御響應。12-氧-植物二烯酸還原酶(12-oxophytodienoic acid reductase,OPR)是茉莉酸生物合成(十八烷碳烯酸代謝途徑)的正調控因子,有研究表明植物中的OPR在各種生物和非生物脅迫下具有特異性表達模式,小麥在受鹽脅迫時OPR1基因(TaOPR1)上調表達以響應各種刺激因子,而OPR2基因(TaOPR2)則因高鹽處理表達受到抑制[50]。香蕉中12-氧-植物二烯酸還原酶(MaOPR)在乙烯、枯萎病脅迫下表達上調以響應脅迫,特別在莖和果實中表達量較高[51]。本試驗中發現蘿卜的OPR在低濃度污染時表達基因上調,說明蘿卜通過激活茉莉酸信號抵御外來脅迫,但隨著污染濃度增加,OPR的部分表達基因變為下調,也說明蘿卜抵御脅迫的能力是有限度的。
2.6 蘿卜中亞油酸的反應
通過KEGG注釋,各DEHP污染處理組分別有11、10、15條unigenes被注釋到代謝所在的亞油酸的KEGG通路,各DEHP污染處理組中,LOX(1.13.11.12)在10 mg/kg處理下,表達基因下調,30和50 mg/kg處理下,表達基因有上調/下調的趨勢。在各處理組的分泌型磷脂酶A2(3.1.1.4)表達基因均上調,亞油酸9S脂氧合酶(1.13.11.58)表達基因均有上調/下調的趨勢。其中LOX、分泌型磷脂酶A2均與抵御外部環境脅迫相關。
LOX能催化植物體內酚基甘油酯產生脂肪酸衍生物,是植物脂肪酸氧化的一條重要途徑,一般在逆境條件下啟動,與植物種子的萌發與老化、生長發育進程、抗逆境脅迫和特有風味物質的產生密切相關[52]。植物發生超敏(hypersensiti e response,HR)反應時,細胞膜崩裂、電解質滲漏、細胞降解,細胞膜系統的破壞可能主要源于膜脂的過氧化反應,LOX是植物體內膜脂過氧化反應中的重要酶類,其在催化不飽和脂肪酸生成氫過氧化物脂肪酸的同時,產生大量的活性氧,后者參與細胞膜脂的過氧化,破壞細胞膜,導致細胞壞死。有研究表明,用放線菌酮抑制LOX的誘導后,也抑制了HR反應。同時,LOX還能催化植物防衛反應信號分子的合成,通過脂氧合酶途徑合成的茉莉酸甲酯、茉莉酸酮酸和7-異茉莉酸都可激活植物的防衛基因[53]。在DEHP的污染下,各處理組的LOX均有下調,表明蘿卜通過降低LOX來應對DEHP的脅迫,但中高污染濃度下LOX部分上調,產生活性氧,導致蘿卜防衛基因下調和細胞膜破損,所以隨著污染濃度增加,蘿卜塊根細胞壁開始變形甚至斷裂,并出現質壁分離。
磷脂酶A2(phospholipase A2,PLA2)作為一類能水解磷脂甘油C-2酯鍵生成游離脂肪酸以及溶血磷脂的酶類廣泛存在于植物組織中,在細胞磷脂消化、新陳代謝、信號轉導以及宿主防御等生理過程中起重要作用。有研究表明PLA2表達調節與傷害[54]和病原侵染[55]時的信號傳導有關; CHAPMAN[56]研究發現,植物PLA2會在受傷或逆境時被激活,且表達量顯著增加;YOUNG等[57]發現在水稻黃單胞菌脅迫下,體內磷脂代謝活動加強,PLA2活性的積累還可以迅速增加植物體內茉莉酸含量,對DEHP脅迫作出防御響應,但PLA2的活化也會導致質膜的破壞,這與透射電鏡觀測結果一致。
3 結論
本研究以蘿卜為研究對象,探究了不同濃度DEHP污染下蘿卜與空白組的亞顯微結構和轉錄組的差異。亞顯微結構研究表明,DEHP脅迫會破壞蘿卜塊根細胞的結構,導致細胞壁加厚變形、部分斷裂,線粒體嵴數減少,內部嵴斷裂變模糊甚至解體,且污染濃度越大,破壞越嚴重。應答轉錄組分析研究表明,通過過轉錄組測序,分別獲得9 885、9 385和11 880條顯著差異表達基因,且上調基因數量均大于下調基因數量。通過GO數據注釋發現,差異表達基因在GO中參與最多的生物過程是細胞過程、代謝過程、單有機體過程和刺激響應,參與最多的細胞組分是細胞成分、細胞區域和細胞器,參與最多的分子功能是催化活性和結合。KEGG富集分析得出,3組不同污染濃度下共同富集最多的主要通路是苯丙氨酸代謝、亞油酸、α-亞麻酸代謝、苯丙氨酸、酪氨酸和色氨酸的生物合成、甘氨酸、絲氨酸和蘇氨酸代謝、苯丙酸生物合成、類胡蘿卜素生物合成、半胱氨酸與蛋氨酸代謝。通過比較空白組和DEHP脅迫組的差異基因發現半胱氨酸與蛋氨酸代謝、亞油酸、α-亞麻酸代謝的差異基因富集比例較高,說明蘿卜在DEHP脅迫下通過這些通路來表達應激反應,值得進一步研究相關基因的應激機制。半胱氨酸與蛋氨酸代謝途徑中的GAT、PAs和5-MeC METI,油酸代謝途徑中的LOX和PLA2,α-亞麻酸代謝途徑中的HPL、AACT和OPR均對DEHP脅迫表現出抗性,說明顯著差異基因對蘿卜的非生物脅迫的響應具有重要意義。

