新型冠狀病毒肺炎重癥化的高危因素分析
徐靜,譚林,李莎莎,王春艷,高學武,王金玲,李風成,姜寧,紀冬*
1安徽省阜陽市第二人民醫院肝臟病科二病區,安徽阜陽 236000,2解放軍總醫院第五醫學中心肝硬化診療二中心,北京 100039
新型冠狀病毒肺炎(coronavirus disease-2019,COVID-19)的特點為傳播快、人群普遍易感,臨床主要表現為發熱、干咳和乏力,重癥患者多出現呼吸困難和(或)低氧血癥[1]。重癥患者的救治占用大量的醫療資源,花費高額的經濟費用,且往往治療效果不佳。Guan等[2]報道,進入ICU治療的COVID-19重癥患者,其28d病死率高達61.5%[2]。因此,避免輕癥向重癥發展對COVID-19患者的救治至關重要[3]。既往相關研究描述了COVID-19患者的流行病學特點、臨床表現和臨床結局,多是對未明確預后結果的患者進行的研究[4-6]。本研究探討了COVID-19患者病情重癥化的高危因素,以期指導臨床早期發現重癥病例、早期治療,為COVID-19的精準診療提供依據。
1 資料與方法
1.1 研究對象 回顧性分析安徽阜陽市第二人民醫院2020年1月20日-2月13日收治的COVID-19確診患者的臨床資料。納入標準:新型冠狀病毒核酸檢測兩次陽性;住院時間長于1周,且臨床資料完整。本研究獲阜陽市第二人民醫院倫理委員會批準(202000303006),因突發重大公共衛生事件豁免知情同意。
1.2 診斷標準 COVID-19確診標準為呼吸道標本實時熒光RT-PCR檢測新型冠狀病毒核酸陽性;患者病情嚴重程度分級標準參考國家衛生健康委員會發布的《新型冠狀病毒肺炎診療方案(試行第六版)》,分為輕型、普通型、重型和危重型[7]。所有患者按照病情進展與否分為穩定組和重癥化組;疾病進展定義為出現癥狀2周內從普通型進展至重型或重型進展至危重型。基礎疾病定義為至少有一種疾病(高血壓、糖尿病、心腦血管疾病、慢性呼吸系統疾病、慢性乙肝、貧血或腫瘤)且病程半年以上。出院標準為體溫恢復正常3 d以上、呼吸道癥狀明顯好轉、肺部影像學顯示急性滲出性病變明顯改善、連續兩次呼吸道病原核酸檢測陰性(采樣時間間隔至少1 d)。
1.3 數據來源 收集患者的臨床電子病歷、護理記錄、實驗室檢查和放射學檢查結果。收集患者年齡、性別、吸煙、飲酒、基礎疾病(高血壓、糖尿病、心腦血管疾病、慢性呼吸系統疾病、貧血或腫瘤)、流行病學史、入院時的生命體征(心率、呼吸頻率)、入院時的臨床分型(輕型、普通型、重型、危重型)、入院時的化驗值[淋巴細胞絕對值、乳酸脫氫酶(lactate dehydrogenase,LDH)、谷丙轉氨酶(alanine aminotransferase,ALT)、谷草轉氨酶(aspartate aminotransferase,AST)、總膽紅素(total bilirubin,TBIL)、堿性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰轉肽酶(γ-glutamyl transpeptidase,GGT)、肌酐(creatinine,Cr)、降鈣素原(procalcitonin,PCT)]。采用中國食品藥品監督管理局批準的實時RT-PCR方法,對呼吸道標本(包括鼻咽拭子或痰)進行新型冠狀病毒核酸、流感、副流感病毒檢測。所有患者均行胸部CT檢查。觀察期截至2020年3月4日。
1.4 統計學處理 采用GraphPad Prism 8.0軟件進行統計分析。符合正態分布的計量資料以表示,兩組間比較采用Studentt檢驗;不符合正態分布的計量資料以M(P25,P75)表示,兩組間比較采用Mann-Whitney檢驗;多組間比較采用方差分析,進一步兩兩比較采用Tukey's多重比較檢驗。計數資料采用χ2檢驗或Fisher精確概率法分析。均采用雙側檢驗。高危因素采用多因素COX比例風險回歸模型進行分析。P<0.05為差異有統計學意義。
2 結 果
2.1 基線特征及單因素分析 共納入148例患者,入院時9例(6.1%)為重型,139例(93.9%)為普通型,其中5例臨床資料缺失,予以排除。最終納入143例患者,年齡43.5(32.7,52.4)歲,81例(56.6%)為男性,28例(19.6%)存在基礎疾病,入院時最常見的癥狀為發熱[119(83.2%)],其次為干咳[(77(53.8%)]。按出現癥狀2周內是否從普通型進展至重型或重型進展至危重型分為穩定組(n=122)和重癥化組(n=21),比較兩組患者各項臨床指標的差異,結果顯示,重癥化組患者年齡更高(55.1歲),合并基礎疾病的比例更高(57.1%),淋巴細胞絕對值更低(0.7×109/L),AST更高[29.0 U/L, 但處于正常范圍(15.0~40.0 U/L)],LDH值更高(322.0 U/L),差異均有統計學意義(P<0.05)。進一步將上述有差異的定量指標進行分層發現,重癥化組年齡>60歲(占46.6%)、淋巴細胞絕對值<1.0×109/L (占81.0%)、LDH>250.0 U/L(占81.0%)的患者所占比例更高(P≤0.001);兩組患者的AST均在正常范圍,取總體患者的中位數26.0 U/L作為分層依據,兩組AST>26.0 U/L的患者占比差異無統計學意義(P=0.285)。兩組性別比例及ALT、ALP、GGT、Cr水平差異均無統計學意義(P>0.05,表1)。
2.2 兩組患者淋巴細胞絕對值和LDH的動態變化分析 進一步分析穩定組患者入院時、入院4~6 d復查時(因重癥化組患者病情進展的時間中位數為3.95 d,故對應的穩定組患者選取入院4~6 d的指標作為復查對照組)、出院時,以及重癥化組入院時、病情進展時、出院時淋巴細胞絕對值和LDH的動態變化,結果顯示,穩定組患者入院、復查及出院時淋巴細胞絕對值均>1.0×109/L,但在住院期間持續上升(組間比較P<0.001);重癥化組患者入院時淋巴細胞絕對值<1.0×109/L,病情進展時較入院時明顯降低(P=0.035),出院時恢復至1.0×109/L以上(P<0.001)。穩定組患者入院時LDH為233.5 U/L,未超過正常上限250.0 U/L,經治療后持續下降(P<0.001);重癥化組患者入院時LDH為322.0 U/L,病情進展時(355.0 U/L)較入院時未下降,甚至有所上升(P=0.114),經治療至出院時明顯下降(P<0.001,圖1)。
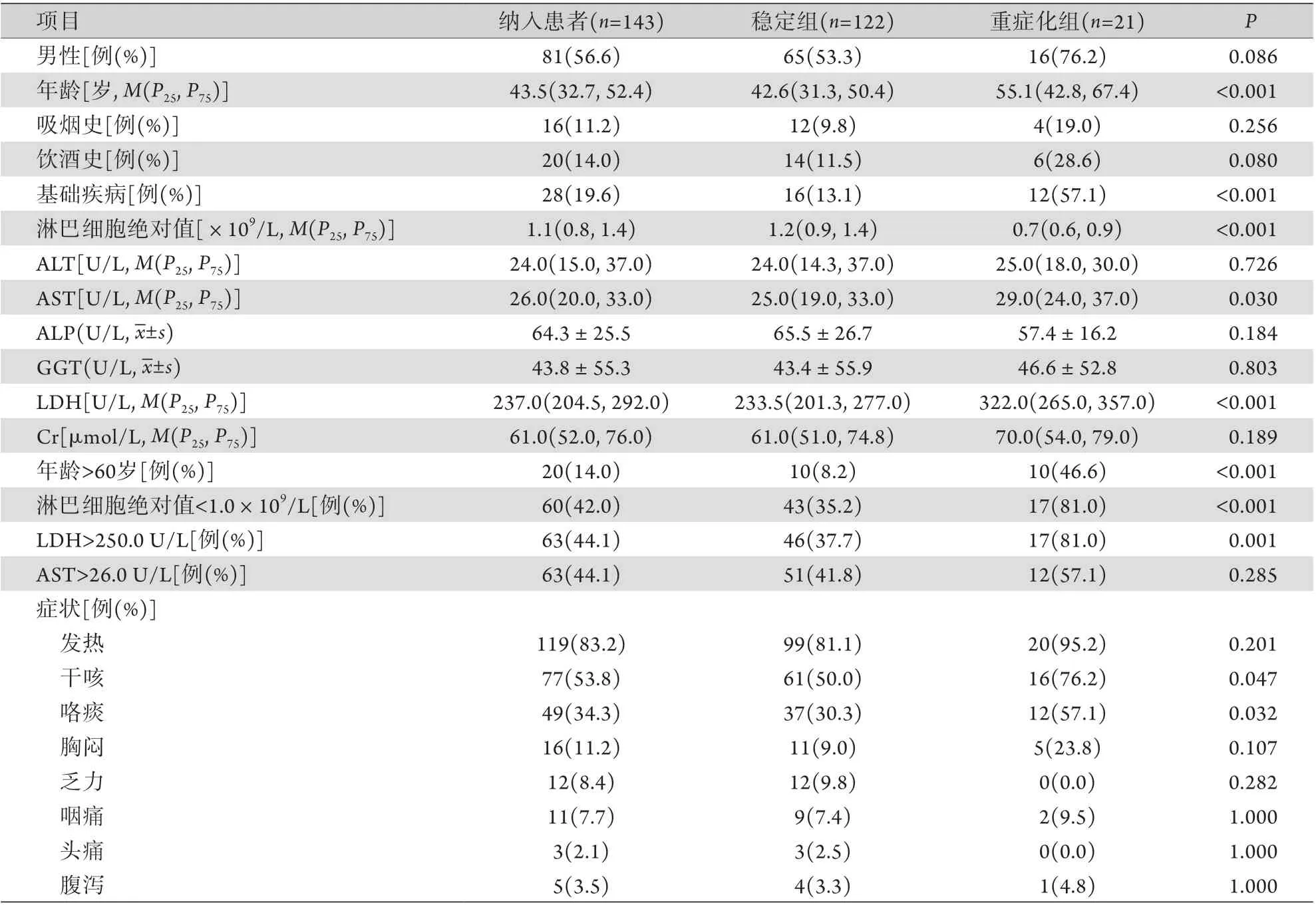
表1 兩組COVID-19患者入院時各項臨床指標比較Tab.1 Comparison of clinical indexes of COVID-19 patients on admission
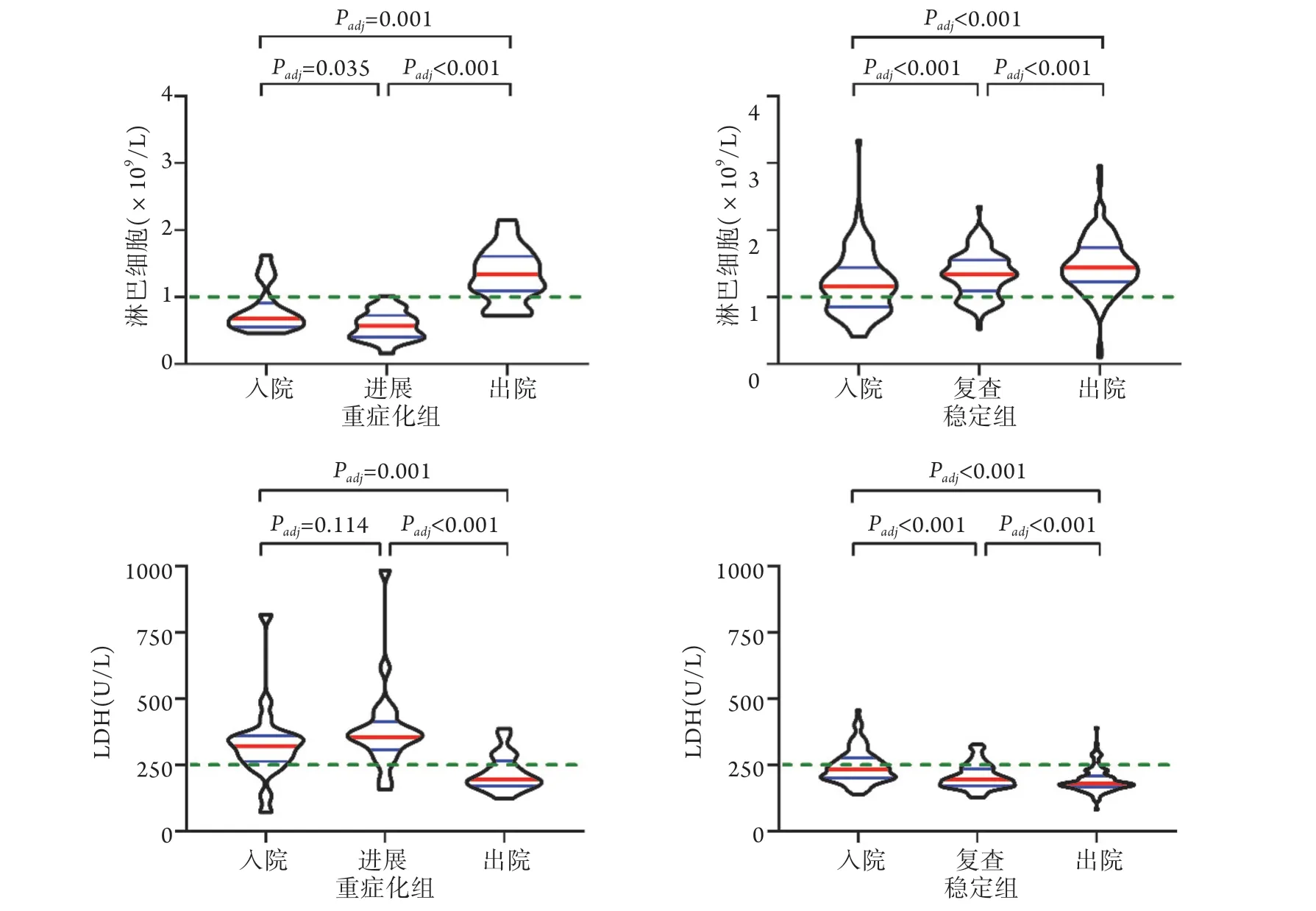
圖1 兩組COVID-19患者淋巴細胞絕對值及LDH的動態變化Fig.1 Dynamic changes of lymphocyte absolute value and LDH in patients in stable group and severe group
2.3 COVID-19患者病情重癥化高危因素的多因素分析 將上述有差異的因素(干咳、咯痰、年齡、基礎疾病、AST、LDH、淋巴細胞絕對值)納入多因素COX比例風險回歸模型,結果顯示,在治療基線時年齡60>歲(HR=3.5,95% CI 1.4~9.0)、合并基礎疾病(HR=3.9,95% CI 1.5~10.4)、LDH>250.0 U/L (HR=4.1,95% CI 1.4~12.6)、淋巴細胞絕對值<1.0×109/L(HR=6.8,95% CI 2.3~20.7)為COVID-19患者重癥化的高危因素(圖2)。
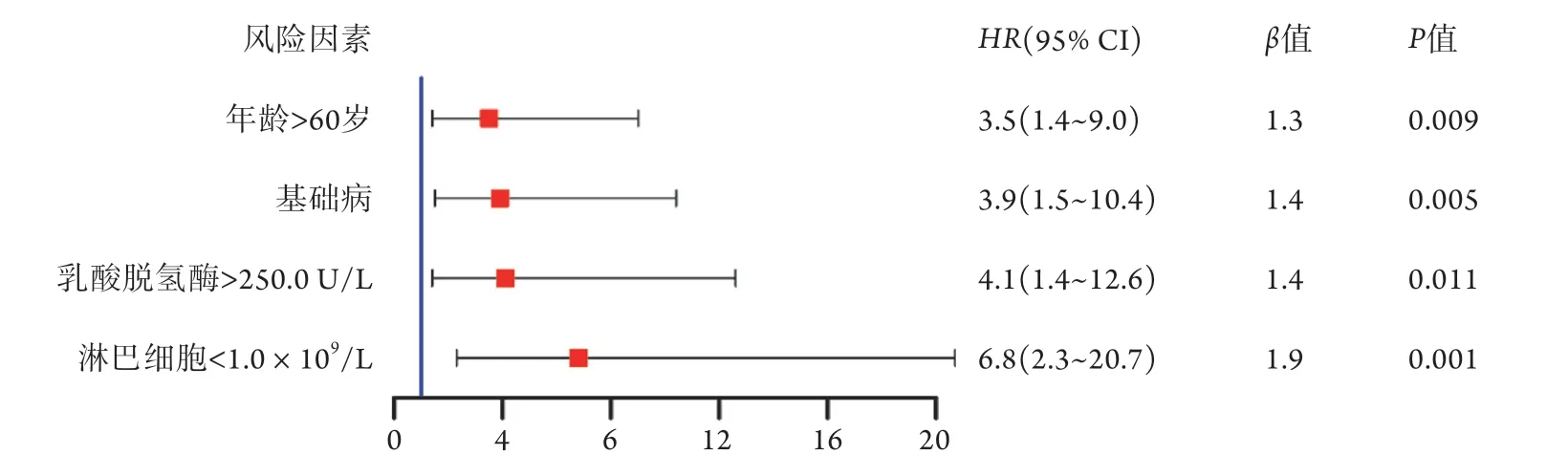
圖2 143例COVID-19患者病情重癥化高危因素的多因素分析Fig.2 Multivariate analysis of high risk factors associated with severity of COVID-19 patients
3 討 論
新型冠狀病毒(SARS-CoV-2)感染后的臨床表現與非典冠狀病毒(SARS-CoV)感染極為相似,疾病進展快,容易重癥化,重癥化患者易出現急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)。Huang等[4]的研究顯示,41例COVID-19患者中,13例(31.7%)進展至重癥且入住ICU治療,6例(14.6%)死亡。Guan等[2]的研究納入了1099例COVID-19患者,其中重癥患者173例(15.7%)。Yang等[8]調查了201例COVID-19患者,其中重癥患者55例(27.4%)。Zhou等[9]的研究顯示,COVID-19重癥患者的病死率為28.3%。由此可見,COVID-19患者重癥化比例及病死率均較高。早期發現COVID-19重癥化的高危因素并重點監測,有利于更早發現易于進展至重癥的輕型患者,可對其實施精準治療,從而降低病死率。本研究結果顯示,年齡>60歲、合并基礎疾病、淋巴細胞絕對值<1.0×109/L及LDH>250.0 U/L為COVID-19重癥化的高危因素。
已有研究發現,高齡是SARS-CoV和中東呼吸綜合征病毒(MERS-CoV)感染患者死亡的重要的獨立預測因素[10-12],且高齡與COVID-19患者死亡有關[9]。 本研究發現,重癥化組患者年齡更大,合并基礎疾病者更多。Guan等[2]發現,COVID-19重癥患者年齡大于非重癥患者,且基礎疾病在重癥患者中更為常見(38.2%vs.22.5%,P<0.001)。Yang等[8]發現,與COVID-19幸存者相比,死亡患者年齡更大(64.6歲vs.51.9歲),合并慢性疾病者更多(53%vs.20%)。de Wit等[13]發現,老年人(>65歲)感染冠狀病毒后更易患ARDS,且病情更重。對接種SARS-CoV的獼猴進行研究發現,老年獼猴對病毒感染的宿主固有反應比年輕獼猴更強,與炎癥相關的基因差異表達增加,而Ⅰ型干擾素-β的表達減少[14];T細胞和B細胞功能的年齡依賴性缺陷以及2型細胞因子的過量產生可能引起病毒復制失控和更持久的促炎反應,從而導致不良結局[15],這可能是高齡患者更易進展至重癥的原因。此外,宿主的免疫狀態也是影響病情輕重的重要因素之一。老年人及合并基礎疾病者的免疫功能低下,容易合并各種感染,病情更易進展至重癥[5]。
本研究中80%以上的重癥化患者出現淋巴細胞絕對值降低,且淋巴細胞絕對值隨著疾病恢復而回升。淋巴細胞計數減少是SARS-CoV感染的危重患者的一個顯著特征,因為SARS-CoV病毒顆粒的靶向侵襲破壞了淋巴細胞的細胞質成分并導致其破壞[16]。此外,淋巴細胞計數減少在MERS-CoV感染的危重患者中較常見,與淋巴細胞凋亡有關[17-18]。Zhou等[9]發現,76%的COVID-19死亡患者出現淋巴細胞明顯下降,且此比例明顯高于幸存者(26%)。與本研究結果一致。以往多個報道均指出與非重癥患者相比,重癥COVID-19患者有更顯著的淋巴細胞計數減少[2,4-5]。Chan等[19]指出淋巴細胞減少是COVID-19患者的一個共同特征,且可能是與病情嚴重程度和病死率相關的一個關鍵因素。由此推測,SRAS-CoV-2感染的重癥化患者淋巴細胞減少亦可能是淋巴細胞壞死或凋亡所致,淋巴細胞計數減少的嚴重程度反映了SRAS-CoV-2感染的嚴重程度。
LDH是一種糖酵解酶,廣泛存在于機體的各種組織中,以心肌最為豐富,其次為肝臟、肺臟等。已有研究表明血清LDH水平升高與病毒性肺炎有密切關系[20-21]。本研究結果顯示,重癥化組患者LDH水平明顯升高,在病情進展時較入院時升高,出院時下降,呈現動態變化。Zhou等[9]發現,在整個臨床過程中,與存活者相比,死亡患者的LDH水平明顯升高,并且隨著病情加重而升高,隨著病情好轉而逐漸降低,與本研究結果一致。Guan等[2]的研究得出了相同的結論。目前有限的COVID-19患者尸檢病理組織學檢查顯示,心臟組織有少量間質單核細胞炎性浸潤[22]。此外,SRAS-CoV-2的受體血管緊張素轉換酶2 (ACE2)在心肌細胞和血管內皮細胞上呈高表達,因此理論上存在病毒直接累及心臟的可能性[23],這也可能是LDH升高的主要原因,且病毒對肺組織的破壞亦有導致LDH升高的可能,而隨著病情好轉,病毒對各組織的破壞力下降,LDH逐漸下降。
既往多數研究為單因素研究,本研究采用考慮時間因素的多因素COX回歸分析,可動態反映各指標的變化,結果更為可靠。本研究也存在一定的局限性。首先,樣本量較小,有必要納入其他中心及更多患者驗證上述結果。其次,本研究為回顧性研究,需要前瞻性研究進一步證實上述結果的可靠性。
綜上所述,本研究結果表明,年齡>60歲、合并基礎疾病、淋巴細胞絕對值<1.0×109/L及LDH >250.0 U/L為COVID-19病情進展的高危因素。在目前全球冠狀病毒疫情大流行的形勢下,對上述高危因素進行密切監測,早期發現有重癥化趨勢的病例,早期采取措施遏制病情進展,可以有針對性地制定個體化治療方案,緩解醫療資源緊缺的壓力,降低病死率。

