2株毛竹枯梢病拮抗細菌篩選及其促生功能
楊 豆,王清海,萬松澤,李 麗,張 揚*
(1. 江西農業大學國家林業和草原局鄱陽湖流域森林生態系統保護與修復重點實驗室,江西 南昌 330045;2. 山東省林業科學研究院,山東 濟南 250014)
毛竹(Phyllostachys edulis(Carrière) J. Houz.)隸屬禾本科剛竹屬單軸散生竹,在竹類植物中具有用途最廣泛、經營周期較短且經濟效益較高的特點,已成為我國南方農林產業結構調整、林業增效、林農增收的主要經濟林種[1]。我國現有毛竹林面積380多萬公頃,占全國竹林面積的70%,占全世界毛竹面積的80%[1-2]。自毛竹枯梢病在浙江黃巖首次發現后,相繼在南方各省份爆發成災,造成嚴重經濟損失,極大程度地制約了我國毛竹資源培育和竹產業的發展。該病害病原菌為竹喙球菌(Ceratosphaeria phyllostachydis),主要危害當年生新竹,造成枯株狀態,已被列為國家森林植物檢疫對象[3-5]。磷是植物生長過程中僅次于氮的第二大限制營養元素,約占植物干質量的0.2%[6],在生態系統能量代謝、核酸和蛋白質合成以及激酶調控等方面發揮著不可替代的作用[7]。由于土壤中僅有約0.1%的磷能直接被植物吸收利用,其余主要以難溶性磷酸鹽存在[8]。因此,人們通過施用大量磷肥來滿足植物對于磷素的需求,然而磷肥中的磷酸根離子極易與土壤中游離的Ca2+、Fe3+和Al3+等離子發生鰲合作用形成難溶性磷酸鹽,導致施用磷肥中僅有5%~25%可被植物吸收利用,大量殘余部分造成土壤磷素富集和土壤肥力喪失[9],引發了一系列的環境問題。這些亟待解決的問題使得提高毛竹抗病能力和竹林土壤磷素有效性成為一種迫切需要。
植物體內分布著豐富的有益內生細菌,它們不但可以通過分泌IAA、利用解磷和固氮等功能直接促進植物生長,還可通過分泌抗生素、水解酶等物質來幫助寄主植物提高抗病性,改善植物健康[10]。研究表明,多數內生細菌不僅存在于植物體內,也常存活于植物根際土壤環境中[11-12]。由于從土壤中篩選出的促生細菌在應用中發現,其在定殖過程中易受土著微生物的干擾導致定殖成功率不高、應用效果較實驗結果欠佳[13]。因此,利用內生細菌進行植物病害防治和促生方面的應用已成為近年來的研究熱點。然而目前關于毛竹內生細菌的相關研究仍較少,且對毛竹內生細菌抗病促生方面的研究也尚未見報道。故本試驗對毛竹根系內生細菌進行分離,以竹喙球菌(C. phyllostachydis)作為指示菌進行拮抗菌株篩選,測定優良內生拮抗細菌的解磷能力和IAA等指標并進行種類鑒定。通過溫室盆栽接種試驗檢驗其對毛竹實生苗的促生長作用,以期為增強毛竹抗枯梢病能力,改善毛竹林地土壤養分情況,提高竹林生產力提供一條有效的生物途徑,也為制備保護竹林健康及提高竹林生產力相關微生物菌劑提供優良的菌株資源。
1 材料與方法
1.1 試驗材料
1.1.1 試驗菌株 毛竹枯稍病病原菌竹喙球菌(C.phyllostachydis)由中國林業微生物菌種保藏中心贈送,現保存于江西農業大學國家林業和草原局鄱陽湖流域森林生態系統保護與修復重點實驗室。
1.1.2 培養基種類 牛肉膏蛋白胨固體培養基(NA):蛋白胨10 g,牛肉膏3 g,瓊脂16 g,NaCl 5 g,水1 000 mL,pH 7.2。
牛肉膏蛋白胨液體培養基(NB):NA培養基不加瓊脂。
馬鈴薯葡萄糖瓊脂培養基(PDA):葡萄糖20 g,馬鈴薯200 g,瓊脂18 g,水1 000 mL。
磷酸鹽生長培養基(NBRIP):葡萄糖10 g,(NH4)2SO40.1 g,KCl 0.2 g,MgCl25 g,MgSO4·7H2O 0.25 g,Ca3(PO4)25 g,瓊脂18 g,水1 000 mL,pH 7.0~7.2。
含溴酚藍的磷酸鹽生長培養基(NBRI-BPB):在NBRIP培養基中加溴酚藍(0.025 g·L-1)。
1.1.3 樣品采集 樣品分別采集于江西省官山林場、大井林場和大港林場毛竹林地,選取4~5年生毛竹,挖出根系,取部分細根裝入無菌自封袋中,標明采樣點、時間、編號等,置于4℃冰箱冷藏室備用。
1.2 方法
1.2.1 毛竹根系內生細菌的分離 毛竹根系用蒸餾水沖洗3遍,按下述步驟進行表面消毒:75% 酒精浸泡1 min,3.25%次氯酸鈉浸泡3 min,75%酒精浸泡30 s,后用無菌水沖洗3遍,無菌濾紙吸干表面水分,進行研磨,收集研磨液[14]。用最后一次沖洗后的無菌水涂布NA平板,檢驗是否表面滅菌徹底。采用稀釋平板法[15],將純化的單菌落于NA斜面培養、儲存、備用。
1.2.2 內生拮抗細菌的篩選 將培養5 d后的竹喙球菌菌餅放置在PDA平板中央,將分離所得的細菌采用劃線法接種于PDA平板兩側,設置僅接病原菌的PDA平板為對照,各處理3個重復。置28℃恒溫箱內培養4 d后測量抑菌帶寬度并做標記。將抑菌效果較好的菌株PN1和PN6接種于NB培養基中。用150 mL搖瓶進行發酵液培養,每瓶裝液量50 mL,于30℃(200 r·min-1)培養2 d。將培養后的發酵液離心取上清液經0.22 μm微孔濾膜過濾。混合5 mL無菌濾液與20 mL PDA培養基后倒平板;以等量無菌水代替無菌濾液為對照,接竹喙球菌菌塊于平板中央培養4 d(28℃),各處理3個重復。測量并計算各處理生長抑菌率。計算公式如下:

1.2.3 內生拮抗細菌PN1和PN6生長曲線的測定 采用比濁法測定菌株PN1和PN6的生長曲線,將菌株PN1和PN6在NB培養基中震蕩培養,每隔6個小時取樣,測定培養液的OD600值,并繪制生長曲線。
1.2.4 內生拮抗細菌PN1和PN6解磷能力的測定 采用Pikovskaya等人的方法對菌株PN1和PN6進行解磷能力的定量測定。將菌株PN1和PN6在NB培養基震蕩培養24 h,配制菌液濃度為1×108cfu·mL-1后,將菌液按1%的接種量至50 mL NBRIP培養液中,以等體積未接菌NBRIP培養液為對照,置于30℃、180 r·min-1環境下搖培5 d,各處理5個重復。將發酵液于4℃、10 000 r·min-1條件下離心10 min,取各處理上清液采用鉬銻抗比色法測其可溶性磷含量[16]。
1.2.5 內生拮抗細菌PN1和PN6分泌IAA能力測定 菌株產IAA量采用Salkowski比色法測定。將IAA標樣稀釋至0,0.5,2.5,5.0,7.5,10,12.5,15,17.5,25,50 mg·L-1,將各濃度梯度的IAA與FeCl3比色液等比例混合(2 mL)在30℃下暗儲藏30 min后,測其在波長530 nm條件下的吸光度,并繪制標準曲線。培養PN1和PN6菌液15 d,以未接菌的NB液體培養基為對照。菌懸浮液與對照離心10 min(10 000 r·min-1)后取上清液進行IAA含量的測定,IAA含量測定采用標準曲線制作方法[17]。
1.2.6 內生拮抗細菌PN1和PN6鑒定 菌株PN1和PN6形態與生理生化分析參考《常見細菌系統鑒定手冊》[18]和利用Biolog鑒定,Biolog系統鑒定方法具體步驟參照該系統的鑒定說明書。DNA提取采用CTAB法[19],采用1 495 r和27 f引物,PCR產物送金斯瑞生物科技公司測序,測序得到的序列提交至NCBI數據中并進行BLAST比對分析,在NCBI數據庫中下載相關基因序列,利用軟件MEGA 5.0構建系統進化樹[20]。
1.2.7 內生細菌PN1和PN6對毛竹促生作用 將菌株PN1和PN6活化后,用接種環挑取少量菌體接種于NB培養基中28℃,180 r·min-1振蕩培養48 h。發酵液(4℃,5 000 ×g)離心5 min,無菌生理鹽水潤洗菌體3次并調節菌懸液(108cfu·mL-1)制成液體菌劑。采用完全隨機設計試驗,培養基質按照土壤∶砂子∶蛭石=2∶1∶1的配比混合,設置對照(等量無菌生理鹽水)、單獨施用解磷菌PN1和PN6 3個處理。于當年4月份采用灌根的方式分別施用于毛竹根際土壤里,菌劑施用量為10 mL·株-1,各處理20 株。在栽培180 d 時測定毛竹苗高、地徑。
1.3 數據處理
利用Microsoft Excel 2013進行數據整理,采用SPSS和Origin分析軟件做統計和制圖,運用單因素方差分析抑菌活性、解磷量和分泌IAA量和促生試驗數據(P<0.05)。圖表中數據為平均值±標準誤。
2 結果與分析
2.1 毛竹根系內生細菌的分離及純化
細菌分離數量結果顯示,毛竹根系存在豐富的細菌資源,3個采樣點共分離純化得到118株細菌,各采樣點均分離到約40株內生細菌(表1)。
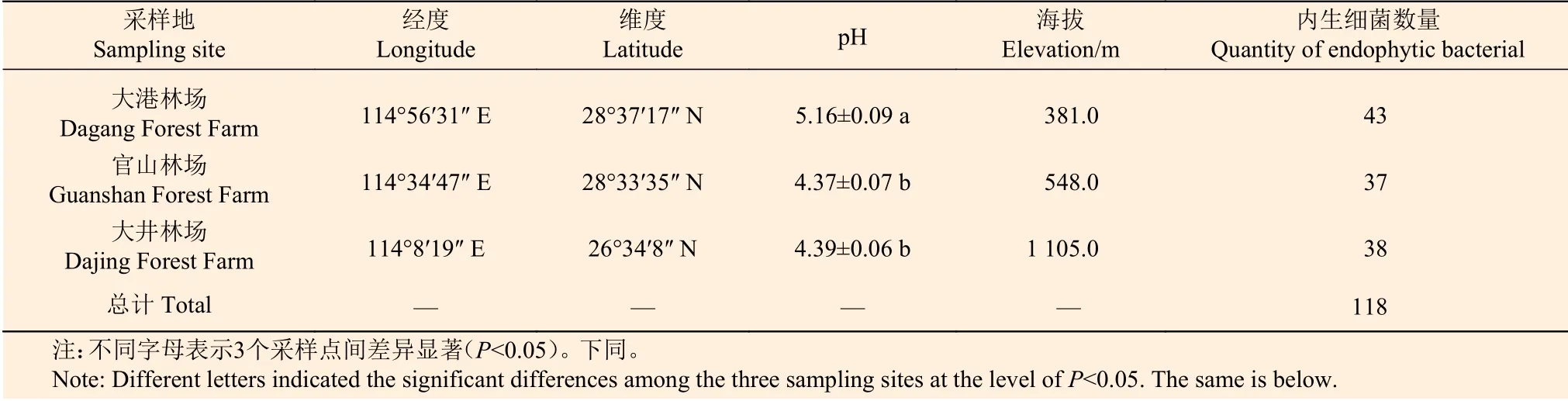
表 1 采集地毛竹根系細菌分離數量 Table 1 The quantity of bacteria from Ph. edulis roots
2.2 毛竹枯梢病病原菌內生拮抗細菌的篩選
通過平板對峙試驗,從毛竹根系中分離純化的118株細菌中,對竹喙球菌有拮抗作用的菌株有16株,其中菌株PN1和PN6對病原菌竹喙球菌有較強抑菌活性(圖1)。平板抑菌帶寬度分別可達2.81 cm和2.13 cm(表2)。菌株PN1和PN6發酵液對竹喙球菌也具有較好的抑菌活性,抑菌效果分別可達58.82%和49.28%(表2)。
2.3 菌株PN1和PN6生長曲線比較
由圖2可知,菌株PN1和PN6的菌液OD600值在0~30 h增長較快,菌株PN1在接種后約36 h內達到最大值2.30,而菌株PN6在接種42 h后達最大值2.18。之后2株細菌的OD600值的變化差異不明顯,標志菌株生長進入穩定期(圖2)。血球計數板計數結果顯示,培養液中菌株PN1和PN6的菌體密度在培養36 h和42 h后分別增加了約125倍和116倍,且菌株PN1的生長能力高于菌株PN6。

圖 1 2株內生拮抗細菌對病原菌平板對抗 A: PN1; B: PN6Fig. 1 The inhibition zone of strain PN1 and PN6 to pathogenic fungi. A: PN1; B: PN6
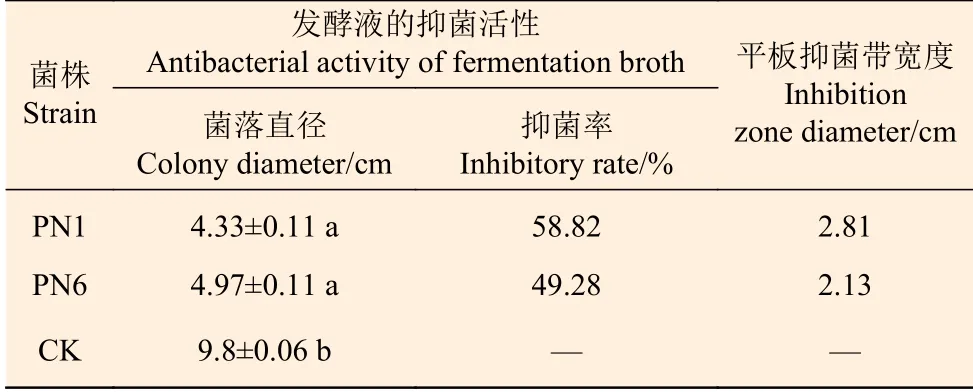
表 2 菌株PN1和PN6對竹喙球菌的抑菌活性Table 2 The antagonistic function of antagonistic bacteria PN1 and PN6 to pathogenic fungi
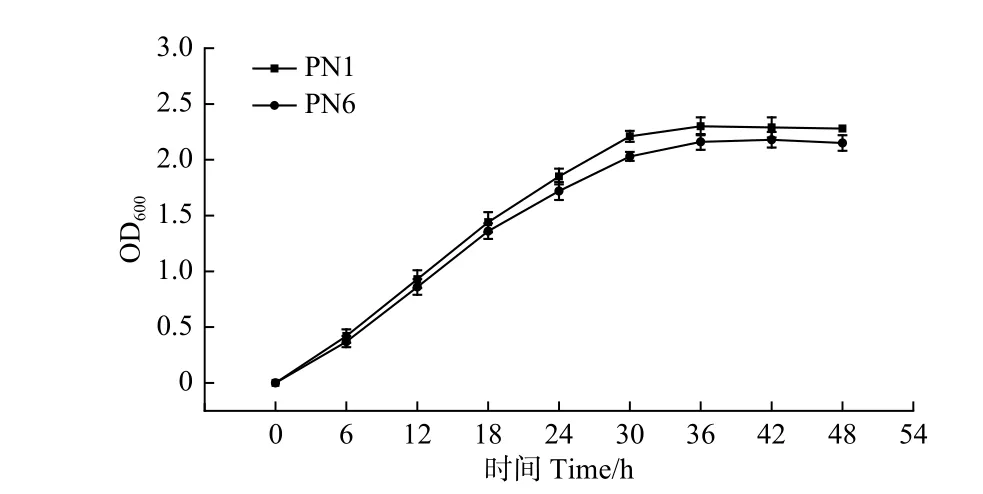
圖 2 菌株PN1和PN6在NB培養基中30 ℃下的生長情況Fig. 2 Growth of strains PN1 and PN6 in NB medium at 30 ℃
2.4 內生拮抗細菌PN1和PN6解磷能力的測定
菌株PN1和PN6在NBRIP固體培養基均有解磷圈,具有較好的解磷能力(圖3)。將菌株PN1和PN6分別接種于NBRIP-BPB液體培養基中振蕩培養3 d和6 d后,測定菌株PN1和PN6對磷酸三鈣的溶解能力。結果顯示,這2株細菌在第3 d和6 d均具有較強的解磷能力,菌株PN1解磷量分別為179 mg·L-1和236.33 mg·L-1,菌株PN6解磷量分別為203.67 mg·L-1和278.21 mg·L-1(圖4)。
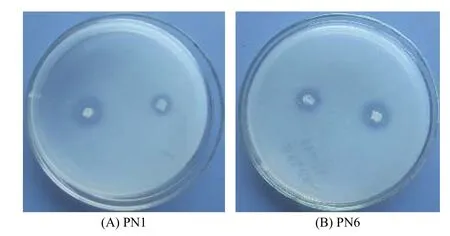
圖 3 菌株PN1和PN6在NBRIP培養基產生的解磷圈(A:PN1;B:PN6)Fig. 3 The halo of strain PN1 and PN6 in NBRIP medium(A:PN1;B:PN6)
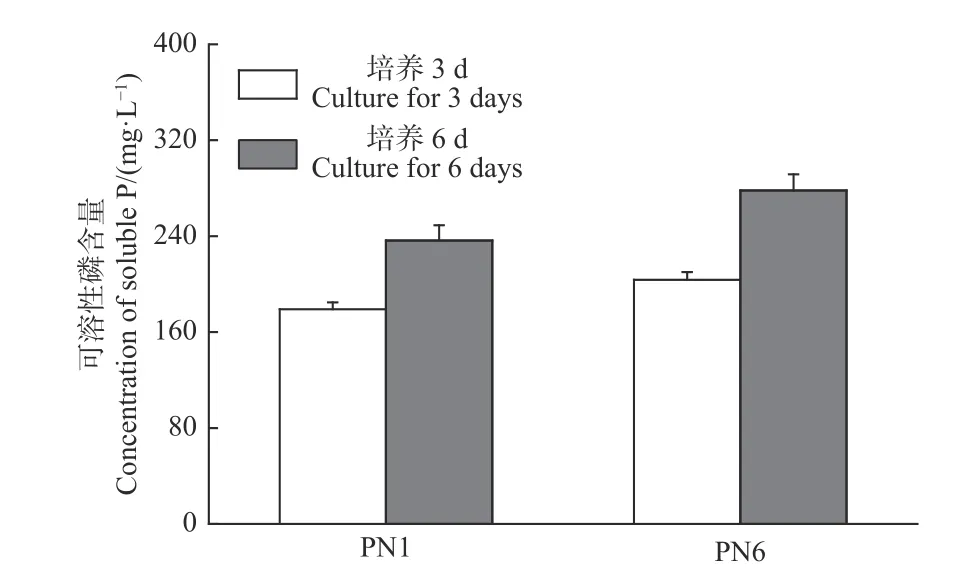
圖 4 菌株PN1和PN6在30 ℃振蕩培養3 d和6 d時培養液中可溶性磷含量Fig. 4 Soluble phosphorus concentration in culture liquid of strains PN1 and PN6 in 30 ℃ between 3 days and 6 days
2.5 內生拮抗細菌PN1和PN6產IAA能力
采用Salkowski比色法對菌株PN1和PN6定量測定,結果顯示菌株PN1和PN6有著較好的分泌IAA能力,其IAA分泌量分別為15.17 mg·L-1和12.36 mg·L-1(圖5)。
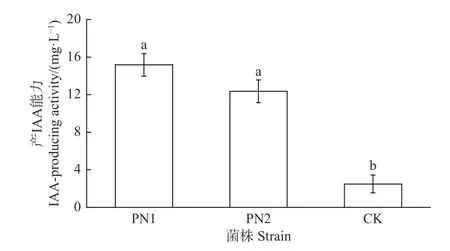
圖 5 菌株PN1和PN6產IAA能力Fig. 5 IAA-producing activity of strains PN1 and PN6
2.6 菌株PN1和PN6的鑒定
2.6.1 菌株PN1和PN6的形態、生理生化特性 菌株PN1和PN6在NA培養基上培養48 h后,菌落均呈圓形,顏色呈淡乳白色,不透明(圖6)。顯微觀察結果顯示,2株細菌均為桿菌;生理生化特征分析顯示,2株細菌均屬于好氧性革蘭氏陰性桿菌(表3)。
圖 6 菌株PN1和PN6的菌落形態(A:PN1;B:PN6)Fig. 6 The colony morphology of strains PN1 and PN6 (A: PN1; B: PN6)

表 3 菌株PN1和PN6生理生化特征Table 3 Biochemical and physiological characteristics of strains PN1 and PN6
2.6.2 菌株PN1和PN6的Biolog鑒定 將分離純化的PN1和PN6于Biolog鑒定板30℃恒溫培養18~24 h后,置Biolog自動微生物鑒定儀上讀數到相似值(SIM)均大于0.5,符合鑒定系統的要求。菌株PN1和PN6分別鑒定為Burkholderia lata和Enterobacter ludwigii。
2.6.3 菌株PN1和PN6的16S rDNA鑒定 菌株PN1和PN6的16S rDNA基因序列已提交至GenBank中(登錄號為MF285775和MG452788)。由圖7的系統進化樹可知,菌株PN1與Burkholderia lata聚類同一個分支,相似度達98%,菌株PN6與Enterobacter ludwigii聚類同一個分支,相似度達100%,說明具有較接近的親緣關系,參照菌落形態特征和生理生化等指標,菌株PN1鑒定為B. lata,PN6鑒定為E. ludwigii。
2.7 菌株PN1和PN6對毛竹實生苗的促生長作用
施用菌劑180 d后菌株PN1和PN6均能促進毛竹實生苗的生長(圖8)。施菌處理后毛竹的苗高和地徑均顯著高于對照,菌株PN1和PN6處理的地徑增長率分別為39.51%和42.59%,苗高增長率分別為54.42%和62.51%(表4)。
3 討論
植物體內分布著多種內生真菌、細菌等有益微生物,這些微生物與植物在長期發育進化過程中形成了穩定的定殖環境,在維持植物健康方面發揮著重要作用[21]。目前利用內生細菌對植物病害進行生物防治方面的研究從廣度到深度均取得了快速發展[22-23]。如Orawan等人從柑桔中分離出內生細菌芽孢桿菌對柑桔潰瘍病有較好的拮抗作用[24];李亮亮從松樹體內分離出3株細菌,經發酵液浸漬試驗顯示3株細菌對松材線蟲有較高殺線活性[25];Wicaksono從獼猴桃分離出5株內生細菌,拮抗試驗顯示5株細菌對獼猴桃細菌性潰瘍病病原菌丁香假單胞菌Pseudomonas syringae具有較強的拮抗作用,并發現其中3種內生細菌能通過接種試驗成功定殖在獼猴桃體內,顯著降低潰瘍病的發生程度[26]。一系列研究結果表明,內生細菌在防治植物病害方面具有一定功效,且有較強的適生性,易在植物體內定殖、形成種群優勢,不會對生態環境造成危害[11,21]。因此,本試驗篩選出菌株PN1和PN6可為今后生物防治毛竹枯梢病時優先考慮應用的菌株。迄今關于拮抗細菌抗病性的相關機制可能是其產生某些抗病原菌的低分子量化學物質,如木質素、胼胝質和多聚物等,也可能是通過誘導一些水解酶、氧化酶類以及相關蛋白的產生進行[27]。本試驗篩選的菌株PN1和PN6分別為Burkholderia lata和Enterobacter ludwigii,以往研究顯示,Burkholderiasp.對病原菌的抑制機制主要與其產生的木假絲菌素、洋蔥菌素吩嗪、硝吡咯菌素和賽派素等相關代謝產物密切相關[17],Enterobactersp.對病原菌的抑制機制主要是通過產生幾丁質分解酶來抑制病原菌活性[28]。本研究中這2株細菌產生何種代謝產物來抑制竹喙球菌尚不清楚,具體拮抗機制還有待研究,以便在今后防治毛竹枯梢病時發揮其最大潛力。
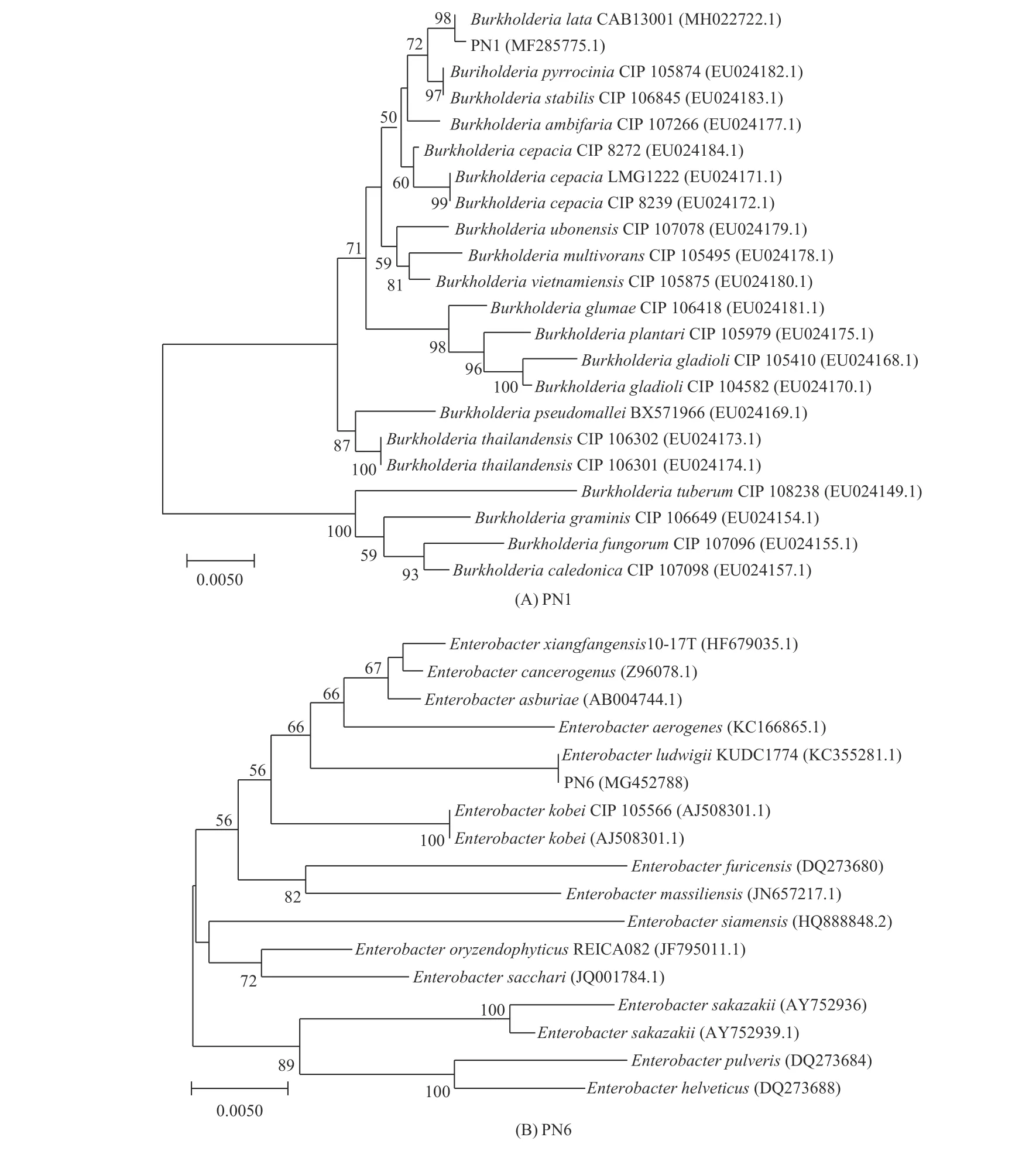
圖 7 基于16S rDNA序列菌株PN1和PN6的系統進化樹(A:PN1;B:PN6)Fig. 7 Phylogenetic tree of strain PN1 and PN6 based on 16S rDNA sequence (A: PN1; B: PN6)

圖 8 施用菌株PN1和PN6對毛竹促生效果的盆栽試驗(180 d)Fig. 8 Inoculated with phosphate-solubilizing fungi PN1 and PN6 for Ph. edulis growth promotion in pot experiment (180 d)
近年來,內生細菌除了具有防治植物病害的能力外,其它生物學功能也屢見報道[10,29]。如姚玉玲從高寒草地矮生嵩草中分離1株內生細菌263AG5,發現該菌株對馬鈴薯炭疽病病原菌有較好的抑制作用,對磷酸三鈣具有較好的溶解作用,此外還具有固氮和產IAA功能[30];Daniel篩選出2株內生細菌E25和CR71,能釋放揮發性有機化合物,對植物灰霉病有顯著的拮抗作用,溫室試驗顯示這2株細菌能顯著提高番茄葉綠素含量和生物量[31];Zhao從河南大豆根瘤中分離276株內生細菌,通過對大豆疫霉菌的拮抗試驗篩選出6株抑菌活性較強的細菌,并發現這些菌株具有產鐵載體、IAA及固氮功能[32]。與已報的功能菌株相比,本研究中篩選出的菌株PN1和PN6具有較好的分泌IAA能力和抑菌功能,且對磷酸三鈣具有較好的溶解作用,其產IAA和解磷能力可比其他菌株強至2~3倍[26,30,32],盆栽接種試驗也顯示這2株細菌對毛竹實生苗具有顯著的促生長作用,該結果顯示了這2株細菌具有多功能特性,具有開發成為抗病促生相關生物菌劑的潛力。以往部分研究證實內生細菌可通過抑制病原菌的侵染、提高寄主對逆境的抗性和通過產生植物激素、提高植物對有效養分的吸收等方式來促進植物生長[33]。我國毛竹主要分布于江西、浙江等亞熱帶丘陵紅壤地區[34],這些地區土壤由于水土流失嚴重導致氮、磷、鉀等養分供應不足,極大地限制了竹林的持續經營和利用[35]。如最近研究表明磷已成為毛竹產量提升的主要制約因子[36]。因此,篩選出具有多功能生物學特性的細菌對于防治毛竹枯梢病及提高竹林土壤養分含量是一條有效的生物途徑[34]。而本試驗所篩選的菌株PN1和PN6既能降低在定殖于毛竹體內時的生防效應,又能較小受到來自土著微生物的干擾,為毛竹生長過程提供有效養分,進而提高竹林生產力。同時,本研究的結果也擴充了促生細菌種質資源,為改善毛竹養分有效性提供了新的生物途徑,也間接證實內生細菌也是優良促生菌株的重要資源庫[37]。
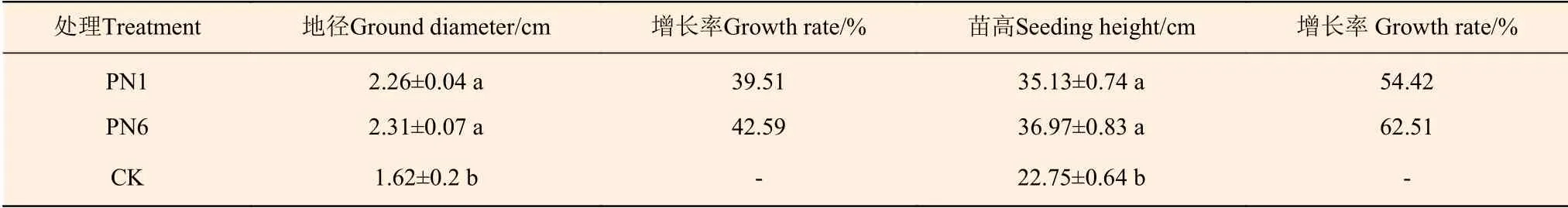
表 4 接種菌株PN1和PN6對毛竹實生苗生長的影響(180 d)Table 4 The effect of adding strains PN1 and PN6 on the growth of Ph. edulis seedling (180 d)
4 結論
本研究從毛竹根系中分離到16株對毛竹枯梢病病原菌竹喙球菌(C. phyllostachydis)具有拮抗作用的內生細菌,其中菌株PN1和PN6的抑菌活性最顯著,這2株細菌也具有較好的解磷能力和分泌IAA能力。菌株PN1和PN6分別被鑒定為Burkholderia lata和Enterobacter ludwigii。盆栽結果顯示2株細菌均能顯著促進毛竹實生苗生長。以上結果表明這2株細菌具有多功能特性,具有開發成為抗病促生相關生物菌劑的潛力。

