基于高通量測序探討健脾調肝飲對肥胖小鼠腸道菌群的影響
谷雨明, 王喆, 馮博
(1.濰坊醫學院附屬醫院中醫科,山東濰坊 261031;2.濰坊醫學院中醫教研室,山東濰坊 261031;3.上海中醫藥大學2020級博士研究生,上海 200000;4.山東第一醫科大學第一附屬醫院中醫科,山東濟南 250014)
肥胖與糖尿病、高血壓病、高脂血癥等多種疾病密切相關。《柳葉刀》雜志中一項研究顯示我國肥胖人口已經超越美國位居世界首位[1]。腸道菌群已經成為肥胖發病機制的研究熱點。本課題組前期臨床和實驗研究表明,健脾調肝飲可以有效降低體質量、減少白色脂肪堆積[2-5]。為進一步闡明健脾調肝飲的作用靶點,本研究從腸道菌群角度探討其對肥胖的可能作用機制,以期為健脾調肝飲的臨床應用提供實驗依據,現將研究結果報道如下。
1 材料與方法
1.1實驗動物及飼料40 只普通雄性C57BL/6J小鼠,4周齡,由濟南朋悅實驗動物繁育有限公司提供,動物質量合格證編號: SCXK(魯)20140007。造模所用的高脂飼料(具體成分按質量分數配比:62.8%基礎飼料、10%蛋黃粉、12%豬油、5%蔗糖、5%奶粉、5%花生、0.2%膽鹽),購自北京科澳協力飼料有限公司。普通基礎飼料,購自北京科澳協力飼料有限公司。
1.2藥物、試劑與儀器健脾調肝飲(由生黃芪30 g,柴胡12 g,茯苓15 g,丹參15 g,炒薏苡仁15 g,炒白芍15 g,決明子15 g,佩蘭15 g,澤瀉12 g,大黃6 g,山楂12 組成)中藥材購自山東中醫藥大學第二附屬醫院。水煎制備,4 ℃冰箱保存備用。鹽酸二甲雙胍片,由北京京豐藥業有限公司生產,國藥準字H11021518。電子天平(珠恒電子有限公司);灌胃針、注射器、離心管、蒸餾水、液氮罐等(山東省千佛山醫院醫學研究中心提供)。
1.3動物分組與肥胖模型復制40只小鼠給予基礎飼料適應性喂養1周后,隨機挑選8只小鼠作為正常對照組,繼續給予普通基礎飼料喂養,其余32 只小鼠為造模組,給予喂食高脂飼料。所有小鼠造模期間自由飲水。喂養12 周后,造模組小鼠體質量大于正常對照組平均體質量的20%,且大于± 1.96 標準差,認為造模成功;如小鼠體質量未達標準或體質量增長緩慢,認為有肥胖抵抗,予以剔除[6]。最終造模成功的小鼠23只,造模成功率為71.875%。選取合格的模型小鼠,按照體質量均一的原則隨機分為模型對照組、二甲雙胍組、健脾調肝飲組,組間及組內動物分別作標記。
1.4給藥方式及治療參考徐叔云教授主編的《藥理實驗方法學》[7],二甲雙胍組小鼠給予二甲雙胍19 mg/6 mL/kg 灌胃,健脾調肝飲組小鼠給予健脾調肝飲12 g/6 mL/kg 灌胃,正常對照組、模型對照組小鼠給予蒸餾水6 mL/kg/次灌胃。每天8∶00及16∶00各灌胃1次,連續5周。
1.5腸道菌群測序流程
1.5.1 樣本收集 末次給藥后,隨機從每組選取3只小鼠,分別單獨放入剛剛高溫高壓滅菌的小鼠籠中。用一次性無菌鑷子,收集各個小鼠新鮮的糞便標本,儲存于高溫蒸汽消毒滅菌的離心管中,并存放于液氮罐中,于-80 ℃冰箱凍存。直到全部收集完成,放入干冰運輸箱中,送至上海美吉生物醫藥科技有限公司進行16SrDNA測序。
1.5.2 DNA 抽提和聚合酶鏈反應(PCR)擴增 按照E.Z.N.A.? soil試劑盒(Omega Bio-tek,Norcross,GA,U.S.)說明書進行總DNA 抽提,利用1%瓊脂糖凝膠電泳檢測DNA提取質量。用338F(5’-ACT CCTACGGGAGGCAGCAG-3’)和806R(5’-GGAC TACHVGGGTWTCTAAT-3’)引物對V3-V4可變區進行PCR擴增。
1.5.3 Illumina MiSeq測序 將PCR產物純化后的擴增片段構文庫, 應用Illumina 公司的MiSeq PE300平臺進行測序,得到原始測序序列。
1.5.4 數據處理及分析 將原始測序序列用Trimmomatic 軟件質控,使用FLASH 軟件進行拼接,得到最終的序列。應用STAMP 進行統計分析,2組間比較采用T檢驗進行比較,多組間比較采用單因素方差分析(one-way ANOVA)。以P<0.05為差異有統計學意義。
2 結果
2.1各組小鼠糞便菌群測序情況通過16SrDNA高通量測序,各組樣品PCR產物平均在300 ~500 bp之間,均為合格樣本。稀釋性曲線顯示隨著測序量的不斷增加,曲線趨向平坦,表明測序數據量合理,測序深度足夠。見圖1。

圖1 各組合格樣本菌群稀釋性曲線Figure 1 Coverage curves of gut microbiota in qualified samples of various groups
2.2各組小鼠腸道菌群物種注釋與評估各組小鼠腸道菌群生物學分類情況:12 個糞便標本共檢測出17 個門(phylum)、36 個綱(class)、72 個目(order)、118個科(family)、239個屬(genus)、372個種(species)的腸道菌群,總操作分類單元OTU 數為761個。詳見表1。

表1 各組小鼠腸道菌群生物學分類情況Table 1 The biological classification of gut microbiota in mice of various groups (n/個)
2.3樣本比較分析ANOSIM 分析各組間差異明顯大于組內差異(P<0.05),分組方式有統計學意義。見表2、圖2。
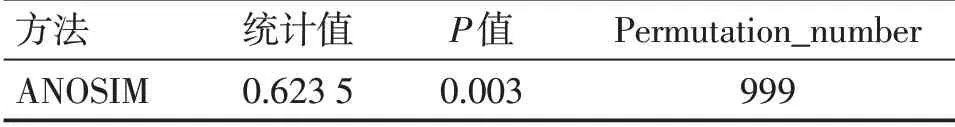
表2 分組ANOSIM分析統計值Table 2 ANOSIM analysis statistics

圖2 組間距離盒狀圖Figure 2 Box-plot for distance among inter-groups
2.4各組小鼠腸道菌群物種組成分析
2.4.1 物種維恩圖分析 在OTU水平上,各組間有共同之處,也存在一定差異。具體見圖3。

圖3 各組OTU水平維恩圖Figure 3 Venn diagram for OTU level in various groups
2.4.2 群落組成分析 在門水平上, 正常對照組、模型對照組、健脾調肝飲組群落分布都是以擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes)為主,前2組擬桿菌門豐富度較高,健脾調肝飲組厚壁菌門豐度較高,二甲雙胍組以擬桿菌門、厚壁菌門及疣微菌門(Verrucomicrobia)豐富度高。此外, 正常對照組和健脾調肝飲組在放線菌門(Actinobacteria)上也有較高的豐富度,肥胖組則相對較低。見圖4。相應的群落熱圖也展示出相應的豐富度情況,見圖5。

圖5 各組腸道菌群門水平群落熱圖Figure 5 Community heatmap for phylum level of gut microbiota in various groups
2.5各組小鼠腸道菌群物種差異分析
2.5.1 多組間比較 在門水平上,各組腸道菌群物種在擬桿菌門、厚壁菌門上存在顯著性差異(P<0.01)。見圖6。

圖6 4組腸道菌群門水平比較Figure 6 Comparison of phylum level of gut microbiota in the 4 groups
2.5.2 正常對照組與模型對照組比較 在門水平上,正常對照組與模型對照組腸道菌群物種間差異性不顯著(P>0.05);在科水平上,2 組腸道菌群在梭菌科_1(Clostridiaceae_1)存在顯著性差異(P<0.01)。見圖7。

圖7 正常對照組與模型對照組腸道菌群科水平比較Figure 7 Comparison of family level of gut microbiota in the normal control group and model control group
2.5.3 二甲雙胍組與模型對照組比較 在門水平上,二甲雙胍組與模型對照組腸道菌群物種在疣微菌門、變形細菌門(Proteobacteria)上差異顯著(P<0.01),在擬桿菌門上存在差異(P<0.05)。見圖8。

圖8 二甲雙胍組與模型對照組腸道菌群門水平比較Figure 8 Comparison of phylum level of gut microbiota in the metformin group and model control group
2.5.4 健脾調肝飲組與模型對照組比較 在門水平上,健脾調肝飲組與模型對照組腸道菌群物種在擬桿菌門、厚壁菌門上差異性顯著(P<0.01),在放線菌門上有顯著性差異(P<0.05)。見圖9。

圖9 健脾調肝飲組與模型對照組腸道菌群門水平比較Figure 9 Comparison of phylum level of gut microbiota in SLP group and model control group
2.5.5 健脾調肝飲組與二甲雙胍組比較 在門水平上,健脾調肝飲組與二甲雙胍組腸道菌群物種在厚壁菌門、 疣微菌門上差異有顯著性(P<0.01),在Unclassified_k__norank、擬桿菌門、放線菌門、 Tenericutes 上存在顯著性差異(P<0.05)。見圖10。

圖10 健脾調肝飲組與二甲雙胍組腸道菌群門水平比較Figure 10 Comparison of phylum level of gut microbiota in the SLP group and metformin group
2.5.6 正常對照組與二甲雙胍組比較 在門水平上, 擬桿菌門、 疣微菌門上差異性顯著(P<0.01)。見圖11。

圖11 正常對照組與二甲雙胍組腸道菌群門水平比較Figure 11 Comparison of phylum level of gut microbiota in the normal control group and metformin group
2.5.7 健脾調肝飲組與正常對照組比較 在門水平上,健脾調肝飲組與正常對照組腸道菌群物種在擬桿菌門、厚壁菌門上差異性顯著(P<0.01)。見圖12。
3 討論

圖12 健脾調肝飲組與正常對照組腸道菌群門水平比較Figure 12 Comparison of phylum level of gut microbiota in the SLP group and normal control group
肥胖癥的病因復雜,既往關注點側重于運動消耗、飲食攝入等方面。近年來研究顯示,腸道菌群異常與肥胖的發生存在密切關聯。人體腸道內的微生物群被認為是人體的第二基因組。寧光教授團隊研究發現,與肥胖人群相比,正常人腸道菌群更加豐富,且肥胖人群腸道菌群中多形擬桿菌的含量明顯降低[8]。丹麥的研究者發現,本國的肥胖人群體內腸道菌群的數量和多樣性明顯低于正常人群[9]。動物研究也顯示,肥胖宿主與正常宿主間的腸道菌群存在差異,移植了肥胖小鼠腸道微生物的無菌小鼠體脂含量顯著上升[10]。可以認為,腸道菌群紊亂是肥胖的重要致病因素。
目前,腸道菌群引起肥胖的作用機制尚未完全闡明。近年來腸道菌群對脂肪代謝的影響受到重視,“腸道菌群-脂肪” 信號軸(microbiota-fat signaling axis,MFSA)的概念[11-12]被提出。“腸道菌群-脂肪” 信號軸的基本構成包括腸道菌群、脂肪組織、相關內分泌和免疫系統等。“腸道菌群-脂肪” 信號軸各部分相互作用,形成了復雜的反饋性網絡,通過多途徑影響機體的脂肪代謝。越來越多的研究顯示 “腸道菌群-脂肪” 信號軸對白色脂肪棕色化有調控作用;還有研究顯示,將熱量限制方式干預的小鼠腸道菌群移植到肥胖小鼠體內,可以明顯增強功能性棕色脂肪活性,考慮其與抑制Toll樣受體4(TLR4)通路有關[11];另有研究發現,經過腸道處理的無菌小鼠體內AMP 活化的蛋白激酶(AMPK)活性增加,促進肥胖小鼠腹股溝皮下和周圍臟器內脂肪組織發生褐變[12-13]。故我們認為可通過 “腸道菌群-脂肪” 信號軸調節腸道菌群以促進白色脂肪棕色化,從而達到減肥的作用。
作為糖尿病診療指南的一線治療藥物,二甲雙胍不僅可以改善胰島素敏感,還具有減肥作用,其應用于肥胖的治療展現出較好的療效及安全性[14-17]。本課題組前期研究選擇二甲雙胍作為陽性對照藥物,顯示其有減輕體質量的作用,因此本次研究也選用二甲雙胍作為陽性對照藥物。
腸道菌群數據分析顯示,從OTU 數量上,正常對照組高于二甲雙胍組、模型對照組,健脾調肝飲組略高于正常對照組,其中,二甲雙胍組OTU 數量明顯減少,可見高脂飲食在一定程度上降低了小鼠腸道菌群的多樣性,二甲雙胍可顯著降低腸道菌群多樣性。在門水平上,正常對照組和模型對照組沒有顯著性差異,但是,在科水平上存在顯著性差異,這個結果和文獻數據稍有差異,可能與樣本量過少有關;現有數據也提示高脂飲食可能通過改變小鼠腸道菌群的豐富度及多樣性導致肥胖的產生。在門水平上,二甲雙胍組腸道菌群的疣微菌門的豐富度明顯高于其他組,健脾調肝飲組腸道菌群厚壁菌門豐富度增高,擬桿菌門豐富度降低。表明二甲雙胍和健脾調肝飲對肥胖小鼠腸道菌群具有不同的調節作用,提示2種藥物減輕體質量的機制不同。二甲雙胍雖然也具有很好的減輕體質量作用,但是,存在腸道菌群豐富度及多樣性減低的風險,而健脾調肝飲在減輕小鼠體質量的同時,可以更好地恢復肥胖小鼠腸道菌群的豐富度及多樣性。本課題組前期研究已表明,健脾調肝飲可減輕肥胖小鼠的體質量,并可促進白色脂肪棕色化[5]。再結合文獻研究,我們認為健脾調肝飲可能通過調節肥胖小鼠腸道菌群,以此介導 “腸道菌群-脂肪” 信號軸促進白色脂肪棕色化,以達到減輕體質量的作用。
綜上所述,本研究初步明確了健脾調肝飲與腸道菌群之間的聯系,進一步豐富了 “腸道菌群-脂肪” 信號軸的科學內涵,亦可為健脾調肝飲臨床應用治療肥胖提供依據。在今后的研究中,我們有待應用宏基因組測序、代謝組學等技術更深入地探究健脾調肝飲對腸道菌群及 “腸道菌群-脂肪” 信號軸的作用機制。

