慢病毒介導miR-222穩(wěn)定沉默結腸癌細胞系的構建及其生物學作用
朱朝陽 賴冬萍 張濤 丁明健 卓少元 黃曉燕
1廣西中醫(yī)藥大學附屬瑞康醫(yī)院(南寧530011);2廣西中醫(yī)藥大學(南寧530000);3廣西中醫(yī)藥大學第一附屬醫(yī)院(南寧530000)
微小RNA(miRNA,microRNA)是短的(20 ~24 nt)非編碼核糖核酸,通過影響微小核糖核酸的穩(wěn)定性和翻譯,參與多細胞生物中基因表達的轉錄后調節(jié)。miRNAs表達異常與細胞自噬、蛋白質折疊等密切相關,可致靶基因活動異常,作為致癌或抑癌基因,在結腸癌中占據(jù)重要地位[1-2]。筆者前期通過收集6例病理證實結腸癌(炎癥相關)患者的術后腸道標本,及6例健康志愿者腸道活檢取材,利用基因芯片識別差異表達的miRNAs,篩選差異表達基因及相關通路。應用生物信息學,采用基因本體GO分析和途徑富集分析發(fā)現(xiàn)大腸癌存在74個表達上調miRNA、26個表達下調miRNA,其中miR-222上調通過靶向調節(jié)TGF-β、MAPK信號通路,參與炎癥相關結腸癌的發(fā)生、發(fā)展[3-4]。為證實miR-222在結腸癌中的致病地位及其生物學效應,本研究擬篩選、構建慢病毒miR-222穩(wěn)定沉默的結腸癌細胞株,觀察穩(wěn)定沉默miR-222基因后,HCT-116結腸癌細胞增殖、凋亡、周期進程以及細胞遷移的變化,探討miR-222與結腸癌發(fā)生、發(fā)展的關系。
1 材料與方法
1.1 材料
1.1.1 實驗材料人結腸癌細胞CaCO2、HTC-15、HT-29、HCT-116、sw480、sw620。以上細胞由賽百慷(上海)生物技術股份有限公司提供,STR鑒定。293T細胞(人胚腎細胞)購自中國科學院細胞庫。
1.1.2 主要試劑胎牛血清、DMEM-高糖培養(yǎng)基、RPMI-1640培養(yǎng)基、青鏈霉素、PBS磷酸鉀緩沖液均購自Hyclone公司,胰酶Trypsin-EDTA Solution購自GIBCO公司,SYBR Green qPCR SuperMix購自Invitrogen公司;慢病毒載體(GenePharma提供的重組Lentivirus顆粒),重組穿梭質粒和包裝質粒pGag/Pol、pRev、pVSV-G由廣州銘善上生物公司構建制備,Puromycin Dihydrochloride(Thermo公司提供)。Hepes AMRESCO 7365-45-9,LipofectamineTM 2000轉染試劑,Polybrene Sigma H9268,T4 DNA Ligase酶(購于TaKaRa公司),氨芐青霉素,DNA凝膠回收試劑盒(DONGSHENG BIOTECH),cellTiter96AQ單溶液細胞增殖檢測試劑(Promega,Cat.No.G3582),Annexin V-FITC細胞凋亡檢測試劑盒(keygen,貨號KGA106),凱基細胞周期檢測試劑盒(貨號KGA511)。
1.2 方法
1.2.1 RT-PCR 檢測不同結腸癌細胞miR-222 的mRNA表達分別收集已成功培養(yǎng)CaCO2、HTC-15、HT-29、HCT-116、sw480、sw620結腸癌細胞(1 ×106)。RT-PCR步驟如下:總RNA抽提去基因組總RNA純度和完整性檢測逆轉錄定量PCR。PCR反應條件為:95 ℃5 min;95 ℃15 s,60 ℃32 s讀板,40 cycles;熔解曲線分析:溫度60 ~95 ℃。委托上海生工技術有限公司合成miR-222、內參U6引物序列(表1)。
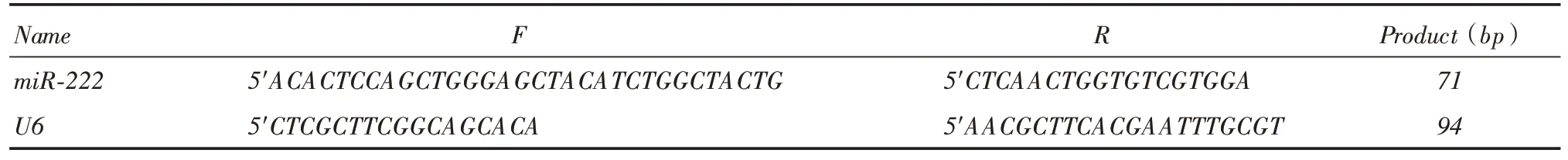
表1 miR-222、內參U6 引物序列及擴增片段Tab.1 miR-222,U6 primer sequence and amplified fragment
1.2.2 TUD-hsa-miR-222-3p Inhibitor 慢病毒載體構建應用TuD RNA(Tough Decoy RNA)的設計方法構建miRNA的抑制慢病毒載體。將穩(wěn)定沉默miR-222有效序列合成、退火形成miR-222 DNA雙鏈,將plvx-shRNAPuro載體XhoI與EcoRII雙酶切載體,在T4 DNA Ligase連接酶的作用下與雙鏈miR-222 DNA于16 ℃1 h進行連接反應制備克隆連接液,轉化DH5α感受態(tài)細胞,挑取若干個陽性單克隆質粒菌落,由上海生工基因公司進行測序鑒定。
1.2.3 病毒包裝制備編碼慢病毒顆粒的重組病毒質粒及其三種輔助包裝原件載體質粒(pGag/Pol、pRev、pVSV-G),運用質粒載體進行高純度無內毒素抽提,用轉染試劑LipofectamineTM 2000轉染293T細胞,轉染后更換為完全培養(yǎng)基,培養(yǎng)、收集富含慢病毒顆粒的細胞上清液,濃縮為高滴度的慢病毒濃縮液,感染293T細胞后用有限稀釋法標定病毒滴度。慢病毒包裝完成,將其存放于-80 ℃中備用。
1.2.4 穩(wěn)定細胞株篩選及轉染培養(yǎng)結腸癌細胞HCT-116,取對數(shù)生長期的細胞進行實驗。接種(3 ~5)× 103個結腸癌HCT-116細胞于96孔培養(yǎng)板中,調整細胞融合度為30%~50%,用常規(guī)培養(yǎng)基稀釋病毒作濃度梯度篩選,Polybrene(6 μg/mL)感染細胞后動態(tài)觀察細胞活性。篩選感染細胞最佳MOI后,以接種密度為2×104個細胞,體積100 μL,接種于96孔板中,用慢病毒感染結腸癌HCT-116細胞,Puromycin壓力篩選1周后,挑選陽性克隆細胞,進行細胞擴增、RT-PCR檢測miR-222相對表達量,在倒置熒光顯微鏡下觀察細胞GFP熒光表達情況,評價感染效率,以確定成功構建穩(wěn)定沉默miR-222結腸癌HCT-116細胞系及陰性對照細胞(NC組)。收集同期未轉染的細胞設為空白對照組(HCT-116組)。
1.2.5 MTS 法檢測細胞存活率分別收集轉染后24、48 h各組細胞1×104,加入10%cellTiter96AQ單溶液細胞增殖檢測試劑,在孵育4 h后,酶標儀讀板,MTS檢測讀取OD490數(shù)據(jù)。參照公式計算細胞存活率=(其他時間點OD值均值÷0 h OD值均值-1)×100%(同一樣品)。
1.2.6 Annexin V-FITC 檢測細胞凋亡分別收集各組細胞(1 × 106),胰酶消化細胞,將1.25 μLAnnexin V-FITC加入細胞懸液中,室溫(18 ~24 ℃)避光反應15 min;去上清后,重懸細胞,加入10 μL Propidium Iodide,立即上機用流式細胞儀檢測分析細胞凋亡率。
1.2.7 流式細胞儀檢測細胞周期分別收集各組細胞(1 × 106),用乙醇進行細胞固定,加入溴化丙錠、100 μg/mL RNase A,0.2% Triton X-100,4 ℃避光孵育30 min,進行細胞染色。以標準程序用流式細胞儀檢測,計數(shù)(2 ~3)×104個細胞,用ModFit分析細胞周期結果。
1.2.8 Transwell 小室模型檢測細胞遷移分別收集各組細胞1 × 105,用100 μL無血清培養(yǎng)基重懸后,平鋪至Transwell細胞培養(yǎng)板的小室上室,在下室加入600 μL完全培養(yǎng)基,放置37 ℃,5% CO2培養(yǎng)箱中常規(guī)培養(yǎng),孵育48 h后,取出小室,用棉簽輕輕拭掉上室的細胞,PBS漂洗,4%多聚甲醛固定,結晶紫染色,倒置顯微鏡選取5個視野,計數(shù)穿膜細胞,取均值,評價穩(wěn)定沉默miR-222結腸癌HCT-116細胞的遷移能力。
1.3 統(tǒng)計學方法用Graphpad 8.0軟件進行數(shù)據(jù)分析,數(shù)據(jù)以均數(shù)±標準差表示,兩組間比較采用t檢驗,P <0.05為差異有統(tǒng)計學意義。
2 結果
2.1 miR-222 在結腸癌HCT-116 細胞中高表達RT-PCR顯示HCT-116的miR-222 mRNA定量表達最高,CaCO2表達最低,因此選擇HCT-116細胞為后續(xù)穩(wěn)定沉默miR-222的實驗細胞。
2.2 TUD-hsa-miR-222-3p Inhibitor 慢病毒高效轉染HCT-116 細胞建立穩(wěn)定轉染細胞系測序分析證實TUD-hsa-miR-222-3p Inhibitor慢病毒載體構建成功。篩選最佳MOI為40,確定最佳殺傷濃度是0.2 μg/mL的Puromycin篩選細胞后,應用含有綠色熒光報告基因(GFP)標記觀察穩(wěn)定細胞株,與NC組對照,熒光轉染效率達80%以上,慢病毒轉染成功并穩(wěn)定表達(圖1)。RT-PCR結果顯示miR-222基因的相對表達量降低了53.42%,miR-222在HCT-116細胞中穩(wěn)定沉默。
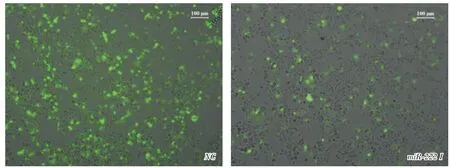
圖1 HCT-116-hsa-miR-222 Inhibitor 穩(wěn)定細胞株10×10 拍照(與NC 組對照)Fig.1 HCT-116-hsa-miR-222 Inhibitor stable cell line(10×10)
2.3 穩(wěn)定沉默miR-222 降低結腸癌HCT-116 細胞存活率MTS法檢測穩(wěn)定沉默miR-222后,HCT-116結腸癌細胞存活率變化。轉染24 h后,與NC組和正常組比較,miR-222穩(wěn)定沉默組細胞增殖率下降(P <0.05)。可見穩(wěn)定沉默miR-222組細胞較NC組和正常組生長緩慢,并且該作用隨著時間的增加而更為明顯。轉染48 h后,穩(wěn)定沉默組細胞增殖率明顯下降,差異有統(tǒng)計學意義(P <0.01)。根據(jù)MTS結果,繪制增值率差異和細胞生長曲線(圖3)。采用Annexin V-FITC檢測細胞凋亡,結果穩(wěn)定沉默miR-222后,HCT-116結腸癌細胞早期凋亡率為17.7%;NC組為1.11%;正常組為6.92%(圖4)。綜合細胞活性下降和凋亡率升高,表明沉默miR-222后,抑制了HCH-116結腸癌細胞增殖力,誘導癌細胞凋亡,從而降低了結腸癌細胞的存活率。
2.4 穩(wěn)定沉默miR-222 減緩結腸癌HCT-116 細胞周期進程流式細胞儀檢測細胞周期變化,發(fā)現(xiàn)沉默miR-222后,miR-222穩(wěn)定沉默組細胞處于S期的細胞比例明顯降低,表明沉默miR-222阻滯癌細胞周期進程(圖4)。
2.5 穩(wěn)定沉默miR-222 抑制結腸癌HCT-116 細胞遷移能力應用Transwell小室模型檢測各細胞組細胞的遷移能力,結果穩(wěn)定沉默miR-222組細胞遷移數(shù)減少,與NC組和HCT-116組比較,遷移能力下降(P <0.05,圖5)。
3 討論
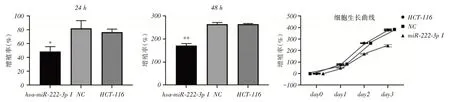
圖2 穩(wěn)定沉默miR-222 結腸癌HCT-116 細胞活性比較Fig.2 Comparison of Proliferation Rates of Stable Silenced MiR-222 Colon Cancer HCT-116 Cells

圖3 穩(wěn)定沉默miR-222 結腸癌HCT-116 細胞凋亡率比較Fig.3 Comparison of the apoptosis rate of stable and silent miR-222 colon cancer HCT-116 cells
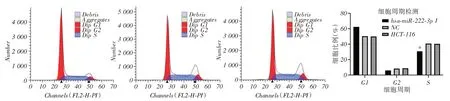
圖4 各細胞組HCT-116 結腸癌細胞周期分布差異比較Fig.4 Comparison of cycle distribution of HCT-116 colon cancer cells in each cell group

圖5 穩(wěn)定沉默miR-222 結腸癌HCT-116 細胞遷移檢測比較Fig.5 Stable and silent miR-222 colon cancer HCT-116 cell migration detection ratio
腫瘤是基因異常表達的結果,miRNAs通過與各種癌基因和抑癌基因mRNA的3′UTR區(qū)結合,影響靶基因的表達來實現(xiàn)對疾病的調控。microRNAs在癌間質中的異常表達與腫瘤的進展相關[5]。KHOSHINANI等[6]通過RT-PCR檢測miR-222/PTEN的表達,表明miR-222通過靶向調節(jié)PTEN基因誘導大腸癌的放射抵抗。亦有研究發(fā)現(xiàn),結腸癌患者糞便中miR-222定量檢測與腫瘤的分期、治療預后等關聯(lián)密切[7]。miR-222在結直腸癌發(fā)生、發(fā)展過程中不同時期所發(fā)揮的作用不同,提示了miRNAs作用的復雜性[8-9],基因靶向調控是多網(wǎng)絡、多靶點調節(jié)的結果[10]。LIU等[11]在人結直腸癌組織中發(fā)現(xiàn)miR-222的異常高表達,與RelA和STAT3 mRNAs水平的升高相關,miR-222抑制劑培養(yǎng)大腸癌細胞可降低其增殖率和集落形成,減少了結腸炎小鼠結腸腫瘤的生長。miR-222可能通過上調MST3表達,增加帕西林磷酸化,減少黏附,降低CRC細胞遷移和侵襲[12]。越來越多的證據(jù)表明miRNA的異常表達與細胞耐藥性密切相關。細胞實驗證實了miR-222-3p通過下調FOXP2可以改變結腸癌LoVo細胞對DOX的敏感性[13]。而miR-222高表達參與CRC細胞多重耐藥形成[14],推測ADAM-17抑制劑與化療藥物聯(lián)合應用可能對結直腸癌具有治療潛力。
遷移和侵襲是惡性腫瘤普遍的生物學特性,也是影響腫瘤患者生存和預后的關鍵因素,成為治療失敗的主要原因[15],近年研究[16-17]發(fā)現(xiàn),癌細胞對抗癌藥物具有多重耐藥性亦是引起CRC高病死率的又一原因。所以,尋找癌癥的新型生物學標志物及治療靶點,研發(fā)化療藥物增敏劑,成為防治結直腸癌的重要課題。本研究采用TuD RNA(Tough Decoy RNA)的設計方法構建miRNA的抑制慢病毒載體TUD-hsa-miR-222-3p Inhibitor。TuD RNA是含有頸環(huán)結構的雙鏈RNA,能夠抵抗胞內核酸酶的降解,并且TuD RNA的兩條鏈都包含一個miRNA結合位點,能夠更高效地隔離濃度較低的目標miRNA。因此TuD RNA能夠更長效的抑制miRNA。病毒靶向特定組織和細胞是科研的挑戰(zhàn),慢病毒載體是當前癌癥基因治療中最有前途的基因傳遞系統(tǒng)之一[18]。本研究采用的慢病毒載體是以國際通用的第三代載體系統(tǒng)為基礎,通過改建,構成四質粒體系。體外成功構建TUD-hsa-miR-222-3p Inhibitor慢病毒載體并轉染HCT-116細胞得到了miR-222穩(wěn)定沉默的結腸癌細胞系,明確了miR-222對HCT-16細胞的生物學影響。MICHIHISA等[5]通過ISH分析發(fā)現(xiàn)miR-222在癌間質中的高表達與結直腸癌的轉移活性和惡性潛能正相關。這說明了miR-222的水平與腫瘤細胞的增殖有極大的關系,與腫瘤的早期形成相關。我們的MTS檢測結果提示穩(wěn)定沉默miR-222后的HCT-116細胞生長緩慢,各時間點的細胞生長活力均顯著降低。同時穩(wěn)定沉默miR-222組細胞早期凋亡率明顯升高,細胞存活率下降,說明穩(wěn)定沉默miR-222具有抗結腸癌HCT-116細胞生長并誘導早期凋亡的作用,這證實miR-222低表達在結腸癌細胞早期形成中發(fā)揮抑制作用。CDKN1B(p27)阻止細胞周期蛋白E-CDK2或細胞周期蛋白D-CDK4復合物的激活而控制細胞周期進程[19-20]。本研究發(fā)現(xiàn)穩(wěn)定沉默miR-222組細胞,S期細胞所占比例明顯減少。S期是細胞DNA復制的主要階段,miR-222低表達通過上調G1/CDK阻斷劑CDKN1B(p27),使更多的細胞阻滯在G0/G1期,減少腫瘤細胞合成和DNA修復。由此筆者推測,穩(wěn)定沉默miR-222可能通過抑制癌基因表達,從而降低細胞生長活性,介導細胞周期阻滯并促進細胞凋亡,表現(xiàn)為抑癌基因的功能。GAO等[21]研究分析了miR-222介導的MIA3基因敲除及其結果證明下調MIA3可增強大腸癌細胞的遷移和侵襲。miR-141-3p過表達靶向TRAF5起腫瘤抑制作用[22]。與本研究結論類似。本研究通過Transwell小室模型檢測細胞的遷移能力,結果提示穩(wěn)定沉默miR-222后HCT-116細胞穿膜進入下室的細胞數(shù)明顯減少,表明miR-222穩(wěn)定沉默細胞株的遷移能力顯著低于NC組和正常組,進一步說明miR-222在結腸癌晚期轉移中發(fā)揮負向調控作用。
抑癌基因表達下調或失活被認為是腫瘤發(fā)生的早期事件。TGF-β激活后可誘導不同細胞類型的上皮間充質轉化(EMT)和細胞遷移[23-24]。研究表明TGF-β通過蛋白質代謝參與炎癥性腸病癌變[25]。下調miR-222-3p表達量,推測miR-222-3p可能通過靶基因TGF-β/MAPK通路負性調控結腸癌HCT-116細胞的惡性生物學行為,其下游信號傳導途徑中的作用尚未完全闡明。
綜上,本研究高通量篩選癌基因,采用慢病毒感染技術,將TUD-hsa-miR-222-3p Inhibito慢病毒載體成功轉染結腸癌HCT-116細胞,產(chǎn)生特異性的miR-222沉默效應,抑制了結腸癌HCT-116細胞的活性、周期進程和遷移能力,誘導癌細胞凋亡,下一步擬在體構建裸鼠結腸癌模型,探索miRNA-222下游靶基因表達的調控。

