髓系來源抑制細胞在舌鱗狀細胞癌中的作用
鐘文德 鄧小燕 陳廣盛
1廣州醫科大學附屬第二醫院(廣州510260);2廣州醫科大學金域學院(廣州510260)
在我國,舌癌患者以男性居多,大部分為舌鱗狀細胞癌(tongue squamous cell carcinoma,TSCC)[1]。TSCC是口腔惡性腫瘤中最具侵襲性的一種,占口腔癌的41%。盡管在多模式診斷和治療技術上有了相當大的進步,TSCC仍然是頭頸部最致命的癌癥類型之一[2]。腫瘤細胞可通過多種途徑來抑制抗腫瘤免疫應答,誘導免疫耐受,而針對髓系來源抑制細胞(myeloid-derived suppressor cells,MDSC)的免疫治療可能是對TSCC行之有效的新治療策略。MDSC是指在病理情況下,髓系細胞發育受阻而聚集的一群具有免疫抑制功能的異質性細胞,是腫瘤誘導免疫耐受的重要參與者[3-5]。既往研究[6]顯示舌癌患者外周血中MDSC細胞比例與臨床分期和病理分級正相關,提示MDSC可能是促使舌癌患者病情惡化的重要原因,然而目前具體機制尚不明確。因此,進一步探究MDSC在舌癌免疫學發病機制中的作用,對舌癌免疫治療的應用和推廣有重要意義。
1 材料與方法
1.1 標本收集選取2017年1月至2019年12月廣州醫科大學附屬第二醫院收治的舌癌(tonguecancer,TSCC)患者。納入標準:(1)年齡25 ~75歲;(2)均經病理學確診為舌癌。排除標準:合并其它系統嚴重疾病的患者。依據納入和排除標準,共納入40例舌癌患者,其中男28例(70%),女12例(30%);臨床生長方式分為潰瘍型20例(50%),外生型11例(27.5%)以及浸潤型9例(22.5%);臨床分期根據TNM分期分為早期(Ⅰ期與Ⅱ期,共18例,占45%)與晚期(Ⅲ期與Ⅳ期,共22例,占55%);根據腫瘤細胞的分化等級,中分化最多20例(50%),其次為低分化15例(37.5%),高分化為5例(12.5%);頸淋巴結轉移17例(42.5%),非轉移23例(57.5%);有吸煙史、飲酒史的患者為35例(87.5%)。同時選取了年齡段接近的健康對照(healthy control,HC)51例,其中男31例(60.8%),女20例(39.2%),兩組間男女比例、年齡差異均無統計學意義(P >0.05)。
1.2 主要試劑流式抗體CD45(APC-Cy7)、CD11b(PE-CF594)、CD33(BV421)、HLA-DR(PE -Cy7)、CD15(FITSCC)、CD4(PE)、CD8(APC)購自Biolegend公司;Trizol、ROS-DCF、S100A8及S100A9抗體購自Invitrogen公司。Western抗體β-actin、iNOS、Arg1、NOX2、S100A9購自Abcam公司。NOHA、LNMMA、NAC、CFSE、Ficoll分離液與膠原酶Ⅳ購自Sigma公司。
1.3 外周血分離PBMC 及MDSC 的流式檢測抽取靜脈血,用含EDTA抗凝管的采血管收集,加入等體積PBS混勻;用吸管將血稀釋液緩慢加入到淋巴細胞分離液Ficoll上層,18 ℃離心25 min;吸取白膜層,加PBS進行離心,裂解紅細胞,得到外周血單個核細胞(peripheral blood mononuclear cell,PBMC)。取約5 × 106細胞進行流式染色,按照抗體說明書進行抗體孵育,進行流式上機檢測,收集數據后使用Flowjo軟件進行分析。
1.4 T 細胞增殖實驗流式分選CD3+的T細胞與MDSC(HLA-DR-CD11b+CD33+)[7],將CD3+T細胞重懸于預熱的PBS+0.1%BSA中,加入CFSE(終濃度為2.5 μmol/L);37 ℃孵育15 min后,終止染色;將T細胞與MDSC以不同的比例(1∶0、1∶8、1∶4、1∶2)進行共培養。并同時加入精氨酸酶抑制劑NOHA(100 μmol/L)、iNOS抑制劑L-NMMA(100 μmol/L)、ROS抑制劑NAC(1 mmol/L)處理,3 d后收集細胞進行CD4+和CD8+ T細胞進行染色,進行流式檢測其增殖情況。
1.5 舌癌組織中單個核細胞的分離及流式檢測將腫瘤及癌旁組織剪碎,充分研磨后過濾到離心管中,加入1 mg/mL的膠原酶Ⅳ進行消化,消化條件為37 ℃,210 r/min,消化30 min,隨后4 ℃450×g離心5 min去上清,紅細胞裂解液加至2 mL裂解約2 ~3 min,PBS沖洗并重懸至單細胞懸液,取約5×105細胞進行流式抗體標記以及流式檢測。
1.6 qRT-PCR 與Western blot 檢測收集分選的MDSC樣品,參照Invitrogen公司的Trizol試劑使用說明書進行操作(qRT-PCR)。檢測基因序列見表1。Western蛋白印跡法實驗使用分選的MDSC細胞進行,按照相應的說明書進行抗體的孵育以及條帶檢測。

表1 MDSC 分選qRT-PCR 引物Tab.1 Primers for MDSC separation
1.7 統計學方法采用GraphPad Prism version 7.0a統計軟件進行統計分析,統計結果以均數±標準差表示,使用非配對的t檢驗和ANOVA分析進行結果統計分析,P <0.05為差異有統計學意義。
2 結果
2.1 TSCC患者外周血MDSCs水平增高與HC相較,TSCC患者外周血PBMC中MDSC水平出現顯著上升,比例如下:HC組(2.328±0.333 1),早期組(Early,8.29±1.791),晚期組(Late,13.56±1.456)。與HC組相比,早期組顯著升高,差異具有統計學意義(P <0.001);與早期組相比,晚期組出現增加,差異具有統計學意義(P=0.022 8,圖1A、B)。該群細胞表達CD15,主要表現為多形核MDSC(PMNMDS)。S100A8與S100A9已被證實為調控MDSC發育與功能的重要因子,本研究使用流式分析發現S100A8與S100A9在舌癌患者MDSC中表達水平呈現增加(圖1C)。
2.2 TSCC患者外周血MDSCs抑制T細胞增值腫瘤中的MDSC具有很強的免疫抑制作用[8]。為了驗證TSCC中MDSC的功能,筆者進行了T細胞增殖實驗。將分選出來的CD3+ T細胞與MDSC細胞從PBMC中分選出來進行共培養。T細胞增殖實驗結果顯示,正常人體內的MDSC無明顯抑制功能,而TSCC患者中MDSC具有較強的免疫抑制作用(T:MDSC比例為1∶4及1∶2時),提示TSCC外周血中的MDSC細胞具有較強的抑制T細胞應答的能力(圖2A、B)。
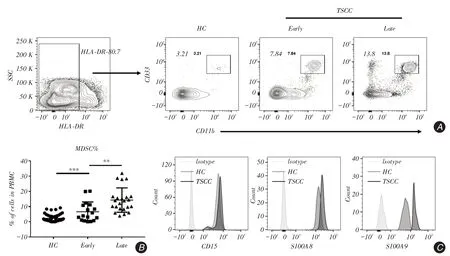
圖1 流式細胞術檢測舌癌患者外周血PBMC 中MDSC 的水平Fig.1 Detection of MDSC in TSCC patients′peripheral blood by Flow cytometry
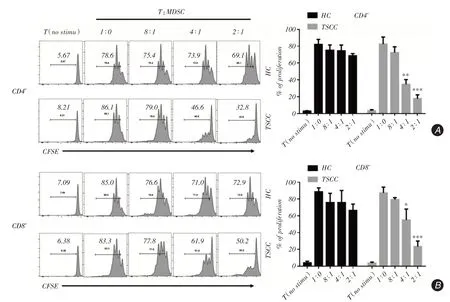
圖2 T 細胞增殖實驗結果Fig.2 The result of T cell proliferation assay
2.3 TSCC 患者MDSC 通過增加ROS 水平抑制T細胞增值在共培養的實驗組中加入了不同的通路抑制劑,發現加入ROS抑制劑后T細胞抑制功能得到了恢復,而使用其他抑制劑處理后無明顯改變(圖3A)。流式分選健康對照及TSCC患者PBMC中的MDSC細胞,進行mRNA水平的檢測,發現與ROS相關的轉錄因子NOX2在舌癌組中表達增高(P = 0.004 5),S100A9作為陽性對照基因(圖3B)。Western blot檢測結果顯示,在蛋白質水平NOX2表達也顯著增高,與mRNA水平的結果相一致(圖3C)。同時,利用流式細胞術對MDSC中的ROS進行檢測,發現與健康對照相比,舌癌患者MDSC細胞中ROS含量顯著增加[HC為(47.4±5.492),TSCC為(73.67±4.388),P=0.020 2,圖3D、E]。
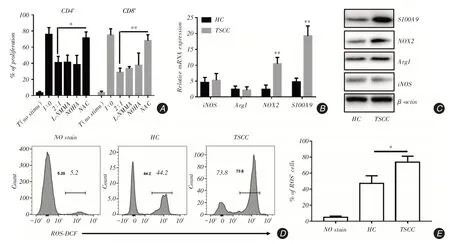
圖3 舌癌患者中MDSC 主要依賴于ROS 途徑來實施T 細胞抑制功能Fig.3 T cell inhibited by MDSC mainly relies on ROS pathway in TSCC patients
2.4 TSCC 患者腫瘤組織中MDSC 表型分析腫瘤及癌旁組織中消化分離得到細胞后,進行流式檢測。發現舌癌患者腫瘤組織以及相應的癌旁組織免疫細胞分離結果顯示與癌旁組織相比,腫瘤中存在較高水平的MDSC,且表型與外周血中基本一致,說明在腫瘤微環境中MDSC可能發揮著重要的抑制功能。
3 討論
舌癌作為口腔頜面部的惡性腫瘤之一,其發病嚴重影響患者的生活,且該病具有發病年輕化的趨勢。基于腫瘤免疫的迅速發展,免疫治療是舌癌潛在的有效治療方法。研究[9]表明人體MDSC表達CD11b和CD33,缺乏成熟髓系細胞表面分子HLA-DR,其水平與多種腫瘤發生發展密切相關,腫瘤中的MDSC通常具有很強的免疫抑制作用,靶向MDSC已成為腫瘤免疫治療的新策略。在口腔鱗癌以及食管鱗癌患者外周血中,存在較高水平的MDSC比例,這一現象在小鼠模型中也得到了驗證[10-11]。目前認為S100A8和S100A9蛋白是MDSC的特征性蛋白,是促進MDSC擴增和活化的主要分子[12]。
人類MDSC表型在不同的腫瘤中有不同的表現。人類MDSC亞型主要是由表達不同的表面標記物CD14和CD15來區分[13]。這兩個亞群的區別主要在于它們的功能,組織分布和調節機制不同[14-15]。有趣的是在絕大多數腫瘤模型中,腫瘤誘導的PMN-MDSC細胞占總MDSC的70%~80%[16]。PMNMDSC通過高表達ROS,從而抑制T細胞的增殖,而M-MDSC通過高表達NO抑制T細胞的增殖。本研究發現在舌癌患者的外周血和腫瘤組織中,MDSC細胞表達水平出現顯著增高,且隨著病情進展呈現出上升趨勢。該群細胞主要表達CD15以及MDSC的特征性蛋白S100A8及S100A9,說明該群細胞主要為粒細胞型MDSC。與正常人外周血的MDSC比較,舌癌患者中MDSC具有較強的抑制T細胞應答的能力,提示在舌癌相關的腫瘤微環境中MDSC可能發揮著重要的免疫抑制功能,從而在促進腫瘤細胞的免疫逃逸中起重要作用。因此,舌癌患者中MDSC細胞不僅表現為比例的增加,還表現為功能活性的增強。因為MDSCs擁有廣譜的免疫抑制活性,在得到可靠結論之前,它們對其他類型的免疫細胞的影響仍然需要被證實。
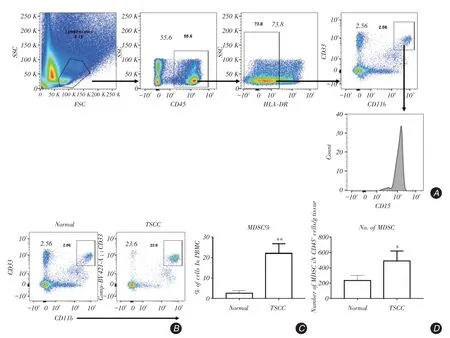
圖4 流式檢測舌癌腫瘤組織中MDSC 的水平Fig.4 Detection of MDSC in TSCC tissues by flow cytometry
基于以上結果,筆者進一步對參與其中的分子機制進行研究,通過加入不同的通路抑制劑與舌癌患者的MDSC與T細胞共培養,發現ROS的抑制劑可以阻斷該群MDSC對T細胞增值抑制的能力,提示舌癌患者中的MDSC可能主要依賴于ROS途徑來發揮T細胞抑制功能。MDSC通常通過高表達精氨酸酶1(ARG1)和誘導型一氧化氮合酶(iNOS)來發揮T細胞抑制功能,另外,在腫瘤中,MDSC中NADPH氧化酶(NOX2)表達上調,產生活性氧(reactive oxygen species,ROS);ROS可抑制T細胞受體(TSCCR)中CD3ζ的表達,進而抑制腫瘤抗原特異的T細胞反應[17-18]。以上研究成果為本次實驗結果提供了有力的理論基礎。以往研究證實多種炎癥相關因子(如GM-CSF,IL-6,IFN-γ等)促進了MDSC的擴增和活化[19]。在分子層面,目前認為STAT-3、C/EBPβ、IRF8、Cox-2及S100A9等參與MDSC擴 增[20-21],而STAT-1[22]、NF-κB[23]、STAT-6[24]等則主要調控MDSC活化。其中,鈣結合蛋白S100A9是調控MDSC擴增的重要分子,缺失S100A9可促進髓系細胞向下游分化,反正過表達S100A9則促進MDSC的擴增[25]。
綜上所述,本研究結果顯示舌癌患者的MDSC細胞中S100A9的表達水平明顯增高,提示舌癌促進了MDSC的擴增與活化,并且后續發現這一功能與細胞內產生的活性氧ROS密切相關,這一結果為MDSC在舌癌免疫治療中的潛在應用價值提供了新的思路,然而MDSC在舌癌發病機制中的具體作用仍有待進一步的探索。

