RyhB-cysE基因對禽致病性大腸桿菌生物表型的影響
涂健 阮苑 蔡偉真 宋祥軍 邵穎 祁克宗


摘要:在禽致病性大腸桿菌(APEC)AE17及AE17△RyhB的基礎上利用Red同源重組技術構建基因缺失株AE17△cysE、AE17△RyhB△cysE, 對野生株和基因缺失株的生長、生物被膜形成和運動特性進行分析,并采用qRT-PCR技術比較野生株和缺失株中與運動性、生物被膜形成相關基因的轉錄水平。結果顯示,各菌株生長曲線無顯著差異;AE17△RyhB、AE17△cysE、AE17△RyhB△cysE生物被膜形成能力較AE17顯著下降;AE17△cysE 、AE17△RyhB△cysE運動能力與AE17相比下降;AE17△cysE、AE17△RyhB△cysE與AE17相比flhB 、flgD、fliF和 cheY轉錄水平均降低,而AE17△RyhB△cysE與AE17△cysE相比基因轉錄水平均有所增強;AE17△RyhB、AE17△cysE、AE17△RyhB△cysE與AE17相比,flhD 、flgC、sidA轉錄水平均顯著降低。表明cysE基因缺失降低了APEC生物被膜形成能力及運動能力,且RyhB基因缺失對cysE基因的運動能力調控作用有代償作用,RyhB、cysE基因均通過調節與生物被膜形成相關的基因(flhD 、flgC、sidA)轉錄水平調控APEC生物被膜形成能力,本研究結果為研究RyhB-cysE基因對APEC的調控作用奠定了基礎。
關鍵詞:禽致病性大腸桿菌;RyhB基因;cysE基因;生物被膜;運動性
中圖分類號:S851.3文獻標識碼:A文章編號:1000-4440(2020)05-1247-08
Abstract:Based on avian pathogenic Escherichia coli (APEC) AE17 and AE17△RyhB, gene-deleted strains AE17△cysE and AE17△RyhB△cysE were constructed using Red homologous recombination technology. The growth, biofilm formation and motion characteristics of wild and gene-deleted strains were analyzeds and qRT-PCR technology was used to compare the transcription levels of genes related to motility and biofilm formation in wild and gene-deleted strains. The results showed that there was no significant difference in the growth curve of each strain. The biofilm formation ability of AE17△RyhB, AE17△cysE, AE17△RyhB△cysE was significantly lower than that of AE17. Compared with AE17, the transcription levels of flhB, flgD, fliF and cheY in AE17△cysE and AE17△RyhB△cysE were reduced, while AE17△RyhB△cysE had enhanced gene transcription levels compared with AE17△cysE. The AE17△RyhB, AE17△cysE, AE17△RyhB△cysE and AE17 flhD, flgC and sidA were significantly reduced. The results indicated that the deletion of cysE gene reduced the ability of APEC biofilm formation and exercise, and RyhB gene had a compensatory effect on the regulation of cysE gene's exercise capacity. RyhB and cysE genes regulated the biofilm formation ability of APEC by regulating transcription level of genes(flhD, flgC and sidA) related to biofilm formation. These results of this study lay a foundation for studying the regulatory effect of RyhB-cysE gene on APEC.
Key words:avian pathogenic Escherichia coli;RyhB gene;cysE gene;biofilm;motility
禽致病性大腸桿菌(Avian pathogenic Escherichiacoli,APEC)是腸外致病性大腸桿菌,可以導致禽類出現全身性感染,嚴重影響全球養禽業。同時APEC 可以通過食源性途徑傳播給人類,是人源腸外致病性大腸桿菌毒力基因的潛在貯存宿主。加強對APEC研究,不僅有助于養禽業的發展,也具有較大的公共衛生學意義[1]。在大腸桿菌研究中,已經證明小分子RNA參與了諸多生命過程,其中包括轉錄翻譯調控、鐵代謝途徑、糖代謝途徑、膜蛋白生物合成、群體感應系統以及致病菌的致病力調節等。而RyhB作為小分子RNA,是目前已知調控的靶mRNA數目最多,其作為關鍵組成部分參與大腸桿菌諸多調控網絡,在細菌的致病過程中發揮著重要作用[2]。本試驗前期已構建AE17 △RyhB并進行Label-free蛋白組學測序及生物信息學預測,篩選出RyhB基因與RNA 伴侶 Hfq共同靶基因cysE[2]。
CysE(Serine acetyltransferase)蛋白屬于轉移酶家族的酰基轉移酶,在微生物中參與合成半胱氨酸。在代謝調控系統中,半胱氨酸主要參與抵制細胞代謝中硫化物的進入,同時半胱氨酸是一些生物元件合成途徑所必需的元素,例如甲硫氨酸、一些維生素和金屬簇等均由半胱氨酸參與合成。這個蛋白質不僅參與半胱氨酸合成反應,同時也參與蛋氨酸代謝、硫代謝等[3],對微生物的生長至關重要。
本研究利用 Red 重組技術在AE17、 AE17△RyhB的基礎上,進一步構建了基因缺失株AE17△cysE、AE17△RyhB△cysE,并比較它們的生長曲線、運動性、生物被膜形成能力等生物學特性差異,并采用qRT-PCR技術比較野生株和缺失株中與運動性、生物被膜形成相關基因的轉錄水平,為研究RyhB-cysE基因對APEC的調控作用以及揭示APEC的致病機理奠定基礎。
1材料與方法
1.1主要試驗材料
1.1.1菌種、質粒及試劑APEC AE17,為本實驗室保存的O2血清型臨床分離株;AE17△RyhB由本實驗室前期構建[4]。Red同源重組輔助質粒:pKD46(氨芐青霉素抗性)、pKD3(攜帶可被FLP重組酶識別的FRT位點,氯霉素抗性)、pCP20(42 ℃可表達FLP重組酶,用于消除FLP位點間的氯霉素抗性基因)均由安徽農業大學獸醫病理生物學與疫病防控安徽省重點實驗室保存。氯霉素、氨芐青霉素、酵母提取物、胰蛋白胨、氯化鈉、瓊脂糖、質粒小量提取純化試劑盒均購自生工生物工程(上海)股份有限公司;高保真酶Phanta Super-Fidelity DNA Polymerase、 AceQ qPCR SYBR Green Master Mix購自諾唯贊生物科技有限公司。
1.1.2引物的設計與合成根據 GenBan登錄的APEC cysE基因序列(ID:4493517),分別設計用于擴增cysE基因上游、下游序列2對引物cysE-U-F/cysE-U-R和cysE-D-F/cysE-D-R。用于擴增抗性基因的引物:cysE-cm-F/cysE-cm-R;設計的用于鑒定RyhB、cysE基因缺失株的2對引物:cysE-IN-F/cysE-IN-R、cysE-OUT-F/cysE-OUT-R、RyhB-IN-F/RyhB-IN-R、RyhB-OUT-F/RyhB-OUT-R。以上引物(表1)均由合肥通用生物科技有限公司合成。
1.2試驗方法
1.2.1AE17△cysE、AE17△RyhB△cysE構建與鑒定以AE17、AE17△RyhB為親本株,使用改良的Red重組方法[5-6]構建cysE基因缺失菌株。以提取的AE17、AE17△RyhB基因組為模板,分別使用引物cysE-U-F/cysE-U-R和cysE-D-F/cysE-D-R,通過PCR擴增cysE基因的上游和下游片段。以pKD3為模板,用引物cysE-cm-F/cysE-cm-R通過PCR擴增氯霉素抗性(Cm+)片段。以上述純化的PCR產物為模板,以cysE-U-F/cysE-D-R為引物,采用Overlap-PCR技術,PCR擴增用于cysE基因缺失的打靶片段。將構建的打靶片段電轉化至含有pKD46質粒的AE17、AE17△RyhB感受態細胞中,重組細菌在37 ℃培養1 h后涂布于含有30 μg/ml Cm+的LB平板上,孵育24 h后,挑取單克隆,用cysE-IN-F/cysE-IN-R、cysE-OUT-F/cysE-OUT-R引物PCR鑒定cysE基因缺失株,利用pCP20質粒將cysE基因缺失株氯霉素抗性消除并測序,鑒定成功的陽性重組子菌株為AE17△cysE、AE17△RyhB△cysE。
1.2.2各菌株生長曲線測定將AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE 4 株菌分別接種到LB平板,從平板上挑取單菌落接種到LB液體培養基中振蕩培養,每隔1 h測其600 nm吸光度OD600值,根據OD600值繪制上述菌株的生長曲線。上述試驗重復3次。
1.2.3各菌株生物被膜形成能力測定將AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE菌株分別培養至OD600=1.0,用LB液體按照1∶50(體積比)稀釋菌液,加入到96孔聚丙烯板中,每孔200 μl,以無菌培養基作為空白對照組,每組3個重復。28 ℃培養48 h,每孔加入200 μl PBS洗滌3遍,晾干后每孔加入200 μl 0.1%結晶紫溶液,37 ℃染色20 min,PBS 洗滌3遍,晾干,每孔加入200 μl 33%乙酸,充分溶解后,酶標儀測定每孔樣本620 nm處的吸光度 OD620值,并通過 GraphPad Prism 6 paired t檢驗分析數據。
1.2.4掃描電鏡觀察各菌株生物被膜在6孔細胞板中放入細胞爬片,分別加入2 ml含量為108CFU/ml的AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE菌液,在37 ℃培養箱中靜置培養48 h。將培養的細胞爬片取出,PBS清洗3遍,晾干,細胞爬片經過固定、脫水、干燥、黏臺、噴金處理后用掃描電鏡觀察。
1.2.5各菌株運動性測定將AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE菌株分別培養至OD600=1.0,4 000 r/min離心10 min,棄去培養基用無菌PBS緩沖液調整OD600=2.0,配制新鮮運動性培養基(每100 ml含有1.00 g蛋白胨、0.50 g氯化鈉、0.80 g葡萄糖、0.25 g瓊脂粉),待冷卻后在板的中央加入2 μl菌體,置于37 ℃培養箱靜置培養6~8 h,觀察細菌運動情況并測量菌圈大小。
1.2.6透射電鏡觀察各菌株鞭毛形態將上述4株菌分別培養至OD600=1.0,2 000 r/min離心10 min,棄去培養基并用無菌PBS緩沖液洗3次,最后用PBS重懸,吸取200 μl重懸液經負染處理后用透射電鏡觀察。
1.2.7各菌株運動性、生物被膜相關基因轉錄水平檢測參照文獻[7],選取與細菌運動性、生物被膜相關基因 fliY、 flhB、flgD、fliF、fliM、 cheY、 flhD、 flhC、sidA,16S作為內參基因,分別設計引物(表2),進行qRT-PCR檢測缺失株與野生株基因的轉錄水平差異。參照文獻[8]的方法,將上述4株菌培養至對數中前期,各取1 ml 菌液提取mRNA,利用反轉錄試劑盒反轉錄為cDNA,并以相應的cDNA為模板。反應條件為:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,40 個循環。采用2-△△Ct (Livak)法分析并計算各目的基因轉錄水平[9]。
2結果與分析
2.1AE17△cysE、AE17△RyhB△cysE的鑒定
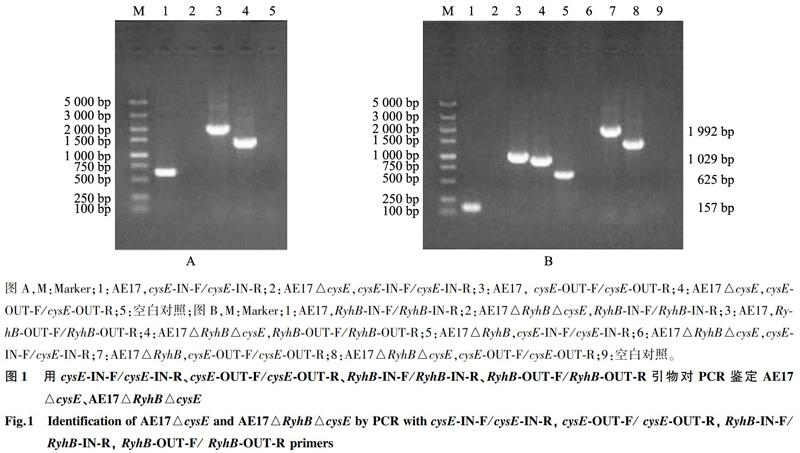
采用Red同源重組的方法構建cysE基因缺失株,通過特異性引物進行PCR鑒定。以cysE-IN-F/cysE-IN-R為引物,AE17、AE17△RyhB擴增出625 bp的cysE基因片段,cysE基因缺失株(AE17△cysE、AE17△RyhB△cysE)擴增不出目的片段(圖 1)。以cysE-OUT-F/cysE-OUT-R為引物,AE17、AE17△RyhB擴增出1 992 bp目的片段,AE17△cysE、AE17△RyhB△cysE擴增出1 303 bp目的片段(圖 1),測序結果表明AE17△cysE、AE17△RyhB△cysE構建成功。
2.2各菌株的生長曲線
各菌株生長曲線顯示,AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE均經歷0~3 h 的延滯期,在第3 h進入對數生長期,第12 h 進入穩定期。4株菌株在2 h之前沒有明顯區別;在2~3 h,AE17△RyhB、AE17△RyhB△cysE與AE17相比沒有明顯區別,AE17△cysE與AE17相比生長緩慢;在3~12 h,AE17△RyhB與AE17相比沒有明顯變化,AE17△cysE與AE17相比生長緩慢,AE17△RyhB△cysE與AE17相比在9 h后生長緩慢;在13~16 h 4株菌株之間無明顯區別(圖2)。表明RyhB基因缺失對APEC的生長速度無影響,cysE基因缺失APEC的對數期生長速度有所降低,RyhB、cysE基因共同缺失對APEC的生長速度無顯著影響。
2.3各菌株生物被膜的形成能力
用改良結晶紫半定量法檢測AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE生物被膜形成能力,結果顯示AE17△RyhB、AE17△cysE、AE17△RyhB△cysE生物被膜形成能力極顯著低于AE17(P<0.01),表明 RyhB、cysE基因缺失APEC生物被膜形成能力下降(圖3)。
掃描電鏡觀察各菌株生物被膜,結果顯示,AE17在堆狀的微菌落中,菌與菌之間絲狀物較多,而AE17△RyhB、AE17△cysE、AE17△RyhB△cysE菌與菌之間絲狀物較少;4株菌株的生物被膜的片狀結構均不明顯,但AE17依稀可見有大片片狀結構,而AE17△RyhB、AE17△cysE、AE17△RyhB△cysE幾乎看不到片狀結構的存在(圖4)。表明 RyhB、cysE基因缺失APEC導致生物被膜形成能力下降。
2.4各菌株的運動能力
各菌株運動能力的測定結果顯示:AE17△RyhB運動圈直徑與AE17相比無明顯差異,AE17△cysE運動圈直徑極顯著小于AE17(P<0.01),AE17△RyhB△cysE運動圈直徑顯著小于AE17(P<0.05),但比AE17△cysE大(圖5)。表明cysE基因缺失降低了APEC運動能力,RyhB基因缺失對cysE基因運動能力調控有代償作用。
透視電鏡觀察各細菌鞭毛數,結果顯示,AE17△cysE鞭毛數與AE17相比顯著減少,AE17△RyhB、AE17△RyhB△cysE鞭毛數與AE17相比有所減少,但比AE17△cysE多(圖6)。表明RyhB、cysE基因缺失APEC鞭毛數均有所下降,但cysE基因對APEC鞭毛數的影響大于RyhB基因,且RyhB基因缺失對cysE基因的鞭毛調節作用有代償作用。
2.5各菌株運動性、生物被膜形成相關基因的轉錄水平檢測
采用qRT-PCR對AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE 運動性相關基因轉錄水平檢測,結果顯示,AE17△cysE較AE17 fliY、 flhB 、flgD、fliF、fliM和 cheY基因轉錄水平均顯著下降,AE17△RyhB較AE17 flhB、fliF、fliY、fliD、cheY基因轉錄水平有下降趨勢,而fliM基因轉錄水平有上調趨勢;AE17△RyhB△cysE與AE17相比,其flhB 、flgD、fliF和 cheY基因轉錄水平均下降,但與AE17△cysE相比均有所增強(圖7)。表明cysE基因缺失APEC運動性相關基因轉錄水平下降,且RyhB基因缺失對cysE基因的轉錄水平有代償作用。AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE 生物被膜相關基因轉錄水平檢測結果顯示,AE17△RyhB、AE17△cysE、AE17△RyhB△cysE與AE17相比,flhD 、flhC、sidA轉錄水平均顯著降低,且轉錄水平降低幅度相近,表明RyhB、cysE基因均通過調節與生物被膜形成的相關基因flhD 、flhC、sidA轉錄水平來調控APEC生物被膜形成能力。
3討論
大腸桿菌是人及動物腸道的常在菌群,但是致病性大腸桿菌卻可以引起人及動物諸多疾病[10-12]。病原菌的致病過程體現在病原和宿主細胞相互作用的過程,對病原來說要經歷黏附、侵入、生長繁殖、抵抗宿主免疫反應、產生毒素等過程,大腸桿菌亦是如此。細菌的生物被膜狀態被認為是一種細菌適應不良環境而形成的保護模式,與浮游細胞相比,生活在生物被膜內的細菌抵抗抗生素和免疫系統的能力更強[13-14]。生物被膜通過增強細菌抗宿主免疫系統和提高在環境中的生存能力,進而能增強細菌的致病性[15]。細菌鞭毛介導的運動性和黏附性在細菌致病性中發揮重要作用[16]。研究RyhB、cysE基因對禽致病性大腸桿菌的生物被膜形成及運動性影響,可為揭示其致病機理奠定基礎。
RyhB基因缺失株AE17△RyhB與野生菌株AE17相比生長曲線無明顯變化,但cysE基因缺失APEC的對數期生長速度有所降低,而cysE、RyhB基因共同缺失時對APEC的生長速率無顯著影響,僅在生長對數期后期生長速率稍微緩慢。cysE基因單缺失時會影響APEC生長對數期的生長速率,猜測是由于基因影響細菌的代謝系統產生的,而cysE、RyhB基因共同缺失時無顯著影響,僅在生長對數期后期生長速率較慢,猜測是RyhB基因缺失對cysE基因調控的細菌代謝作用具有補償機制且該機制具有時效性,具體機制仍有待進一步研究。
用改良結晶紫半定量法檢測AE17、AE17△RyhB、AE17△cysE、AE17△RyhB△cysE生物被膜形成能力,結果顯示,AE17△RyhB、AE17△cysE、AE17△RyhB△cysE生物被膜形成能力極顯著低于AE17,且AE17△RyhB、AE17△cysE、AE17△RyhB△cysE生物被膜形成能力相似。qRT-PCR測定結果顯示,AE17△RyhB、AE17△cysE、AE17△RyhB△cysE與AE17 flhD 、flhC、sidA均顯著降低,且轉錄水平降低幅度相近。推測RyhB基因通過cysE基因調控APEC fhlD 、flhC、sidA基因的生物被膜形成能力,APEC cysE基因是RyhB基因調控生物被膜形成能力的調節靶點。flhD 、flhC、sidA均為DNA結合轉錄雙重調節因子,推測其結合下游基因的啟動子區域,從而調控細菌的生物被膜形成能力。flhD 、flhC的突變可對生物被膜形成產生促進或抑制的影響,具體取決于突變位點[17]。本試驗結果顯示,缺失cysE、RyhB基因的APEC菌株中的flhD 、flhC基因轉錄水平下調,說明APEC cysE、RyhB基因缺失菌株通過調節fhlD 、flhC基因轉錄水平從而抑制生物被膜的形成。研究結果表明,在腸致病性大腸桿菌中缺失 sdiA后,其生物被膜形成和運動性相關基因(如纖維素合成亞基 bcsA基因、鞭毛結構蛋白fliC基因及Curlin菌毛合成亞基 csgA基因)轉錄水平上調,生物被膜的形成及運動能力增強,說明sdiA對細菌的生物被膜形成具有負調控作用[18]。本試驗APEC缺失cysE、RyhB基因后sdiA基因轉錄水平下調,可能通過抑制生物被膜形成相關基因的轉錄而降低其生物被膜的形成。具體機制仍有待進一步研究。
運動性能力測定以及透射電鏡觀察細菌鞭毛結果顯示,cysE基因缺失APEC運動性顯著下降;RyhB基因缺失APEC運動性無顯著變化;RyhB、cysE雙基因缺失APEC運動性較cysE基因缺失APEC運動性增強,與野生菌株相比降低。qRT-PCR測定結果顯示,cysE基因缺失株與AE17相比,APEC運動性相關基因 fliY、 flhB 、flgD、fliF、fliM和cheY轉錄水平均顯著下降;但AE17△RyhB△cysE flhB、flgD、fliF、fliM和cheY基因的轉錄水平較AE17△cysE均有所增強,flhB是鞭毛生物合成蛋白質[19],是Ⅲ型分泌系統中與鞭毛蛋白轉運有關的蛋白質;cheY是擴散性反應調節蛋白質,可以被cheA磷酸化,能改變鞭毛的運動方向[20];fliY 是細菌鞭毛馬達開關蛋白質,在病原菌侵襲相關鞭毛運動中發揮關鍵作用[21];fliF是鞭毛基體的MS環的主要成分,將鞭毛固定在細胞質膜上;flgD與fliM構成鞭毛基體的C環,參與改變鞭毛旋轉方向[22]。推測cysE基因缺失通過下調flgD、fliF、flhB、cheY、 fliM基因轉錄水平控制鞭毛的合成及運動能力,使APEC運動性下降,RyhB基因缺失影響flgD、fliF、flhB、cheY、 fliM基因轉錄水平,對cysE基因調控菌株運動能力具有代償作用。具體機制仍有待進一步研究。
參考文獻:
[1]JOHNSON T J, WANNEMUEHLER Y, KARIYAWASAM S, et al. Prevalence of avian-pathogenic Escherichia coli strain O1 genomic islands among extraintestinal and commensal E. coli isolates[J]. J Bacteriol, 2012, 194(11): 2846-2853.
[2]張煜. 非編碼小RNA(RyhB)調控禽致病性大腸桿菌生物學表型分析及靶蛋白的篩選[D]. 合肥:安徽農業大學, 2017.
[3]NAKAMORI S, KOBAYASHI S, KOBAYASHI C, et al. Overproduction of l-Cysteine and l-Cystine by Escherichia coli Strains with a Genetically Altered Serine Acetyltransferase[J]. Appl Environ Microb,1998,64(5): 1607-1611.
[4]尹磊,祁克宗,涂健,等. 非編碼小RNA(RyhB)調控禽致病性大腸桿菌毒力相關基因的分析[J]. 畜牧獸醫學報, 2015, 46(8): 1409-1416.
[5]DATSENKO K A . One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J]. Proc Natl Acad Sci USA, 2000, 97(12):6640-6645.
[6]王棟,王少輝,孟慶美,等. 禽致病性大腸桿菌Ⅵ型分泌系統2 evfC 基因缺失株的構建及其生物學特性分析[J]. 中國動物傳染病學報, 2016, 24(3): 21-26.
[7]NI B, GHOSH B, PALDY F S, COLIN R, et al. Evolutionary remodeling of bacterial motility checkpoint control[J]. Cell Rep, 2017, 18(4): 866–877.
[8]O′NEILL J, ROUJEINIKOVA A. Cloning, purification and crystallization of MotB, a stator component of the proton-driven bacterial flagellar motor[J]. Acta Crystallogr F, 2008, 64(6): 561-563.
[9] SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative C(T) method[J]. Nat Protoc, 2008, 3(6): 1101-1108.
[10]張 謙,劉一塵,徐進,等. 加味白頭翁散發酵產物對肉仔雞大腸桿菌病的防治效果及對其腸道菌群的影響[J].江蘇農業科學,2018,46(21):177-180.
[11]李軍,馮世文,曾蕓,等. 大腸桿菌O157∶H7氟苯尼考耐藥菌株與敏感菌株的蛋白組學差異[J].南方農業學報,2019,50(4):875-882.
[12]畢志香,朱亞露,趙陽,等. 山東省某地區肉雞H9亞型禽流感與大腸桿菌混合感染的診治[J].江蘇農業科學,2018,46(3):163-165.
[13]HIBY N, BJARNSHOLT T, GIVSKOV M, et al. Antibiotic resistance of bacterial biofilms[J]. Int J Antimicro Agents, 2010, 35(4): 322-332.
[14]COSTERTON J W, STEWART P S, GREENBERG E P. Bacterial biofilms: a common cause of persistent infections[J]. Science, 1999, 284(5418): 1318-1322.
[15]WOOD T K, GONZLEZ BARRIOS A F, HERZBERG M, et al. Motility influences biofilm architecture in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2006, 72(2): 361-367.
[16]HAIKO J, WESTERLUND-WIKSTRM Z B. The role of the bacterial flagellum in adhesion and virulence[J]. Biol, 2013, 2(4): 1242-1267.
[17]SHELLEY M H, JOSEPH S, NICHOLAS S, et al. Spontaneous mutations in the flhD operon generate motility heterogeneity in Escherichia coli biofilm[J]. BioMed Central, 2016, 16(1):1-13.
[18]HEBERT C, SAMUEL C, JULIANA H, et al. Role of SdiA on Biofilm Formation by Atypical Enteropathogenic Escherichia coli[J]. Pubmed, 2018, 9(5): 253.
[19]MINAMINO T, INOUE Y, KINOSHITA Miki, et al. FliK-Driven conformational rearrangements of FlhA and FlhB are required for export switching of the flagellar protein export apparatus[J]. Pubmed, 2020, 202(3): e00637.
[20]QUAX TESSA E F, ALTEGORR F, ROSSI F, et al. Structure and function of the archaeal response regulator CheY[J]. Proc Natl Acad Sci USA, 2018, 115(6): 1259-1268.
[21]LAM K H, CHAOLUN X, KAILEI S, et al. Three SpoA-domain proteins interact in the creation of the flagellar type III secretion system in Helicobacter pylori[J]. J Biol Chem, 2018, 293(36): 13961-13973.
[22]田延,丁雪燕,岑雪,等. 大腸桿菌鞭毛研究進展[J]. 中國預防獸醫學報, 2019, 41(6): 649-653.
(責任編輯:陳海霞)

