基于轉錄組序列的羊肚菌EST-SSR標記開發與遺傳多樣性分析
馬杰 屈雯 陳春艷 王磊 馬維 劉針杉 馬俊 楊珊 丁麗 高強 孫勃


摘要:利用羊肚菌(Morchella spp.)轉錄組數據開發EST-SSR(表達序列標簽-簡單重復序列)標記,并對33份羊肚菌材料進行遺傳多樣性分析。結果表明,轉錄組測序共獲得73 781條Unigene序列,其中25 461條Unigene序列中含有41 814個簡單重復序列(Simple sequence repeats, SSR)位點,SSR位點發生頻率為34.51%,平均分布距離為2.51 kb。優勢重復序列類型為單核苷酸,占總SSR位點數量的51.39%,其次為三核苷酸和二核苷酸,分別占總SSR位點數量的28.04%和13.35%。A/T、AG/TC、AGC/TCG分別是單核苷酸、二核苷酸、三核苷酸的優勢重復基元。以33份羊肚菌和1份酵母菌為材料,從61對SSR引物中篩選出15對多態性引物,經擴增得到130條多態性條帶,多態性比例為100%。遺傳多樣性分析結果顯示,平均每個位點的等位基因數(Na)為4.866 7個,平均有效等位基因數(Ne)為2.124 2個,平均多樣性指數(I)為0.958 3,平均觀察雜合度(Ho)為0.191 1,平均期望雜合度(He)為0.495 1,平均Neis基因多樣性指數為0.483 5,表明篩選出的15對SSR引物的擴增產物具有較好的遺傳多樣性。通過非加權組平均法(Unweighted pair-group method with arithmetic means, UPGMA)聚類分析,可將33份羊肚菌材料分為4類。試驗結果可為羊肚菌的種質資源鑒定、品種鑒別和分子標記輔助育種等研究提供依據。
關鍵詞:羊肚菌;分子標記;EST-SSR;轉錄組;遺傳多樣性
中圖分類號:S646.701文獻標識碼:A文章編號:1000-4440(2020)05-1282-09
Abstract:Expressed sequence tag-simple sequence repeat (EST-SSR) markers were developed using transcriptome data of Morchella spp., and the genetic diversities of 33 varieties of Morchella spp. were analyzed. The results showed that a total of 73 781 Unigene sequences were obtained using transcriptome sequencing. There were 41 814 simple sequence repeats (SSR) loci in 25 461 Unigene sequences, the occurrence frequency of SSR locus was 34.51%, the average distribution distance was 2.51 kb. Single nucleotide was the advantage repetitive sequence type, which accounted for 51.39% of the total SSR loci, followed by tri-nucleotides and di-nucleotides, which accounted for 28.04% and 13.35%, respectively. A/T, AG/TC, AGC/TCG were the predominant repetitive motifs in single nucleotides, di-nucleotides, tri-nucleotides, respectively. 15 pairs of polymorphic primers were selected from 61 pairs of SSR primers, using 33 varieties of Morchella spp. and one variety of yeast as material. 130 polymorphic bands were obtained through amplification, with a polymorphic rate of 100%. Results of genetic diversity analysis showed that the average number of alleles (Na) was 4.866 7, the average number of effective alleles (Ne) was 2.124 2, the average diversity index (I) was 0.958 3, the average observed heterozygosity (Ho) was 0.191 1, the average expected heterozygosity (He) was 0.495 1, and the average Neis gene diversity index was 0.483 5, indicating that the amplified products of the selected 15 pairs of SSR primers had a good genetic diversity. 33 varieties of Morchella spp. could be divided into four groups by unweighted pair-group method with arithmetic means (UPGMA) cluster analysis. The results can provide basis for germplasm resources identification, variety identification and molecular marker assisted breeding of Morchella spp.
Key words:Morchella spp.;molecular marker;expressed sequence tag-simple sequence repeats (EST-SSR);transcriptome;genetic diversity
羊肚菌(Morchella spp.)屬于子囊菌門(Ascomycata),盤菌綱(Pezizomycetes),盤菌目(Pezizales),羊肚菌科(Morchellaceae),羊肚菌屬(Morchella),由于其菌蓋表面凹凸不平,形如羊肚,故名羊肚菌[1]。羊肚菌肉質脆嫩、風味獨特、味道鮮美、營養豐富[2],在全球范圍內主要分布在法國、德國、美國、印度、中國等地,在中國主要分布在中西部地區,如貴州、云南、四川等地。
簡單重復序列(Simple sequence repeat, SSR),又稱微衛星DNA(Microsatellite DNA),是一類由16個堿基組成的基序串聯重復而成的DNA序列[3]。SSR因具有共顯性、數量豐富、多態性高、重復性好、易檢測、操作簡單等優點[4]而被廣泛應用于植物遺傳多樣性分析[5]、遺傳圖譜構建[6]及親緣關系研究[7]等領域。根據SSR的來源不同,可以將其分為基因組SSR和EST(Expressed sequence tag,EST,表達序列標簽)-SSR兩大類型,與基因組SSR標記相比,由于EST-SSR是基于EST序列開發的,來源于表達的基因組區域,可以直接反映相關基因的多樣性,因而在不同物種之間具有良好的通用性[8-10]。此外,由于轉錄組序列多集中在功能基因上,因此基于轉錄組數據開發的SSR標記有利于后期與重要農藝性狀進行關聯分析,從而為分子標記輔助育種節約時間和成本。
目前,EST-SSR在蔬菜[7]、果樹[11]、花卉[12]等許多植物中都有應用,但尚未見將其應用于羊肚菌的相關報道。本研究利用轉錄組數據開發出羊肚菌EST-SSR標記,并對其多樣性進行分析,旨在篩選適合羊肚菌SSR標記分析的核心引物,為羊肚菌種質資源遺傳多樣性評價和親緣關系分析提供引物。
1材料與方法
1.1試驗材料
本試驗采集了33份羊肚菌材料和1份酵母菌材料作為提取DNA模板的原材料,材料的相關信息見表1。
1.2試驗方法
1.2.1轉錄組測序采集不同品種羊肚菌的各組織,進行等量混合后送至北京諾禾致源公司進行轉錄組測序。
1.2.2基因組DNA的提取采集各個材料樣品,用液氮冷凍后研磨,采用改良的十六烷基三甲基溴化銨(CTAB)法提取樣品的基因組DNA[13],并于-20 ℃儲存備用,用1.0%瓊脂糖凝膠電泳檢測DNA的質量。
1.2.3引物設計與合成采用MISA軟件(http://pgrc.ipk-gatersleben.de/misa/misa.html)對羊肚菌轉錄組的Unigene基因進行搜索。分別設定單核苷酸、二核苷酸、三核苷酸、四核苷酸、五核苷酸、六核苷酸的最少重復搜索次數為10次、6次、5次、5次、5次、5次。用Primer 3進行引物設計,引物序列長度為18~27 bp,預計擴增產物長度為100~300 bp,G+C含量為40%~60%,退火溫度為54~61 ℃。隨機挑選出設計的61對引物送至生工生物工程(上海)股份有限責任公司進行合成。
1.2.4PCR擴增及檢測20 μl PCR反應體系如下:1 μl DNA模板,10 μl 2×EasyTaq PCR SuperMix for PAGE,各1 μl上游、下游引物,用去離子水補足體積至20 μl。PCR反應擴增條件如下:95 ℃預變性 2 min;98 ℃變性10 s,49~54 ℃退火30 s,72 ℃延伸15 s,32個循環;72 ℃延伸10 min。初篩用1.5%瓊脂糖凝膠電泳進行檢測,復篩用8%非變性聚丙烯酰胺凝膠電泳進行檢測。
1.2.5數據統計采用人工讀帶的方法,將聚丙烯酰胺凝膠電泳圖上可重復的清晰條帶的記為“1”,在同一位置條帶較弱或無條帶的記為“0”,由此建立原始數據矩陣。用POPGENE 1.31和PIC-CALC軟件進行SSR位點的遺傳多樣性分析,用NTSYS-PC 1.0軟件進行供試材料的聚類分析。
2結果與分析
2.1羊肚菌轉錄組中SSR位點的分布及特點
通過對羊肚菌的73 781條Unigene序列(總長度約為104 910 kb)進行搜索發現,在25 461條Unigene序列中含有41 814個SSR位點,其中7 306條Unigene含有2個或2個以上SSR位點。整體上看,SSR位點的發生頻率為34.51%,即平均每2.51 kb出現1個SSR。單核苷酸重復是主要類型,占總SSR位點數的51.39%;其次是二核苷酸重復、三核苷酸重復,分別占總SSR位點數的13.35%、28.04%;四核苷酸重復、五核苷酸重復和六核苷酸重復類型數量較少,分別占總SSR位點數的4.56%、1.10%和1.56%。在所有SSR位點中,重復10次的SSR位點數最多,共有6 658個,占總數的15.92%;重復5次的SSR位點數次之,共有6 396個,占總數的15.30%;重復6次的SSR位點共有5 426個,占總數的12.98%(表2)。
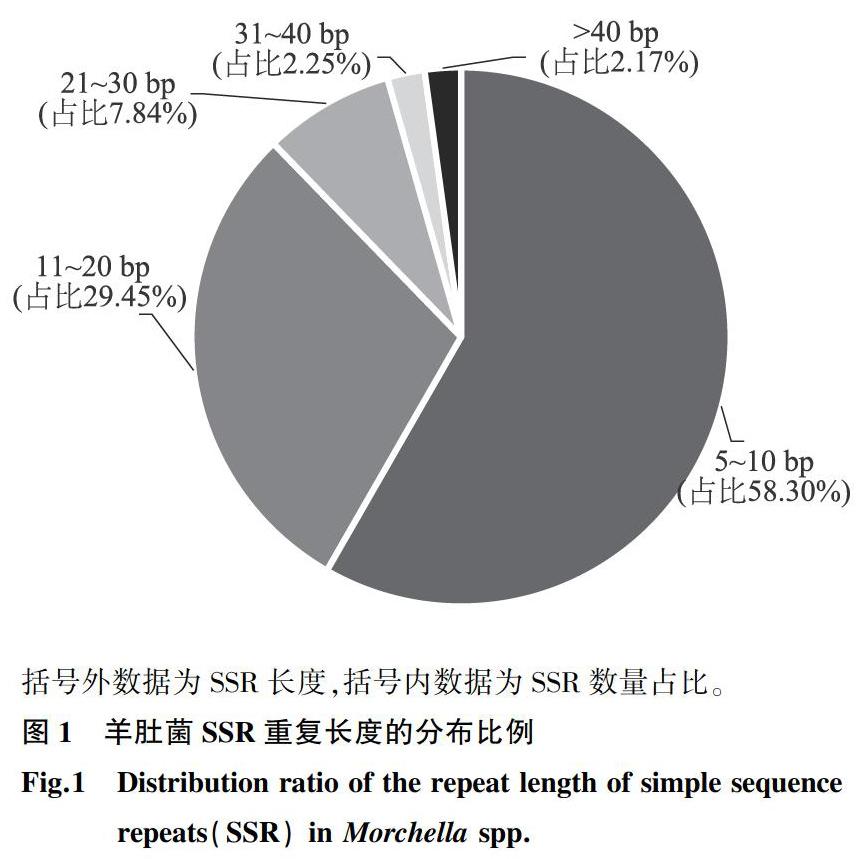
羊肚菌的平均SSR位點長度為18.63 bp,其中六核苷酸重復序列的平均長度最長,達到38.94 bp。羊肚菌的SSR長度范圍為5~114 bp,其中長度為5~10 bp的重復序列數最多,共有24 377個,占總SSR位點數的58.30%;長度為11~20 bp的重復序列數次之,共有12 313個,占總SSR位點數的29.45%;長度大于40 bp的重復序列數最少,僅占總SSR位點數的2.17%(圖1)。
在本試驗中,利用15對SSR引物對來自7個省份的33份羊肚菌材料和1份酵母菌材料進行PCR擴增,結果表明,擴增條帶的多態性比例為100.0%,高于黑木耳(95.5%)[24]、野生香菇(95.9%)[25]、真姬菇(81.2%)[26]。15對SSR引物擴增產物的遺傳多樣性分析結果表明,這些羊肚菌材料具有豐富的遺傳多樣性。徐銳[25]利用34對高多態性引物對94個香菇菌株進行遺傳多樣性分析,結果表明,I、Ho、PIC的平均值分別是0.89、0.24、0.40。張躍新等[24]研究發現,黑木耳SSR標記的平均PIC、I分別為0.216、0.455,這些結果都略低于本試驗結果,表明本試驗開發的羊肚菌的SSR多態性較好。一些真菌的遺傳多樣性高于本試驗結果,如灰樹花的平均PIC為0.52[15],金針菇的平均PIC為0.801 9[21],這些現象可能與物種的差異有關。本研究通過對33份羊肚菌材料進行聚類分析,結果共分為4大類,來自貴州畢節的11個材料在這4類中均有分布,說明這些來自貴州畢節的羊肚菌材料受所在地區羊肚菌基因滲透的影響較小。而來自云南昆明、貴州貴陽和四川成都的大部分材料都各自聚類在同一小組,說明這些材料在區域內沒有發生明顯的遺傳分化,由此表明聚類分析結果與地理位置有一定關系。
4結論
本研究基于轉錄組數據成功開發了羊肚菌SSR位點,共篩選獲得15對核心引物,并將其成功應用于33個羊肚菌的遺傳多樣性和聚類分析中。研究結果豐富了羊肚菌EST-SSR標記引物庫,為今后羊肚菌的種質資源鑒定、物種鑒別、分子標記輔助育種、親緣關系分析等研究提供了引物支持和實踐參考。
參考文獻:
[1]謝占玲,謝占青. 羊肚菌研究綜述[J].青海大學學報(自然科學版), 2007,25(2):36-40.
[2]倪淑君,張海峰. 我國羊肚菌的產業發展[J].北方園藝, 2019(2): 165-167.
[3]楊夢婷,黃洲,干建平,等. SSR分子標記的研究進展[J].杭州師范大學學報(自然科學版), 2019, 18(4): 429-436.
[4]GARCIA-LOR A, CURK F, SNOUSSI-TRIFA H, et al. A nuclear phylogenetic analysis: SNPs, indels and SSRs deliver new insights into the relationships in the ‘true citrus fruit trees group (Citrinae, Rutaceae) and the origin of cultivated species[J].Annals of Botany,2013,111(1): 1-19.
[5]蘇一鈞,王嬌,霍愷森,等.甘薯引進種SSR遺傳多樣性分析[J]. 江蘇農業學報, 2018, 34(5):984-997.
[6]BHATTACHARJEE M, PRAKASH S H, ROY S, et al. SSR-based DNA fingerprinting of 18 elite Indian varieties of sesame (Sesamum indicum L.)[J]. Nucleus, 2020, 63(1): 67-73.
[7]林琿,薛珠政,裘波音,等. SSR標記在茄子雜交種純度檢驗中的應用[J/OL].分子植物育種,2020. http://kns.cnki.net/kcms/detail/46.1068.S.20200310.1700.006.html.
[8]王玲玲,陳東亮,黃叢林,等. SSR分子標記技術在植物研究中的應用[J].安徽農業科學,2017,45(36):123-126,130.
[9]POWELL W, MACHRAY G C, PROVAN J. Polymorphism revealed by simple sequence repeats[J].Trends in Plant Science,1996,1(7):215-222.
[10]SCOTT KD, EGGLER P, SEATON G, et al. Analysis of SSRs derived from grape ESTs[J]. Theoretical and Applied Genetics, 2000,100(5): 723-726.
[11]文舜,陳秀萍,鄭少泉.龍眼EST-SSR標記開發及無患子科5個屬種質遺傳多樣性分析[J].園藝學報,2019, 46(7): 1359-1372.
[12]賀? 丹,吳芳芳,張佼蕊,等.牡丹轉錄組SSR信息分析及其分子標記開發[J].江蘇農業學報,2019,35(6):1428-1433.
[13]孫立夫,張艷華,裴克全. 一種高效提取真菌總DNA的方法[J]. 菌物學報, 2009, 28(2): 299-302.
[14]李明衛. 大型真菌黑松露EST-SSR信息分析[D]. 臨安: 浙江農林大學, 2012.
[15]楊楊. 灰樹花EST-SSR引物開發及遺傳多樣性研究[D]. 長春: 吉林農業大學, 2016.
[16]李強,陳誠,熊川,等.杏鮑菇轉錄組數據SSR位點的生物信息學分析[J]. 應用與環境生物學報, 2017, 23(3): 454-458.
[17]孟清,謝占玲,戴大日,等.青海小海綿羊肚菌M12-10轉錄組SSR信息分析及其分子標記開發[J].青海大學學報, 2019, 37(6): 1-10.
[18]劉偉,蔡英麗,何培新. 粗柄羊肚菌轉錄組的SSR分布和序列特征分析[J].輕工學報, 2017, 32(2): 33-39.
[19]魯鐵. 蒙古白麗蘑的遺傳多樣性及其保育學研究[D]. 長春: 吉林農業大學, 2018.
[20]萬志兵,王小龍,管宏偉,等. 楊樹銹菌表達序列微衛星分析及EST-SSR標記開發[J].東北林業大學學報, 2012, 40(6): 76-80.
[21]金群力,沈穎越,蔡為明,等. 金針菇基因組SSR位點分析及標記開發[J].食用菌學報,2016,23(2): 12-19.
[22]王瑩,陳明杰,汪虹,等. 美味牛肝菌全基因組SSR位點的分布規律研究[J].菌物學報, 2015,34(2): 204-214.
[23]徐凱,張勁松,唐傳紅,等. 靈芝基因組SSR位點分布與分析[J].上海農業學報, 2014, 30(5): 32-37.
[24]張躍新,胡偉,郝藝銘,等. 北方地區黑木耳部分主栽品種與野生菌株遺傳多樣性SSR分析[J].中國食用菌, 2019, 38(5): 44-48.
[25]徐銳. 野生香菇數量性狀與SSR分子標記的關聯分析[D].武漢: 華中農業大學, 2013.
[26]董巖,陳輝,趙明文,等. 真姬菇栽培菌株的ITS和SSR分析[J].上海農業學報, 2009, 25(3): 59-64.
(責任編輯:徐艷)

