鹽湖鹵水中鋰的分離提取研究進展
吳 靜,任秀蓮,魏琦峰
[哈爾濱工業(yè)大學(威海)海洋科學與技術(shù)學院,山東威海264200]
隨著有色金屬的快速發(fā)展, 有色金屬逐漸發(fā)展成為一把衡量國家經(jīng)濟實力水平的標尺[1]。 其中最輕的金屬元素鋰,因其廣泛應用于軍工、航空航天、醫(yī)藥、鋰電池等行業(yè)被譽為“推動世界前進的金屬”。此外,自移動式電動工具、便攜式電子設(shè)備、電動自行車尤其是電動汽車日益普及后, 鋰離子電池因其卓越的儲存性能引起了大家的關(guān)注。 與傳統(tǒng)的鉛酸電池、鎳鎘電池和鎳氫電池相比,鋰電池體積小、容量大、循環(huán)時間長,更適用于新技術(shù)和新能源汽車等行業(yè)[2]。 伴隨著新能源技術(shù)對鋰離子電池消費量的快速增長[3],鋰的需求量也隨之高速增長,這種趨勢對全球鋰資源的供應、高純鋰產(chǎn)品的開發(fā)及低成本鋰的提取方法都提出了新的要求。
1 鹵水提鋰方法
全球鋰資源總量中鹵水鋰和礦石鋰分別占62.6%和37.4%。中國鋰資源總量占全球鋰資源總量的10.4%,其中鹵水鋰資源總量占全球鹵水鋰資源總量的12.0%,占中國鋰資源總量的71.9%[4]。 含鋰鹵水資源豐富,而且鹵水提鋰工藝簡單、能耗低、成本低,具有良好的應用前景。 鹽湖鹵水提鋰技術(shù)歸納起來主要有沉淀法、萃取法、離子交換吸附法、碳化法、煅燒浸取法和許氏法等[5]。 近年來萃取法、吸附法、膜法成為研究的熱點。 筆者將重點闡述鹵水提鋰最新研究進展。
1.1 溶劑萃取法
溶劑萃取法的基本原理是利用物質(zhì)在兩種互不相溶的溶劑中溶解度或分配系數(shù)的不同使某種特定的化合物從一種溶劑內(nèi)轉(zhuǎn)移到另外一種溶劑中[6-7]。20世紀60年代美國鋰公司Nelli 等[8]首次公開使用FeCl3作為協(xié)萃劑,使用中性萃取劑共同萃取鐵絡(luò)酸鹽如LiFeCl4、NaFeCl4、Ca(FeCl4)2、Mg(FeCl4)2等,并在這之后形成了一系列相同原理的萃取流程。 目前使用萃取法提鋰的研究中,大多仍使用含F(xiàn)eCl3的萃取體系,主要致力于探索合成不同的萃取劑來提高萃取效率。 在萃取法提鋰實驗中, 由于FeCl3性質(zhì)特殊,所以在萃取過程中需要對水相酸度進行控制。 另外萃取工藝中的萃取、洗滌、反萃、再生等環(huán)節(jié)對于萃取劑的選擇性、揮發(fā)性、腐蝕性、可循環(huán)利用性等都有較高的要求,探究并合成出滿足以上所有要求的綠色萃取劑成為萃取法提鋰的重點。
中國科學院青海鹽湖研究所時東等設(shè)計合成了不同結(jié)構(gòu)的磷酸酯和酰胺類萃取劑[9-10]。 其中N523-磺化煤油萃取體系中, 當N523體積分數(shù)≤50%、鐵鋰物質(zhì)的量比≤1.3、鹵水酸度≥0.10mol/L時,鋰的萃取率達到74.94%。三級逆流萃取后,鋰的萃取率≥96%, 鋰與鈉、 鉀、 鎂的分離因數(shù)分別為402.5、126.3、9907.7。 該體系雖在高鎂鋰比的鹽湖鹵水中萃取鋰有較好的萃取和分離效果,但是分相時間較長,在產(chǎn)業(yè)化推廣和應用方面受限。
后來李麗娟等[11]將N523-磺化煤油萃取體系進行改進,加入TBP(磷酸三丁酯)作為新協(xié)萃劑。在相比(O/A,有機相與水相的體積比)為2/1、Fe 與Li 物質(zhì)的量比為1.3、鹵水酸度≤0.05mol/L 條件下,串級實驗后鋰的萃取率≥99%,Li+與Mg2+、Na+、K+、B2O3的分離因數(shù)分別為βLi/Mg=87720、βLi/Na=3937、βLi/K=4830、βLi/B=116。 改進后此工藝已運用到工業(yè)化生產(chǎn)中。 目前,建成了西臺吉乃爾鹽湖鹵水年產(chǎn)500t 氯化鋰的中試示范線,鋰萃取率>94%,氯化鋰純度>99.9%。
該萃取體系適用于從鋰含量不同的鹵水中萃取鋰, 與現(xiàn)有高鎂鋰比鹽湖鹵水提鋰方法相比具有適用范圍廣、工藝流程簡單、鋰硼回收率高、成本低、經(jīng)濟技術(shù)指標優(yōu)異等特點。 但是仍然無法完全避免TBP 的使用所帶來的設(shè)備腐蝕以及長期運行后TBP的降解問題。
北京大學Zhou[12]等提出了以TBP 為萃取劑、FeCl3為協(xié)萃劑、琥珀酸二乙酯為稀釋劑,從高鎂鋰比模擬鹽湖鹵水中提取鋰離子的新工藝。 洗滌時創(chuàng)新性地將MgCl2作為氯源,防止Fe3+流失。 以Mg(OH)2和MgCO3為再生劑對有機相進行再生。 在TBP 體積分數(shù)為30%、Fe3+與Li+物質(zhì)的量比為1.3∶1、 相比(O/A)為1∶1時,鋰的單級萃取率達到65.53%,分離因數(shù)βLi+/Mg2+、βLi+/Na+、βLi+/K+分別為347.38、29.10、202.02。 以HCl 和MgCl2為反萃劑,在相比(O/A)為20、總Cl-濃度為7.2mol/L、H+濃度為0.6564mol/L 洗滌條件下,Li+、Mg2+、Na+、K+的反萃率分別為11.44%、90.78%、48.15%、90.27%。 大部分Mg2+和K+被洗掉,而Li+大部分保留在有機相中。 此萃取體系的優(yōu)點在于選用極性高、閃點大、水溶性低的琥珀酸二乙酯作為稀釋劑,有效避免了使用TBP 造成萃取過程產(chǎn)生的第三相。 同時提出了在不影響萃取性能的前提下利用一系列鎂化合物作為氯化物源和再生劑的新思路,并且有機相重復使用10次后鋰的萃取率仍保持在53%左右,具有良好的穩(wěn)定性和重復使用性。
綜上所述,近年來使用萃取法提鋰大部分萃取體系仍使用TBP。 Yang 等[13]設(shè)計了以離子液體1-羥乙基-3-甲基咪唑雙(三氟甲基磺酰基)酰亞胺(OHEMIMNTf2)和中性配體三烷基氧化膦(Cyanex 923)為萃取劑,以O(shè)HEMIMNTf2-Cyanex923為萃取體系從堿性鹵水中提取鋰的萃取工藝。 在最佳條件下鋰的單級萃取率達到93%以上。 此方法在堿性鹵水提鋰方面具有重大意義,具有良好的應用前景。
由于溶劑萃取法能夠有效分離堿金屬和堿土金屬,是以鹵水為原料提鋰中較為有效、成本較低、能耗較少、工藝簡單、綠色環(huán)保的一種提鋰方法,具有很好的工業(yè)應用前景,近年來針對已有的TBP-FeCl3體系所存在的弊端, 研究者們嘗試使用離子液體代替?zhèn)鹘y(tǒng)萃取體系、 或改變萃取水相進行堿性鹵水或氨溶液的萃取,或使用新型再生劑反萃劑等,但目前仍在實驗階段,未投入工業(yè)大量生產(chǎn)。
1.2 沉淀法
沉淀法是指通過化學反應將目標離子轉(zhuǎn)化為難溶物以沉淀的形式從溶液中分離出來。 常見方法是將鹵水自然蒸發(fā)使鋰含量濃縮至一定濃度, 然后經(jīng)酸化或萃取除硼、除鈣鎂離子,最后加入純堿使鋰以Li2CO3的形式沉淀出來。 根據(jù)沉淀離子的不同沉淀方式大概可分為兩類:伴生離子(鎂離子、鈣離子、硼和硫酸根等)沉淀提鋰工藝和鋰目標離子鋁鹽沉淀提鋰工藝。前者是利用共沉淀法除去其他金屬離子,后者是僅沉淀Li+,其中以碳酸鹽沉淀法和鋁鹽沉淀法為主[14-15]。
沉淀法是鹵水提鋰工業(yè)中使用較早、 工藝較為成熟的方法。 其中碳酸鹽沉淀法是現(xiàn)階段較為成熟的工藝,已經(jīng)應用于工業(yè)生產(chǎn)。但是其弊端也日益突出,如工藝流程長導致工藝步驟繁瑣、溶劑耗損量較多導致成本突增、供不應求等問題都急需改進[16]。
1.3 納濾膜與電滲析法
納濾是一種以壓力差為推動力的膜分離過程,在膜兩側(cè)施加一定的壓力差可使一部分溶劑及小于膜孔徑的組分透過膜,大于膜孔徑的微粒、大分子、鹽等被膜截留下來而實現(xiàn)分離的目的。 此外, 由于Donnan 效應納濾膜對不同價態(tài)的離子具有不同的選擇性, 對二價和多價離子的截留率要比一價離子高, 從而可以應用于鹽湖鹵水中鎂離子與鋰離子的分離[17]。
Pramanik 等[18]采用納濾(NF)與膜蒸餾相結(jié)合的方法比較了兩種納濾膜NF90和NF270在不同條件下對Li+和Mg2+的選擇性。 經(jīng)NF90處理后鹵水中的Mg、Li 物質(zhì)的量比從10降至0.19,Li+回收率達到23%。 經(jīng)NF270處理后Mg、Li 物質(zhì)的量比從10將至2.1,Li+回收率達到44%。
Li 等[19]首次合成了表層帶正電(PA-B)的復合納濾膜,該復合納濾膜由聚乙烯亞胺(BPEI)和均苯三甲酰氯(TMC)在交聯(lián)聚醚酰亞胺載體上通過界面聚合而成,同時加入乙二胺四乙酸(EDTA)對帶正電的PA-B NF 膜進行改性。 結(jié)果證明, 經(jīng)EDTA 修飾后,Mg2+與Li+質(zhì)量比為24時,鎂鋰的分離因數(shù)(βLi/Mg)能夠達到9.2, 且膜分離36h 后納濾膜仍具有良好的穩(wěn)定性。
電滲析法是利用離子交換膜在電場的作用下強行將離子向電極處吸引, 使電極中部的離子濃度大為下降的方法。 對離子交換膜的研究逐漸大量應用于Li+與Mg2+的分離,配有單價選擇性離子交換膜的電滲析系統(tǒng)可分離濃縮高鎂鋰比鹵水后得到富鋰鹵水[20]。
Ji 等[21]研究發(fā)現(xiàn)使用選擇電滲析法(S-ED)從高鎂鋰比鹵水提鋰的實驗中, 當外加電壓為6V 時鋰的萃取效果較好,但鎂鋰分離因數(shù)較低。另外鎂鋰分離因數(shù)(βMg/Li)受陽離子(Na+、K+)濃度的影響,隨著Na+與Li+物質(zhì)的量比、K+與Li+物質(zhì)的量比從1提高到5,βMg/Li分別從8.73降至1.83、從8.33降到2.13。研究還發(fā)現(xiàn)HCO3-濃度變化對βMg/Li的影響、 變化趨勢與鋰回收率相反,可能與MgHCO3+的出現(xiàn)有關(guān)。以上實驗結(jié)論證明,S-ED 對高鎂鋰比鹵水中分離鎂鋰離子具有廣泛的適用性。
Qiu 等[22]采用選擇性電滲析(S-ED)和雙極膜選擇性電滲析(BMS-ED)法從高鎂鋰比鹵水中提鋰。實驗研究了單價選擇性陽離子交換膜(CIMS、CSO)與單價選擇性陰 離 子交換 膜(ACS、ASV)。 其中CIMS/ACS 膜堆對于Mg2+和Ca2+的分離效果要優(yōu)于CSO/ASV 膜堆, 當電流密度低于12mA/cm2時能夠有效避免膜結(jié)垢。電流密度為6mA/cm2時,LiOH 濃度與電流效率達到最佳。 另外, 實驗采用BMS-ED法對不同陽離子交換膜(CIMS、CSO 和CMX)和陰離子交換膜(ACS、ASV 和AMX)進行評估。與FBM(雙極膜)/ASV/CSO/FBM 膜堆和FBM/AMX/CMX/FBM膜堆作比較時,F(xiàn)BM/ACS/CIMS/FBM 膜堆表現(xiàn)出優(yōu)異的電流效率以及對Mg2+、Ca2+良好的分離能力。
Liu 等[23]提出了以常溫離子液體為鋰離子載體,采用液膜電滲析法從高鎂鋰比鹵水中提取鋰。其中以C4mimTFSI 體系為液膜時Li+遷移速率最高。當電 流 密 度 為4.375A/m2時,Mg、Li 質(zhì) 量 比 從 最 初輸入時的50∶1下降到輸出時的0.5∶1。對于西臺吉乃爾鹽湖體系,初始鹵水Mg、Li 質(zhì)量比從53∶1下降到0.26∶1,鹵水中的K+和Ca2+幾乎完全被液膜截留不進入。 該方法適用于低鈉高鎂鋰比鹵水的處理。
1.4 電化學法
電化學法是指通過控制鋰離子電池電位來實現(xiàn)Li+的嵌入/脫出,相關(guān)研究人員提出了使用不同吸附材料作為電極, 利用電場控制Li+在材料中嵌入/脫出的電化學吸附法[24]。
Zhao 等[25]以LiNi0.03Mo0.01Mn1.96O4(LNMMO)為陰極材料,研制了連續(xù)流控混合式超級電容器(CFLNMMO/AC)。 該裝置在模擬鹽水中每循環(huán)一次(以Li+計)僅消耗7.91W·h/mol,同時Li+提取率可達14.4mg/g。 優(yōu)化操作條件后,模擬鹵水中Li+提取率達到97.2%。
He 等[26]根據(jù)搖椅式鋰離子電池工作原理,以LiFePO4為正極材料構(gòu)建了新型鋰離子電池體系LiFePO4|NaCl 溶 液|陰 離 子 交 換 膜|鹵 水|FePO4從 鹵水中提取鋰。最終鋰的提取率為83%,鹵水的Mg、Li質(zhì)量比從最初的134.4降至1.2。 萃取鹽湖老鹵時從最初的Mg、Li 質(zhì)量比為48.4降至0.5,陽極電解液中鋰的質(zhì)量濃度約為初始值的6倍(從最初的0.51g/L上升到3.2g/L)。
Wang 等[27]用真空過濾法制備了新型鋰離子分離復合膜萃取低濃度的鋰溶液。該膜由H1.6Mn1.6O4納米顆粒和還原氧化石墨烯(rGO)組成。 通過電化學控制離子交換(ESIX)技術(shù),吸附平衡5h后H1.6Mn1.6O4/rGO 復合膜上鋰離子吸附量達到38.78mg/g,5次循環(huán)后膜對鋰離子的吸附能力與初始值相比仍保持在99%的平均通量,當初始n(Li+)/n(Na+)和n(Li+)/n(Mg2+)為1∶1時,Li/Na、Li/Mg 的選擇系數(shù)分別達到10.39、10.23。
與傳統(tǒng)的太陽能蒸發(fā)法提取鋰相比, 電化學法提鋰具有效率高、選擇性好、環(huán)境污染小等優(yōu)點。 隨著納米材料和新型儲能技術(shù)研究的快速發(fā)展, 電化學法提鋰效率得到了顯著提高。 近年來電化學法提鋰研究進展迅猛, 相信在未來會具有一定的競爭力和良好的發(fā)展前景。
1.5 吸附法
吸附法是指使用特定的吸附劑, 經(jīng)吸附和洗脫兩步將Li+從鹵水中提取出來。吸附法多適用于從高鎂鋰比鹵水中提取鋰。根據(jù)吸附劑的性質(zhì),離子交換劑可分為層狀吸附劑、銻酸鹽吸附劑、鋁基吸附劑、離子篩型氧化物吸附劑[28]。
1.5.1 層狀吸附劑
層狀吸附劑一般為多價金屬酸性鹽, 其中四價的磷酸鹽和砷酸鹽對Li+具有一定的選擇作用,通常情況下其層間距與Li+大小越接近則選擇性越強,特別是砷酸釷,Li+能夠進入其晶體內(nèi)部并置換出H+,但鹵水中的其他雜質(zhì)則不能進入。但是,由于砷酸釷具有一定的毒性,對鹽湖環(huán)境會造成污染,因此并不適合大規(guī)模工業(yè)化生產(chǎn)[29]。
1.5.2 銻酸鹽吸附劑
由過渡金屬氧化物和銻化合物結(jié)合得到的銻酸鹽對Li+有較高的選擇性。單斜晶系銻酸與銻酸鹽型無機離子吸附劑的制法, 是用酸處理具有斜方對稱骨架結(jié)構(gòu)的復合氧化物LiSbO3洗脫出鋰, 這時的HSbO3轉(zhuǎn)變?yōu)閱涡本汀?由于該法制得的吸附劑對鋰具有“記憶”性,因此具有吸附鋰的性能,最終在回收鋰時只要改變解析液的酸度即可[30]。 但是由于目前銻酸鹽吸附劑的研究較少且銻具有一定的毒性,因此并未投入工業(yè)化生產(chǎn)[31]。
1.5.3 鋁基吸附劑
鋁鹽吸附劑是從鋁鹽沉淀法提鋰發(fā)展而來,通常結(jié)構(gòu)為LiX·2Al(OH)3·nH2O,X 代表陰離子通常為Cl-,故可表示為LiCl·2Al(OH)3·nH2O。 鋁鹽吸附劑是將LiCl 插入到Al(OH)3中間得到的插入化合物。 用酸除去鋁基吸附劑中的Li+后,吸附劑中產(chǎn)生的空位可以選擇性吸附溶液中的Li+。其吸附和脫附過程如下:
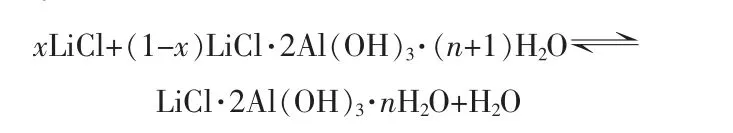
Guo 等[32]提出用反應耦合分離技術(shù)從高鎂鋰比鹽湖鹵水中分離鎂鋰。 該反應核心是使用結(jié)晶法將Mg2+轉(zhuǎn)化為MgAl 層狀雙氫氧化物(MgAl-LDH)。 此時鹵水中的Mg2+進入MgAl-LDH 層中,Li+仍停留在鹵水中。 最佳條件下Mg2+幾乎全部進入到LDH 層中,Li+質(zhì)量分數(shù)僅減少8%。 這一方法具有對環(huán)境友好、可持續(xù)等優(yōu)點。
Sun 等[33]合成了鋰層雙氫氧化物(LiAl-LDHs),利用耦合反應從高鈉鋰比鹵水(Na 與Li 質(zhì)量比為48.7)中分離鈉和鋰。 鹵水中鋰離子選擇性進入固相從而形成LiAl-LDHs,鈉離子仍保留在液相中。Li 與Al 物質(zhì)的量比為1∶2時得到單相LiAl-LDHs,Li 與Al 物質(zhì)的量比增大到1∶3時產(chǎn)生Al(OH)3。 最佳條件下鋰的損耗可低至3.93%。 這一方法對于從較高鎂鋰比和鈉鋰比鹽湖鹵水中提鋰具有一定的參考意義。
Li 等[34]利用活性鋁粉水解-吸附反應在NaCl加入量為70%、球磨時間為3h、球粉質(zhì)量比為20∶1條件下制備活性鋁粉, 然后將活性鋁粉加入Mg-Li混合溶液中提取鋰。 在反應時間為3h、反應溫度為70℃、活性鋁粉加入量為Al 與Li 物質(zhì)的量比為4∶1時,鋰沉淀量超過90%,鎂沉淀量控制在13%。
鋁鹽吸附劑具有對鋰離子選擇性較好、有效且所得鋰純度較高等優(yōu)點。 但是在吸附-洗脫過程中普遍存在造粒導致吸附容量降低和溶損率較高的情況[35]。
1.5.4 離子篩型吸附劑
離子篩型吸附劑通常用無機化合物與Li+復合生成復合氧化物, 在不改變復合氧化物晶體結(jié)構(gòu)的前提下將Li+抽除,從而得到具有規(guī)則空隙結(jié)構(gòu)的多孔材料[36]。 鋰離子篩吸附劑能夠根據(jù)分子的記憶效應、尺寸效應和篩分效應,在多種離子共存下對Li+具有很高的吸附選擇性,進而將Li+同其他離子分離開來,特別適合鹵水和海水等稀鋰溶液中Li+的選擇性吸附分離[37]。 目前研究較多的為偏鈦酸型離子篩和錳系離子篩。
Chen 等[38]采 用 微 波 輔 助 水 熱 法 合 成 了Li1.6Mn1.6O4(LMO),將LMO 酸 處 理 后 得 到MnO2·0.5H2O 離子篩(HMO)。 Li 與Mn 物質(zhì)的量比為4的HMO-1在100℃微波輻射1h,對Li+吸附能力達到5.6mmol/g,分配平衡系數(shù)為12366.44mL/g。 同時,它對Li+脫出/嵌入過程離子交換量大于95%。 HMO離子篩吸附能力強,對Li+選擇性高,在萃取鹽湖鹵水、沉鋰母液等方面具有良好的應用前景。
Xue 等[39]用水熱法首次制備了摻雜Fe3O4的錳氧化物(LMO/FO)作為磁性離子篩前驅(qū)體。 將Fe3O4摻雜到LMO 中,能夠使前驅(qū)體中Mn 的平均價從+3.48提高到+3.53,有利于提高其結(jié)構(gòu)穩(wěn)定性。 經(jīng)酸處理的LMO/FO(即HMO/FO)的平衡吸附能力為29.33mg/g,大于未摻雜的HMO。 在0.05mol/L HCl溶液中,30min 后可以達到解吸平衡,錳和鐵的溶解損失率分別為6.22%和4.14%。LMO/FO 的飽和磁化強度(Ms)為2.5A·m2/kg,通過磁體實現(xiàn)固液分離。此外,在含有Li+、Na+、K+、Mg2+、Ca2+的混合溶液中,磁性離子篩對Li+表現(xiàn)出良好的吸附性。
Marthi 等[40]采用水熱和固態(tài)煅燒相結(jié)合的方法合成了lambda-MnO2硅藻土復合吸附劑。 以鹽酸為洗脫劑, 經(jīng)過5次吸附-脫附循環(huán)后造成Mn2+的損失,使得吸附能力下降30%。80℃下用(NH4)2S2O8替代鹽酸作為洗脫劑,降低Mn2+的損失,提高吸附劑的循環(huán)穩(wěn)定性。 此吸附劑在富含堿金屬鹵水中能夠高選擇性地提取95%的鋰。
總結(jié)發(fā)現(xiàn), 吸附劑中以鋁基吸附劑和離子篩型吸附劑的優(yōu)勢最為明顯, 但二者都存在多次循環(huán)后吸附劑成粉末狀、流動性及滲透性差、溶損率較高等缺點。 由于其選擇性高、操作簡單、綠色環(huán)保等優(yōu)點也較為突出,相信在今后的發(fā)展中會日益完善。
2 結(jié)語
目前, 鹵水提鋰主要應用于工業(yè)級碳酸鋰的生產(chǎn)。沉淀法作為較成熟的傳統(tǒng)鹵水提鋰技術(shù),適用于低鎂鋰比鹵水提鋰, 例如智利Atacama 鹽湖和美國Silver Peak 鹽湖,已實現(xiàn)工業(yè)化生產(chǎn)。 吸附法鹵水提鋰技術(shù)的關(guān)鍵是合成性能優(yōu)異的吸附材料, 鋁鹽吸附劑已應用于美國的FMC 公司和中國的青海藍科鋰業(yè)實際生產(chǎn)。 萃取法已建成西臺吉乃爾鹽湖鹵水500t/a 氯化鋰中試示范線, 興華鋰業(yè)建成5000t/a規(guī)模的箱式萃取槽萃取鋰的工業(yè)示范生產(chǎn)線, 一直正常運行。 其他新興方法,如電化學法、離子篩吸附法也在不斷取得新的突破性進展。 但是單獨使用某一種方法,總有一些方法本身帶來的弊端無法避免,故越來越多的研究者正在嘗試將新型材料運用到已有方法中,或?qū)⒁延械膬煞N方法結(jié)合;Pramanik 等[20]采用納濾與膜蒸餾相結(jié)合的方法制備新型納濾膜等, 都取得了較好成績, 但是都處于實驗室起步階段。相信在今后的發(fā)展中吸附法、膜法和萃取法將成為未來鹵水提鋰技術(shù)的主要研究與發(fā)展方向。

