不同粒度納米碳酸鈣的可控制備
常越凡,張慧捷,王珊珊,薛永強,
(1.山西工程職業學院冶金與環境工程系,山西太原030009;2.太原理工大學應用化學系)
納米碳酸鈣(CaCO3)是一種新型固體材料。CaCO3粉末經過超細微化處理其晶體結構和表面電子結構均會發生顯著變化,使其表現出不同的性能,使其應用更加廣泛,可用于環保[1]、造紙[2]、涂料[3]、生物[4]、醫藥[5]、臨床[6]、農業[7]、橡膠制品[8]、建筑[9-10]等領域。納米CaCO3的晶型有3種,分別為球霰石型、方解石型和文石型。 其中,球霰石相納米CaCO3的比表面積較高、密度較低、溶解性和分散性較好,在材料領域具有良好的應用前景[11]。 例如,Cai 等[1]用40nm 左右的球霰石型納米CaCO3作凈水劑, 發現其對去除水中有毒重金屬離子有著良好的效果;Mori等[2]制備了適用于打印紙涂料的CaCO3粉末,其中包含粒徑在100nm 的球霰石型納 米CaCO3;Som 等[6]發現100nm 的球霰石CaCO3粒子可以有效調節體內腫瘤pH 而抑制腫瘤的生長, 但是當納米CaCO3粒徑太大(>300nm)或太小(<20nm)時,則不能有效調節體內腫瘤的pH。 可見球霰石相CaCO3應用廣泛, 并且不同行業對CaCO3的粒徑的要求不同,因此其粒徑的可控制備顯得尤為重要。
目前, 關于納米CaCO3可控制備的研究較少。Trushina 等[12]采用復分解法,以多元醇(乙二醇、甘油和赤蘚糖醇)為添加劑,制備了0.35~2.0μm 粒徑可控的球霰石相納米CaCO3微球;更大粒徑球霰石型CaCO3的可控制備也有文獻報道[13]。 而對于100nm 以下CaCO3的制備:Cai 等[1]以氫氧化鈉、碳酸二甲酯和氯化鈣為原料, 聚丙烯酸為添加劑,合成出粒徑為40nm 左右的球霰石型納米CaCO3;Mori 等[2]以碳酸鉀和氯化鈣為原料,制備出包含100nm 的球霰石型納米CaCO3;陳銀霞等[14]以油酸為添加劑,制備了粒徑為30nm 左右、形貌為球形的球霰石型納米CaCO3顆粒。 上述文獻報道的關于100nm 以下的球霰石納米CaCO3的制備都是單一粒徑的制備,而小尺寸球霰石相納米CaCO3不同粒徑的可控制備未見報道。
筆者采用復分解法,以氯化鈣和碳酸銨作為反應物,選用乙醇、檸檬酸和焦磷酸鈉作為添加劑,考察了反應物濃度、反應溫度、滴加速率以及分散劑對產物粒徑的影響規律,在此基礎上制備出了不同粒徑的球霰石型納米CaCO3并進行了表征,實現了球霰石型納米CaCO3的可控制備,為相關的研究和工業生產提供了重要參考。
1 實驗部分
1.1 試劑與儀器
試劑:無水氯化鈣(CaCl2)、碳酸銨[(NH4)2CO3]、檸檬酸、無水乙醇、焦磷酸鈉、三乙醇胺、氫氧化鈉(NaOH)、鈣指示劑(NN)、乙二胺四乙酸二鈉(EDTA),均為分析純。
儀器:XRD-6000X 射線衍射儀(XRD);JEM-2100F 透射電子顯微鏡(TEM);JSM-6700F 場發射掃描電子顯微鏡(SEM);TENSOR27型傅里葉紅外光譜儀(FT-IR);AUY220電子分析天平;DZF-6030A真空干燥箱。
1.2 納米CaCO3 制備
以無水CaCl2和(NH4)2CO3為原料,制備納 米CaCO3的反應方程式:
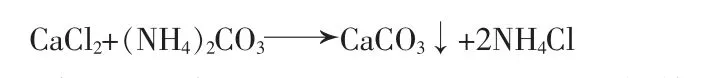
稱取一定量無水CaCl2、(NH4)2CO3和分散劑分別配制成一定濃度的溶液。量取一定量(NH4)2CO3溶液和分散劑混勻, 在一定溫度下滴加CaCl2溶液得到白色沉淀,將沉淀物過濾、洗滌、60℃干燥8h,得到納米CaCO3。 改變反應條件(濃度、溫度、滴加時間和分散劑等),制備一系列不同粒徑的納米CaCO3。
1.3 納米CaCO3 表征
1.3.1 純度的測定
采用配位滴定分析法[15]測定CaCO3的純度。 用鹽酸將一定質量的產物溶解得到樣品溶液,用NaOH 調節溶液pH 大于12,以NN 作為指示劑,用EDTA 標準溶液滴定樣品溶液的顏色至純藍色,根據消耗EDTA 的體積計算產物中CaCO3的含量。
1.3.2 結構和形貌表征
采用XRD-6000型X 射線衍射儀分析樣品的晶型; 采用TENSOR27型傅里葉紅外光譜儀分析樣品的官能團;采用JEM-2100F 型透射電子顯微鏡和JSM-6700F 型場發射掃描電子顯微鏡分析樣品的形貌。
1.3.3 粒徑表征
CaCO3屬于非導電材料,表面帶有“電子陷阱”,產生“充電效應”。 為消除這種效應,在做SEM 測試時需要在材料表面噴金, 但噴金后觀察到的樣品在形貌和粒度上與其真實情況不同。 因此,采用GB/T 23413—2009《納米材料晶粒尺寸及微觀應變的測定:X 射線衍射線寬化法》計算產物的一次粒徑,根據產物XRD 譜圖特征衍射峰的半峰寬由Scherrer公式計算產物的平均直徑。
2 結果與討論
2.1 制備條件對粒徑的影響
以無水CaCl2和(NH4)2CO3為原料用復分解法研究了納米碳酸鈣的制備,在制備過程中反應條件(如濃度、溫度、滴加時間)和分散劑對所得樣品的粒徑都有影響。 為探究多種制備條件對納米CaCO3粒徑的影響規律,采用控制單一變量法進行了如下實驗:在納米碳酸鈣的制備過程中,無水CaCl2與(NH4)2CO3物質的量比為1∶1;分散劑分別為乙醇(A)、檸檬酸(B)、焦磷酸鈉(C),分散劑A、B、C 的用量分別為CaCl2質量的3%、3%、5%。
2.1.1 反應物濃度的影響
選用分散劑為A 和C 的混合溶液(A+C),反應溫度為60℃,CaCl2溶液滴加時間為30min, 改變反應物CaCl2與(NH4)2CO3的濃度分別為0.3、0.5、1.0mol/L,不同反應物濃度制備CaCO3的XRD 譜圖見圖1,用Scherrer 公式計算得到納米CaCO3的粒徑見表1。
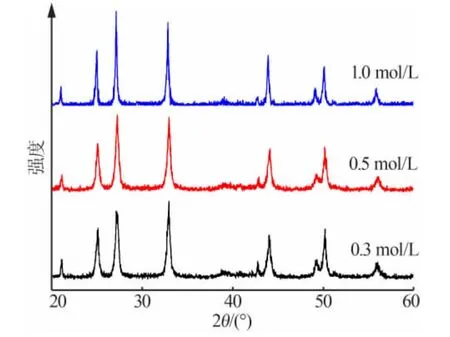
圖1 不同反應物濃度制備納米CaCO3 的XRD 譜圖

表1 不同反應物濃度制備納米CaCO3 的粒徑
由表1可知,隨著反應物濃度增大,納米CaCO3的粒徑先減小后增大。 這是因為,反應開始時,隨著反應物濃度升高,產物晶核的生成速率較快,生長速率相對較慢,使得產物的粒徑減小;當反應物濃度繼續升高時, 生成納米CaCO3晶核的速率變化不大,而生長速率明顯增大,使得納米CaCO3的粒徑增大。
2.1.2 反應溫度的影響
選用分散劑為A+C,反應物CaCl2與(NH4)2CO3的濃度均為0.1mol/L,CaCl2溶液滴加時間為15min,改變反應溫度分別為20、40、60℃,不同反應溫度制備納米CaCO3的XRD 譜圖見圖2,用Scherrer 公式計算得到納米CaCO3的粒徑見表2。
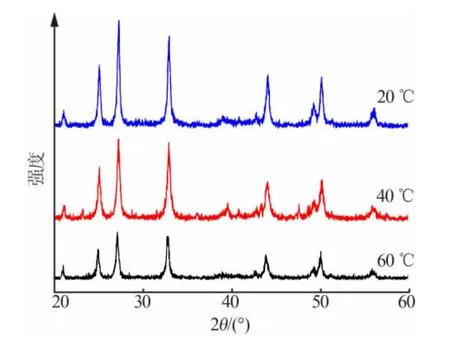
圖2 不同反應溫度制備納米CaCO3 的XRD 譜圖

表2 不同反應溫度制備納米CaCO3 的粒徑
由表2可知, 隨著反應溫度升高, 納米CaCO3平均粒徑減小。這是因為,在較低反應溫度下CaCO3晶核的形成速率較慢且晶核數目少, 因此形成的晶體粒徑較大;隨著反應溫度升高,晶核的形成速率加快且數目增多,此時晶核的生成速率大于生長速率,因此形成的晶體粒徑較小。
2.1.3 CaCl2 溶液滴加時間的影響
選用分散劑為A+C,反應物CaCl2與(NH4)2CO3的濃度均為0.1mol/L,反應溫度為30℃,改變CaCl2溶液滴加時間為15、30、45min, 不同CaCl2溶液滴加時間制備納米CaCO3的XRD 譜圖見圖3,用Scherrer 公式計算得到納米CaCO3的粒徑見表3。
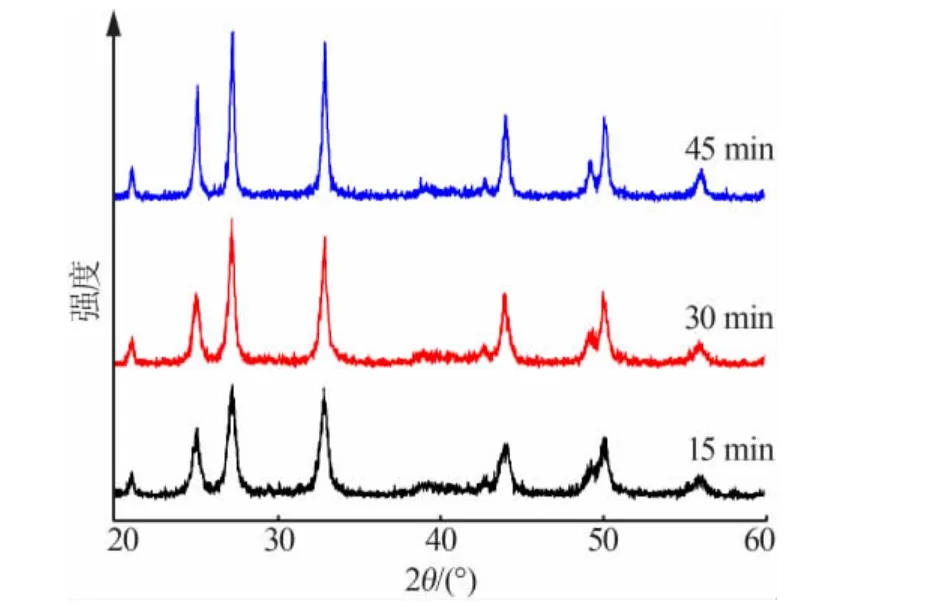
圖3 不同CaCl2 溶液滴加時間制備納米CaCO3 的XRD 譜圖

表3 不同CaCl2 溶液滴加時間制備納米CaCO3 的粒徑
由表3可知,隨著CaCl2溶液滴加時間的增加,CaCO3的平均粒徑逐漸增大。 這是由于產物的晶粒隨著反應時間的增加而逐漸長大, 因此納米CaCO3粒徑隨著CaCl2溶液滴加時間的增加而增大。
2.1.4 分散劑的影響
反應物CaCl2與(NH4)2CO3的濃度為0.3mol/L,反應溫度為20℃,CaCl2溶液滴加時間為15min,分散劑分別為A+C、B+C、C,不同分散劑制備納米CaCO3的XRD 譜圖見圖4,用Scherrer 公式計算得到納米CaCO3的粒徑見表4。 由表4可知,當分散劑為A+C時,制備的納米CaCO3粒徑最大;而當分散劑為B+C時,CaCO3的粒徑最小。 因此,在納米CaCO3的制備過程中,要獲得較大的粒徑,應選用乙醇與焦磷酸鈉的混合溶液作為分散劑;要獲得較小的粒徑,應選用檸檬酸與焦磷酸鈉的混合溶液作為分散劑。

圖4 不同分散劑制備納米CaCO3 的XRD 譜圖

表4 不同分散劑制備納米CaCO3 的粒徑
2.2 不同粒徑納米碳酸鈣的表征結果
2.2.1 納米CaCO3 的XRD表征結果
以上述反應物CaCl2與(NH4)2CO3的濃度、反應溫度、CaCl2溶液滴加時間、 分散劑等制備條件對納米CaCO3粒徑的影響規律為基礎,通過控制不同的制備條件制備了5種不同粒徑的納米CaCO3。 5種不同粒徑納米CaCO3制備條件見表5。 用X 射線衍射儀對樣品進行表征,得到相應的XRD 譜圖,結果見圖5。
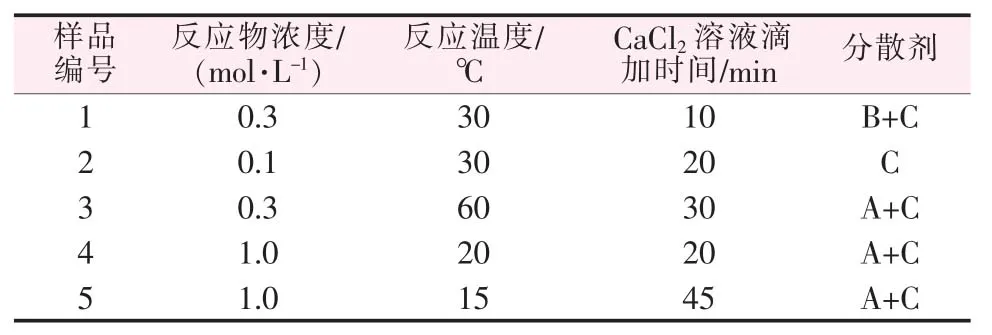
表5 5種不同粒徑納米CaCO3 制備條件
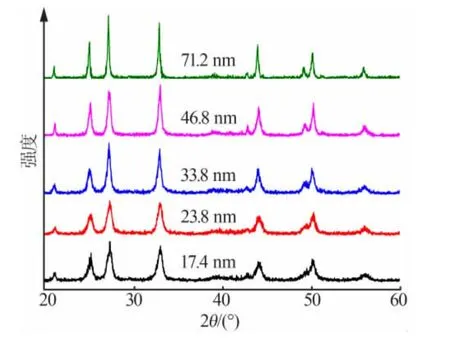
圖5 制備的5種不同粒徑納米CaCO3 的XRD 譜圖
由圖5可知,5種樣品在2θ 為21.1、25.1、27.3、33.0、44.0、50.2°處都出現了特征峰, 其衍射峰位置與JCPDS 標準卡片72-0506完全一致,為球霰石型CaCO3衍射峰,表明制備的樣品為球霰石型CaCO3。而且在樣品XRD 譜圖中未出現方解石型與文石型CaCO3特征峰,說明制備的納米CaCO3純度很高。由Scherrer 公式計算求得樣品顆粒的平均粒度, 結果見表6。
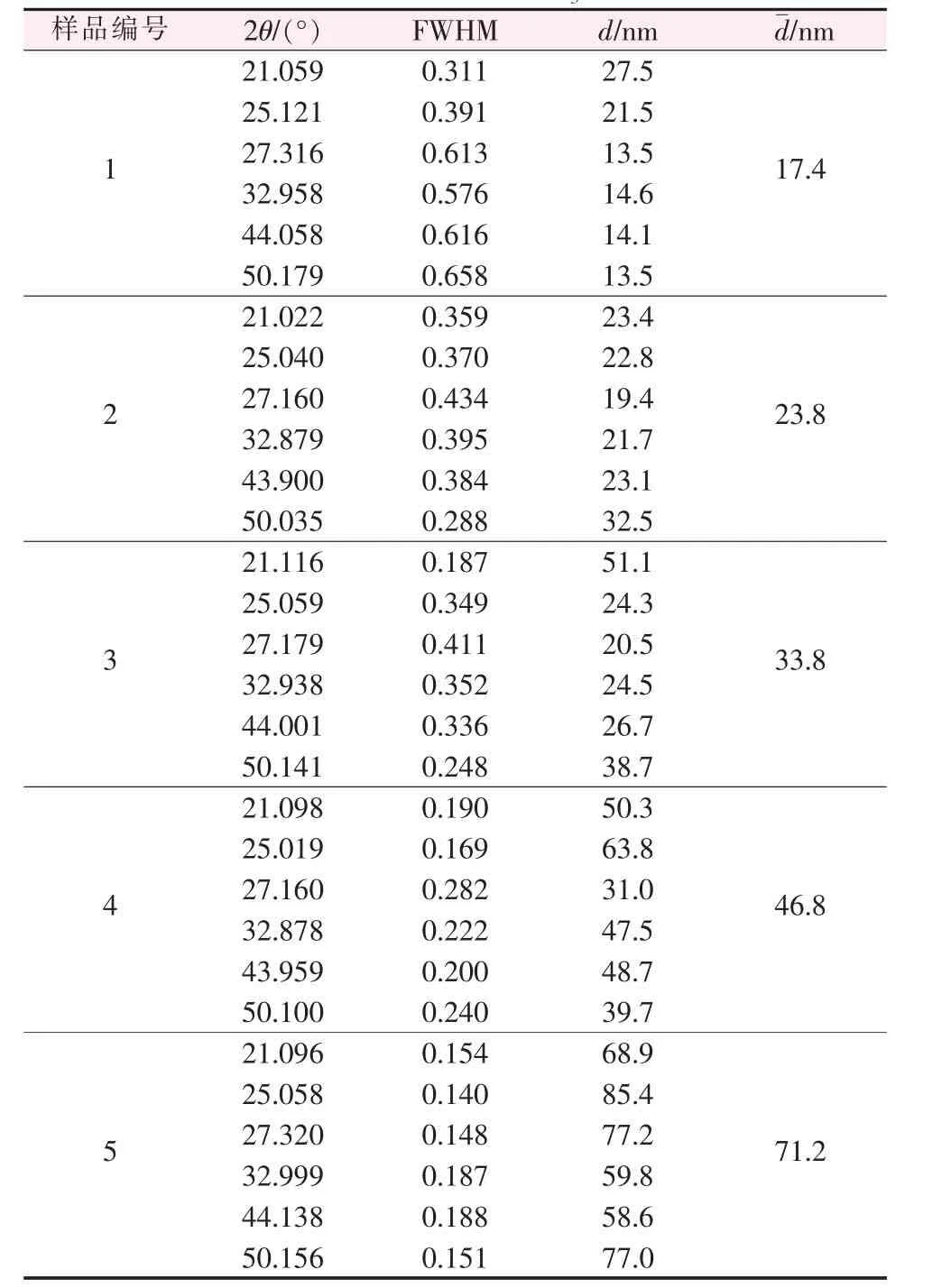
表6 制備的5種不同粒徑納米CaCO3 的XRD 數據及粒度
2.2.2 納米CaCO3 純度測定結果
對制備的5種不同粒徑納米CaCO3的純度進行測定,結果見表7。 由表7看出,制備的5種不同粒徑納米CaCO3的純度都在99%以上,說明用該方法制備的納米CaCO3具有純度高、雜質少的優點。 因此制備球霰石型納米CaCO3適宜選用復分解法。
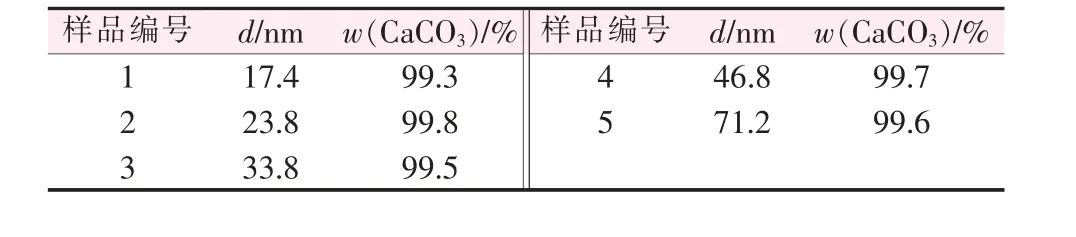
表7 制備的5種不同粒徑納米CaCO3 的純度
2.2.3 納米CaCO3 紅外光譜表征結果
制備的納米CaCO3(粒徑為71.2nm)的紅外光譜圖見圖6。由圖6可知,圖中只出現了位于745、877、1087cm-1處的特征吸收峰,這些特征吸收峰屬于球霰石相納米CaCO3的特征峰,而沒有出現方解石(712、1421cm-1)和文石(860、1475cm-1)的特征吸收峰。 同樣證明所制備的納米CaCO3的晶型為球霰石型。
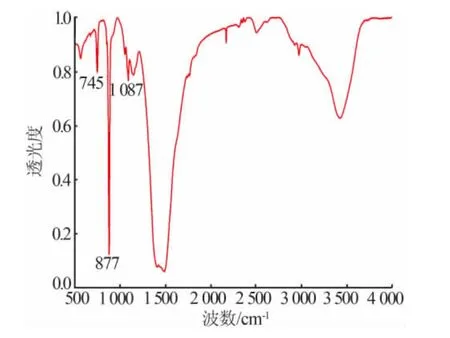
圖6 制備的納米CaCO3 的紅外光譜圖
2.2.4 納米CaCO3 的TEM 及SEM 表征結果
圖7a、b 為制備的粒徑為71.2nm 的CaCO3的透射電鏡照片;圖7c、d 為掃描電鏡照片。 從圖7可以看出,制備的納米CaCO3的形貌近似球形,并且分散性較好。

圖7 制備的納米CaCO3 的TEM(a、b)及SEM(c、d)照片
3 結論
采用復分解法,以乙醇、檸檬酸和焦磷酸鈉作為分散劑,研究了粒徑可控的納米CaCO3的制備。 研究結果表明,增大反應物濃度,納米CaCO3的粒徑呈先減小后增大的趨勢; 反應溫度的升高可減小納米CaCO3的粒徑; 納米CaCO3的粒徑隨著CaCl2滴加時間的增加而增大。 所制備的納米CaCO3屬于球霰石型,其形貌近似球形,純度在99%以上。 本文提供了一種高純度、粒徑可控的小尺寸納米CaCO3的制備方法,可為不同粒徑納米CaCO3的制備、研究與應用提供重要的參考。

