1株三型丁香假單胞菌獼猴桃致病變種細菌全基因組掃描圖測序及分析
鄧博涵 劉丹蕾 陳秋菊


摘要:丁香假單胞菌獼猴桃致病變種(Pseudomonas syringae pv. actinidiae,簡稱Psa)是引起獼猴桃細菌性潰瘍病的病原菌。對從感染潰瘍病的東紅獼猴桃枝條中分離得到的1株Psa野生株(命名為GX05)進行全基因組測序,獲得基因組草圖,分析其中毒力基因、耐藥基因和致病基因的情況。研究發現,多位點序列分型結果顯示GX05為biovar 3,與毒力因子數據庫比對,GX05攜帶99種毒力因子及692個相關毒力基因,同源性和匹配度最高的毒力因子是PvdL和Irp1;與綜合抗生素抗性基因數據庫比對,GX05攜帶336種耐藥基因,與29種抗生素有關;與病原宿主互作數據庫比對,不表達導致病原菌致病力減弱的基因數量最多,其中同源性和匹配度最高的是PvdL,此外與增強致病力相關的同源性和匹配度最高的基因是hrcC。通過全基因組測序信息初步分析了1株三型Psa菌株中存在的毒力、耐藥及致病基因情況,對深入研究其致病機制和合理用藥有重要意義。
關鍵詞:丁香假單胞菌獼猴桃致病變種;獼猴桃細菌性潰瘍病;全基因組測序;毒力基因;耐藥基因;致病基因
中圖分類號:S436.634.1+9?? 文獻標志碼: A? 文章編號:1002-1302(2020)20-0067-08
獼猴桃細菌性潰瘍病嚴重威脅著獼猴桃產業的發展,給世界獼猴桃產業造成了巨大損失[1],丁香假單胞菌獼猴桃致病變種(Pseudomonas syringae pv. actinidiae,簡稱Psa)是獼猴桃細菌性潰瘍病的致病菌[2]。研究發現,原本健康的獼猴桃植株在春季初次出現潰瘍病癥狀(如葉斑)后,年底便會死亡。潰瘍病的傳播速度快、危害大,1年便可毀壞整個獼猴桃園[3-4]。目前還沒有直接殺滅病原菌的有效措施[5],主要的防治方法包括以銅制劑為主的化學防治[6-7]、以鏈霉素為主的生物防治[8-9]、果園管理[10]和抗性品種選育[11]等。化學和生物防治可造成植物毒性、藥物殘留、產生耐藥細菌等缺點,并且基因水平轉移可使耐藥基因在細菌間流動[12],目前已有報道表明部分Psa對鏈霉素[13]和銅制劑[14]產生了抗性。
尋找獼猴桃細菌性潰瘍病的有效防治途徑是全球獼猴桃產業面臨的重要任務。已發現的Psa有5種生物型,分別為biovar 1、biovar 2、biovar 3、biovar 5、biovar 6。我國目前只發現biovar 3群體[15],但其致病機制尚不明確。有關Psa的研究主要集中在群體結構、病原菌鑒定、防控藥物篩選等方面,對毒力基因、耐藥基因和致病基因的研究報道較少。本試驗對1株從貴州省貴陽市修文縣古堡鎮獼猴桃養殖基地采集的患病東紅獼猴桃(Actinidia chinensis “Donghong”)枝條中分離出的Psa進行全基因組掃描圖測序,分別與毒力因子數據庫、綜合抗生素抗性基因數據庫和病原宿主互作數據庫等進行比較,篩選出與毒力基因、耐藥基因和致病基因同源性最高的基因組,利用基因組信息從分子水平揭示病原菌的致病機制,為Psa的致病機制研究提供理論積累。
1 材料與方法
1.1 菌株的分離純化
2018年3月在貴州省貴陽市修文縣古堡鎮的獼猴桃園內采集感染獼猴桃潰瘍病的東紅獼猴桃枝條。在無菌環境下,削取枝條病部,置于無菌的生理鹽水中,27 ℃振蕩10 min,接種于1.5%NB固體培養基(國藥集團化學試劑有限公司)表面,參考馬志宏等的方法[16]進行平板劃線純化。倒置平板于恒溫培養箱中,27 ℃培養24 h,挑單菌落于NB液體培養基中,于27 ℃恒溫搖床中180 r/min搖菌 16 h。吸取最后一輪純化的菌液于無菌離心管中離心后棄上清,收集菌體沉淀用于提取DNA和浸染煙草試驗。
1.2 菌株基因組DNA的提取與菌種鑒定
根據細菌基因組DNA小量純化試劑盒[寶日醫生物技術(北京)有限公司]說明書提取基因組DNA,用27F/1492R通用引物進行16S rDNA測序[由生工生物工程(上海)股份有限公司進行測序],測序結果在NCBI數據庫(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中進行核酸BLAST比對,篩選出屬于Psa的菌株。
1.3 煙草過敏反應
細菌緩沖液(100 mL)成分包括1 mL的1 mol/L MgCl2、1 mL的1 mol/L 2-(N-嗎啉代)乙烷磺酸一水(用KOH調整pH值至5.6)和100 μL的 100 μmol/L 乙酰丁香酮。用配制好的緩沖液將細菌沉淀懸浮,調整濃度為D600 nm=0.5,避光3~4 h后備用。在本氏煙草葉片背面用注射器針頭輕微劃傷,將無針注射器壓在傷口處,輕輕往里注射,使菌液直徑擴散至2 cm左右。處理組(接種細菌懸浮液)和對照組(直接注射緩沖液)各選擇5個葉片進行接種,24 h后觀察葉片的變化情況。
1.4 抗生素敏感性試驗
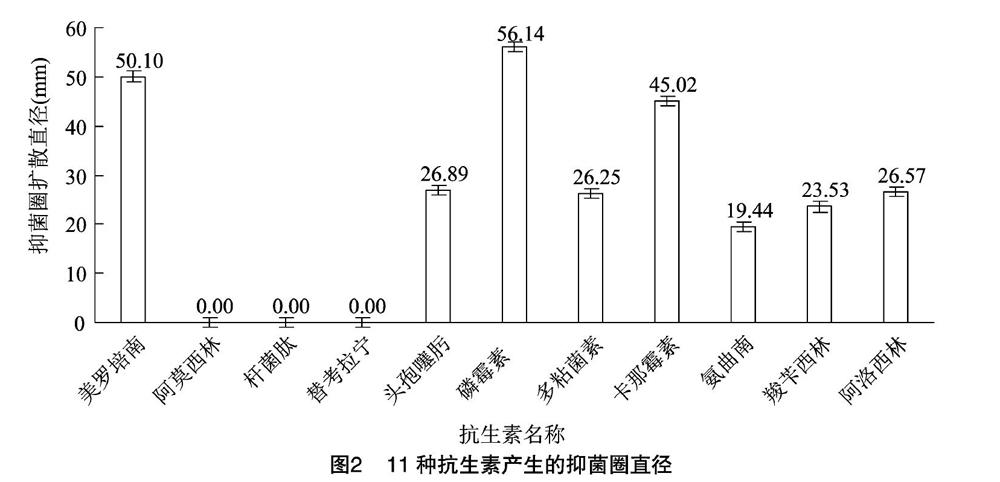
采用紙片擴散法,選擇11種抗生素進行抗生素敏感性試驗。用無菌的生理鹽水稀釋菌液至0.5麥氏濁度,用無菌涂布棒均勻涂抹菌液至整個NB瓊脂平板,鑷子滅菌后夾取各藥敏紙片(杭州微生物試劑有限公司)于平板正中。每種藥敏片做3個平行,進行3次生物學重復,每個抑菌圈統計3個直徑,計算平均值,判斷抗生素敏感性[17]。
1.5 GX05全基因組測序
將GX05的基因組DNA送往上海美吉生物醫藥科技有限公司二代測序平臺Illumina Hiseq×10進行測序。使用短序列組裝軟件SOAPdenovo2[18]對二代測序后的經過濾得到的有效數據進行多個 K-mer 參數的拼接,得到最優的重疊群(contigs)組裝結果。隨后通過將測序讀長(reads)比對到contig上,對組裝結果進行局部組裝和優化,獲得基因組骨架(scaffolds)。使用CGview[19]軟件繪制基因組圈圖。使用Glimmer 3[20]軟件預測編碼基因,使用Tandem Repeats Finder軟件[21]進行串聯重復序列預測。按照管家基因在標準株Pseudomonas syringae pv. tomato DC3000基因組上的位置,使用biovar 1~biovar 6型以及Pfm菌株[15]的管家基因以gapA-pgi-rpoD-gyrB-pfk-acn的順序串聯[22],使用MEGA 7.0用Tamura-Nei模型和近鄰法進行系統發育分析[23]。比對病原菌毒力因子數據庫(virulence factors of pathogenic bacteria,簡稱VFDB)[24],綜合抗生素抗性基因數據庫(comprehensive antibiotic resistance database,簡稱CARD)[25]和病原與宿主互作數據庫(pathogen host interactions,簡稱PHI)[26]分別獲得毒力基因、耐藥基因和致病基因的信息。
2 結果與分析
2.1 Psa菌株的分離與鑒定
經過多輪純化后分離得到的Psa菌株在NB平板上的菌落形態呈光滑圓形,白色半透明狀。16S rDNA測序結果在NCBI數據庫經過BLAST比對,結果顯示與Psa菌株(序列號:MH071159.1)相似度為98.24%,判斷為Psa菌株,命名為GX05。
2.2 煙草過敏反應
圖1-a、圖1-b分別為注射細菌懸浮液(處理)和無菌緩沖液(對照)的煙草,注射范圍約2 cm,呈現出水漬狀。24 h后,處理組葉片的注射部位出現明顯的黃色枯斑,產生了過敏反應(圖1-c),而對照組葉片注射無菌緩沖液的部位水漬消失,葉片
恢復正常狀態(圖1-d),說明分離純化所得的Psa野生株GX05具有相應的致病性。
2.3 抗生素敏感性試驗結果
由表1、圖2可知,Psa菌株GX05對磷霉素、多黏菌素、卡那霉素、氨曲南、羧芐青霉素、阿洛西林、美羅培南、頭孢噻肟等表現為敏感,對替考拉寧、桿菌肽和阿莫西林表現為耐藥。
2.4 Psa菌株GX05全基因組測序結果
Psa GX05進行全基因組測序后,對獲得的片段進行過濾和組裝,得到251條scaffolds,總長度為 6 212 819 bp(圖3), N50 為 46 356 bp。長度大于 1 000 bp 的scaffolds有223條,共6 195 265 bp,最大的scaffold長度為181 097 bp,鳥嘌呤-胞嘧啶(G+C)含量為58.53%。經預測,基因組的編碼基因總長度為5 180 589 bp,共有5 725個。非編碼區有57個tRNA,9個rRNA,包括1個23S rRNA1個16S rRNA、7個5S rRNA,有195個串聯重復序列,占基因組的0.97%。根據多位點序列分型(MLST)構建的系統發育樹結果可知,GX05屬于biovar 3型Psa(圖4)。
2.5 Psa菌株GX05毒力因子分析
VFDB數據庫預測到692個毒力基因,其中367個毒力基因注釋為99種毒力因子,52種毒力因子的功能分屬于攻擊型毒力因子(28種)、防御型毒力因子(11種)、非特異性毒力因子(11種)和調控毒力基因的毒力因子(2種),剩余的47種沒有功能歸類。按照打分由高到低的條件篩選, 同源性和匹配
度最高的2個毒力因子與鐵載體(siderophore)有關:熒光鐵載體(pyoverdine,簡稱PVD)肽合成酶PvdL以及合成耶爾森菌素(yersiniabactin)有關的耶爾森菌素生物合成蛋白Irp1。另外經統計,共匹配到51個PVD合成相關毒力基因(表2,未完全顯示,僅顯示同源性最高的10個基因)和4個非熒光鐵載體(pyochelin)合成相關的毒力因子[Fe(Ⅲ)-pyochelin receptor precursor、salicylate biosynthesis isochorismate synthase PchA、salicylate biosynthesis protein PchB、ABC transporter ATP-binding protein]。
2.6 Psa菌株GX05耐藥基因分析
通過與CARD數據庫比對分析,預測GX05攜帶366個耐藥基因,與29種抗生素有關(圖5)。經ARO(Antibiotic Resistance Ontology)注釋,GX05有5種耐藥機制,分別為抗生素外排、抗生素靶標改變、抗生素失活、抗生素靶標替代和抗生素靶標保護。外排泵系統的基因數量最多,主要包括macB(31個)、oleC(14個)、evgS(13個)、drrA(13個)等253個相關抗生素耐藥基因本體,其中根據score打分,同源性和匹配度最高的10個基因中與外排泵有關的基因是mexF、mexK、MexB、TriC、MexN。
2.7 Psa菌株GX05致病基因分析
PHI數據庫注釋預測GX05攜帶有959個與宿主病原菌互作相關的基因,屬于8種表現型:缺失導致病原菌致病力減弱的基因643個、對病原菌致病性沒有影響的基因172個、導致病原菌致病能力喪失的基因99個、使病原菌致病能力增強的基因68個、致病效應基因34個、致死因子18個、抗藥基因3個、感藥基因2個。比對結果按照得分打分,同源性和匹配度最高的是不表達導致病原菌致病能力減弱的并與鐵載體有關的基因PvdL,此外與增強病原菌致病能力有關并且同源性和匹配度最高的基因是三型分泌系統通路上的基因hrcC。當篩選作用宿主為擬南芥時,高度匹配得到5個基因,其中AvrE1、hrcC、HopD1等3個基因與植物感染后葉片出現細菌性斑點的癥狀有關(表3)。
3 討論與結論
由于紅陽獼猴桃和黃金果獼猴桃的栽培面積最廣、經濟價值高,所以全世界對獼猴桃潰瘍病的關注點主要集中于這2個品種,對其他患有獼猴桃細菌性潰瘍病的獼猴桃品種的研究較少。本研究是首次對從患病的東紅獼猴桃枝條中分離出的Psa(菌株命名為GX05)進行全基因組掃描圖測序,并且著重分析耐藥基因以及同源性和匹配度最高的毒力基因和致病基因。
注射煙草和真空滲透葉盤的結果證明Psa菌株GX05有致病力。從使用MLST構建的系統發育樹結果來看,GX05屬于biovar 3。biovar 3是我國目前發現唯一存在的Psa群體[15],也是目前全世界最普遍流行的Psa群體[27]。在5種生物型中,biovar 3的致病力最強[28],但其致病機制尚不明確。Hacker等發現,病原菌的致病性取決于位于毒力島上的多種毒力基因[29-30],而各種毒力因子的組合與平衡對于Psa的致病性(毒力)來說很重要[27]。目前對感染潰瘍病的東紅獼猴桃的研究主要以調查其發病情況[31]和抗性評價[32]為主,針對致病菌Psa致病及乃耐藥機制的研究尚未見報道。因此本研究著重關注了導致東紅感染獼猴桃細菌性潰瘍病的Psa菌株的毒力和致病基因以及導致其產生耐藥性的原因。本次測序結果得到的GX05基因組大小為6 212 819 bp,與NCBI數據庫中丁香假單胞菌的基因組大小(6.1 Mp)接近。根據全基因組測序結果,通過分析毒力基因和致病基因,篩選出3個同源性最高且最具代表性的基因:PvdL、Irp1、hrcC;分析耐藥基因發現,該菌攜帶多種類型的耐藥基因,并且以外排泵系統基因為主。
本研究預測到692個毒力基因,同源性和匹配度最高的基因與鐵載體的合成有關。Marcelletti等對2株Psa biovar 1和1株biovar 3菌株基因組的草圖進行研究,發現它們均攜帶一組編碼鐵載體(鐵載體是假單胞菌屬細菌的重要毒力因子[34])的基因,例如PVD、腸桿菌素(enterobactin)和耶爾森菌素[33]。Lamont等發現,PVD在銅綠假單胞菌中可以調控外毒素A、PrpL等其他毒力因子的表達[35];Wooldridge等發現,PVD參與調控生物膜的形成,增加病原菌的耐藥性[36]。從測序結果來看,GX05的基因組中共計匹配到51個合成熒光鐵載體相關毒力基因,覆蓋了PVD合成、分泌和作用途徑,其中PvdL的同源性最高。結合GX05中PVD的存在可以初步判定,Psa分離株具有與銅綠假單胞菌相似的毒力因子和致病機制,生物膜的形成是Psa產生耐藥性的主要原因。Irp1廣泛存在于假單胞菌屬的細菌中[37],編碼耶爾森菌素生物合成蛋白[38],與合成、攝取鐵載體有關[39],引起番茄和擬南芥的細菌性葉斑病[40]。測序結果預測顯示,Irp1是與增強Psa致病力有關同源性最高的基因。因此,Psa可能通過Irp1來調控鐵載體和其他鐵吸收系統,從而在獼猴桃中繁殖并增強Psa的感染能力,這可能是Psa破壞力強大并造成毀園的主要原因。但目前Psa中還沒有Irp1功能研究的相關報導。此外,感染潰瘍病的獼猴桃葉片出現葉斑的原因也可能與Irp1有關。Mccann等研究發現,Psa通過Ⅲ型分泌效應因子感染獼猴桃[41],而hrcC蛋白是組成Ⅲ型分泌系統的外膜蛋白[42],可以引起非宿主植物(如煙草)的過敏反應并使宿主植物感病[43]。本次的全基因組測序數據顯示,同源性最高的互作基因是hrcC。因此,攜帶hrcC的Ⅲ型分泌系統可能是引起Psa感染獼猴桃并使得葉片出現細菌性斑點的原因之一。目前對于Psa的毒力因子和病原菌宿主互作的研究主要集中于Ⅲ型分泌系統中的avr和hop基因[27],而hrcC的存在為完善Psa分泌系統通路提供了新的途徑。通過CARD預測到GX05攜帶多種耐藥基因,以外排泵系統產生抗生素耐藥性為主。外排泵能夠將進入細菌體內的抗生素排出[44],因此GX05可能主要靠外排泵系統產生耐藥性。藥敏試驗發現,GX05對替考拉寧、桿菌肽和阿莫西林表現出了耐藥性,這3種抗生素分別屬于糖肽類抗生素、多肽類抗生素和青霉類抗生素,與預測到的信息相匹配。
首先從患病的東紅獼猴桃枝條中分離出Psa(菌株命名為GX05),并對其進行煙草過敏反應試驗和抗生素敏感性試驗,最后對其基因組進行掃描圖測序。分析發現,其致病機制主要是與PVD的合成和分泌有關,并發現其導致葉片出現葉斑病的是Irp1致病基因。這為進一步研究Psa的致病機制提供了新的思路,在未來可以尋找影響Psa的鐵載體和外排泵系統發揮作用的方法來治療獼猴桃細菌性潰瘍病。
參考文獻:
[1]Vanneste J L. The scientific,economic,and social impacts of the New Zealand outbreak of bacterial canker of kiwifruit (Pseudomonas syringae pv. actinidiae)[J]. Annual Review of Phytopathology,2017,55(1):377-399.
[2]Takikawa Y,Serizawa S,Ichikawa T,et al. Pseudomonas syringae pv. actinidiae pv. nov.:the causal bacterium of canker of kiwifruit in Japan[J]. Japanese Journal of Phytopathology,1989,55(4):437-444.
[3]Scortichini M,Marcelletti S,Ferrante P,et al. Pseudomonas syringae pv. actinidiae:a re-emerging,multi-faceted,pandemic pathogen[J]. Molecular Plant Pathology,2012,13(7):631-640.
[4]Vanneste J L. Pseudomonas syringae pv. actinidiae(Psa):a threat to the New Zealand and global kiwifruit industry[J]. New Zealand Journal of Crop and Horticultural Science,2012,40(4):265-267.
[5]Kim M J,Chae D H,Cho G,et al. Characterization of antibacterial strains against kiwifruit bacterial canker pathogen[J]. The Plant Pathology Journal,2019,35(5):473-485.
[6]Horgan D B,Gaskin R E . The effect of copper on the uptake and translocation of spirotetramat insecticide on kiwifruit[J]. New Zealand Plant Protection,2015,68:26-31.
[7]秦虎強,趙志博,高小寧,等. 四種殺菌劑防治獼猴桃潰瘍病的效果及田間應用技術[J]. 植物保護學報,2016,43(2):321-328.
[8]Wicaksono W A,Jones E E,Casonato S,et al. Biological control of Pseudomonas syringae pv. actinidiae (Psa),the causal agent of bacterial canker of kiwifruit,using endophytic bacteria recovered from a medicinal plant[J]. Biological Control,2018,116:103-112.
[9]Pinheiro L,Pereira C,Frazo C,et al. Efficiency of phage φ6 for biocontrol of Pseudomonas syringae pv. syringae:an in vitro preliminary study[J]. Microorganisms,2019,7(9):286.
[10]高小寧,趙志博,黃其玲,等. 獼猴桃細菌性潰瘍病研究進展[J]. 果樹學報,2012,29(2):262-268.
[11]羅 軒,李才國,張 蕾,等. 早熟抗潰瘍病獼猴桃優系“JS67”選育初報[J]. 中國南方果樹,2018,47(5):148-150.
[12]de Jong H,Reglinski T,Elmer P A G,et al. Integrated use of Aureobasidium pullulans strain CG163 and acibenzolar-S-methyl for management of bacterial canker in kiwifruit[J]. Plants,2019,8(8):287.
[13]李春游,趙志博,吳玉星,等. 陜西關中地區獼猴桃潰瘍病菌對鏈霉素的抗藥性監測[J]. 中國果樹,2016(6):59-62.
[14]Masami N,Masao G,Hibi T. Similarity between copper resistance genes from Pseudomonas syringae pv. actinidiae and P. syringae pv. tomato[J]. Journal of General Plant Pathology,2002,68(1):68-74.
[15]He R,Liu P,Jia B,et al. Genetic diversity of Pseudomonas syringae pv. actinidiae strains from different geographic regions in China[J]. Phytopathology,2019,109(3):347-357.
[16]馬志宏,楊 慧,李鐵梁,等. 西伯利亞鱘(Acipenser baerii)致病性維氏氣單胞菌的分離鑒定[J]. 微生物學報,2009,49(10):1289-1294.
[17]鐘永軍,何昕蔚,余達勇,等. 臺州獼猴桃潰瘍病病原菌分子鑒定及藥劑篩選[J]. 浙江農業學報,2018,30(9):1548-1554.
[18]Luo R B,Liu B H,Xie Y L,et al. SOAPdenovo2:an empirically improved memory-efficient short-read de novo assembler[J]. GigaScience,2012,1(1):18.
[19]Stothard P,Wishart D S. Circular genome visualization and exploration using CGView[J]. Bioinformatics,2005,21(4):537-539.
[20]Delcher A L,Bratke K A,Powers E C,et al. Identifying bacterial genes and endosymbiont DNA with Glimmer[J]. Bioinformatics,2007,23(6):673-679.
[21]Benson G. Tandem repeats finder:a program to analyze DNA sequences[J]. Nucleic Acids Research,1999,27(2):573-580.
[22]Sarkar S F,Guttman D S. Evolution of the core genome of Pseudomonas syringae,a highly clonal,endemic plant pathogen[J]. Applied and Environmental Microbiology,2004,70(4):1999-2012.
[23]Kumar S,Stecher G,Tamura K. MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution,2016,33(7):1870-1874.
[24]Chen L H,Zheng D D,Liu Bo,et al. VFDB 2016:hierarchical and refined dataset for big data analysis-10 years on[J]. Nucleic Acids Research,2016,44(1):694-697.

