針藥并用誘導自噬對ApoE 基因敲除小鼠認知功能的影響
呂美娟, 馬賢德, 任 路
(1.遼寧中醫藥大學針灸推拿學院,遼寧 沈陽110032; 2.遼寧中醫藥大學教學實驗中心,遼寧 沈陽 110032;3.遼寧中醫藥大學研究生院,遼寧 沈陽 110032)
阿爾茨海默病(Alzheimer’ s disease, AD)是記憶障礙最常見的神經退行性疾病[1],通常與行為變化有關,常表現為焦慮、幻覺、妄想、冷漠和異常運動等行為[2]。隨著老年人口比例的持續增長,AD 的患病率進一步升高,世界老年癡呆癥報告(2015 年)[3]指出:到2030 年,AD 患者將達到1 600 多萬,到2050 年將達到2 800 萬。AD 的病理特征是β-淀粉樣蛋白(amyloid β-protein,Aβ) 沉積過多和含有高磷酸化Tau (p-Tau) 的神經纖維內纏結[4-6]。Aβ 和p-Tau 的異常積累提示疾病過程中蛋白質處理系統失效。事實上,蛋白質穩態的失衡(包括自噬途徑) 與AD 的發病機制有關聯[7-8]。中醫中藥和針灸對AD 均具有較好的作用。研究[9]表明:單一應用中藥或針刺治療AD 具有良好的療效。目前,有關針藥并用的研究相對較少,且作用機制不明確。本研究以ApoE 基因敲除小鼠作為研究對象,觀察化痰祛瘀法針藥并用對ApoE 基因敲除小鼠認知功能的影響,探討其可能的作用機制。
1 材料與方法
1.1實驗動物、實驗藥品、主要試劑和儀器選取50 只SPF 級8 周齡ApoE 基因敲除小鼠和10 只同齡具有相同遺傳背景的C57BL/6J 小鼠,體質量18~22 g,所有小鼠均購于北京維通利華實驗動物技術有限公司,動物生產許可證號:SCXK (京) 2012-0001,雌雄各半,分籠飼養。飼養于遼寧中醫藥大學SPF 級動物中心,自由攝食與飲水,飼養環境:溫度22℃, 相對濕度40%~45%。 高脂飼料由膽固醇、蔗糖、蛋黃粉、豬油、膽鹽和基礎飼料等組成,由遼寧省沈陽市于洪區前民動物實驗飼料廠加工制成。二陳湯和桃紅四物湯購于遼寧中醫藥大學附屬醫院。全部藥物加水浸泡1 h 后,先武火煎煮沸騰后調至文火煎煮,每份藥物煎煮3 次,混合后濃縮為分別含 有 生 藥 量 為 0.72 、 1.44 和2.89 g·L-1的煎劑,保存于4℃冰箱中備用。磷脂酰 肌 醇-3- 激 酶 (phosphatidylinositol-3-kinase,PI3K)、蛋白激酶B (protein kinase B,AKT) 和哺乳動物雷帕霉素靶蛋白(mamalian target of repamycin,mTOR) 一抗(美國Abcam 公司),β -actin 一抗、免疫組織化學SP 試劑盒和DAB 顯色劑和辣根過氧化物酶標記的二抗(北京中杉金橋公司),蘇木素、WB 和IP 細胞裂解液(上海碧云天公司), ECL 超敏發光試劑盒(美國Thermo 公司)。 中研太和牌一次性使用無菌針灸針(0.25 mm×13.00 mm,北京健樂康醫持器械有限公司),Morris 水迷宮由遼寧中醫藥大學重大科研平臺動物行為學實驗室提供, EPS300 型電泳儀(意大利SCOTSMAN 公司),VE-180 型電泳槽和VE-186 型轉膜儀(上海天能公司),LX300 型微量離心機和TS-1000 水平搖床(江蘇省海門市其林貝爾儀器制造有限公司),高速臺式冷凍離心機(安徽嘉文儀器裝備有限公司), 數碼顯微鏡(日本Olympus 公司),透射電鏡(型號H-7650,日本日立公司)。
1.2實驗分組和造模50 只8 周齡ApoE 基因敲除小鼠以高脂飼料喂養, 16 周后ApoE 基因敲除小鼠隨機分為模型組、低劑量中藥組、高劑量中藥組、針藥組和針刺組,每組10 只;10 只同齡C57BL/6L 小鼠以普通飼料喂養,作為對照組。ApoE 基因敲除小鼠繼續給予高脂飼料喂養,同時施加干預因素;C57BL/6J 小鼠繼續給予普通飼料喂養,不進行干預。
1.3各組小鼠給藥方式從第17 周開始,低劑量中藥組和高劑量中藥組小鼠分別于單日給予含有生藥 量 為0.72 和2.89 g·mL-1中 藥 煎 劑 灌 胃, 每 次0.2 mL;雙日以膠帶固定于木板上,持續15 min。針藥組小鼠單日給予含有生藥量為1.44 g·mL-1(相當于中劑量中藥組,各劑量組間給藥劑量間距依據《藥理實驗方法學》,設定為彼此2 倍關系)中藥煎劑灌胃,每次0.2 mL;同時雙日以膠帶固定于木板上,并予以針刺百會、關元和豐隆穴,每次針刺15 min 干預。針刺組小鼠單日經口灌胃蒸餾水0.2 mL; 雙日以膠帶固定, 并給予針刺干預,方法同針藥組。模型組小鼠單日每只給予0.2 mL蒸餾水灌胃;雙日以膠帶固定于木板上, 持續15 min。對照組不進行處理。上述各組小鼠的干預方法共計持續8 周。
針刺取穴:采用膠帶將小鼠固定于木板上,仰臥位,依照《常用實驗動物穴位的標準化定位方法研究》[10],選取百會、關元和豐隆穴。百會向后平刺2~3 mm, 關 元 穴 向 恥 骨 聯 合 方 向45° 斜 刺1.5 mm,豐隆直刺3.0 mm。
1.4樣本采集末次干預后1 h,采用水迷宮方法檢測各組小鼠認知功能。水迷宮實驗結束后,所有小鼠采用過量麻醉法處死,置于冰盤上,開顱取腦。將所取腦組織分為左腦和右腦,每組隨機選取2 只小鼠左腦海馬組織,切成1 mm×1 mm×1 mm組織塊,固定于2.5% 戊二醛溶液中,用于電鏡觀察自噬體;剩余8 只小鼠的左腦浸泡于4% 多聚甲醛溶液中,用于免疫組織化學檢測;從所有小鼠的右腦中分離海馬組織, 置于1.5 mL 凍存管中,- 80℃冰 箱 保 存, 用 于Western blotting 法檢測。
1.5水迷宮實驗檢測各組小鼠逃避潛伏期采用Morris 水迷宮實驗檢測各組小鼠逃避潛伏期,評估小鼠空間學習和記憶能力。 將小鼠放置在充滿水(21 ℃~22 ℃,通過添加奶粉使其不透明) 的圓形池(直徑104 cm) 中的不同起始位置。 訓練各組小鼠尋找平臺(直徑8 cm),該平臺通過使用遠距離視覺提示淹沒在水面以下1 cm 處,并位于水池的西北象限中。 視覺提示出現在水池周圍的四壁上,距離為0.5 m。 在所有實驗中,視覺觀察者均在房間中,并且始終位于同一位置(在圍繞設備的窗簾后面)。連續5 d, 小鼠每天進行3 次采集試驗(60 s 內小鼠爬上平臺并停留≥5 s,則本次測試結束,所經歷時間記作本次實驗的逃避潛伏期。若在60 s 內小鼠未找到平臺,則潛伏期記作60 s,并將小鼠放上平臺,停留10 s,便于小鼠學習與適應。最后將小鼠擦拭干凈置入鼠籠)。起始位置是隨機選取除目標象限的任一象限,按照上述方法從入水象限順時針方向(除目標平臺所在象限以外) 依次對各象限進行記錄,記錄小鼠尋找平臺的時間,即逃避潛伏期。
1.6各組小鼠海馬組織的超微結構觀察水迷宮實驗結束之后,所有實驗小鼠采用0.3% 戊巴比妥鈉(30 mg·kg-1) 腹腔注射麻醉后將小鼠仰臥,四肢固定于手術臺上,暴露胸腹部,常規消毒,開胸進行心尖快速灌注0.9% 氯化鈉溶液,觀察肝臟顏色至白色后停止灌注,在冰盤上開顱取腦。將所取腦組織分別按照電鏡檢測、 免疫組織化學和Western blotting 樣本要求制備,然后置于-80℃冰箱保存待檢。取每組5 只小鼠的海馬組織切成1 mm×1 mm×1 mm 的組織中,置于含2.5%戊二醛的緩沖液(4 ℃、pH 7.4) 中固定4 h,經漂洗、脫水和浸透后,常規電鏡包埋,超薄切片,片厚80 nm,每組每只小鼠海馬組織切5 張切片,每張切片隨機選取3~5 個視野。并在醋酸雙氧鈾及檸檬酸鉛雙重染色后,在透射電鏡下觀察自噬泡、自噬溶酶體和溶酶體的形態表現。
1.7 Western blotting法檢測各組小鼠海馬組織中PI3K、AKT和mTOR蛋白表達水平取出各組小鼠的海馬組織,自然融化,于100 mg 海馬組織加入1 mL 裂解緩沖液, 研磨均勻后靜置30 min,4 ℃、1 2000 r·min-1離心15 min,取上清液。測定蛋白濃度,然后按1∶4 的比例加入5×SDS-PAGE蛋白上樣緩沖液,混勻,100℃水浴鍋加熱5 min,充分變性蛋白。 SDS-PAGE 電泳, 轉膜, 漂洗5 min,5% 脫脂奶粉室溫封閉處理1 h。分別加入相應的抗體孵育(PI3K 稀釋度為1∶400;AKT 稀釋度為1∶500;mTOR 稀釋度為1∶200),緩慢搖動,4 ℃孵育過夜。次日洗膜后, 加入二抗(1∶1 500), 室 溫 孵 育2 h。 加 入 洗 滌 液 TBST ,10 min×3 次。將PVDF 膜放置于凝膠成像分析系統中,避光配置ECL 發光液,并滴加在PVDF 膜上,反應1 min。采用凝膠成像分析系統自帶分析軟件測定條帶的灰度值,以各目的蛋白與內參蛋白β-actin 條帶灰度值的比值作為該蛋白表達水平。
1.8免疫組織化學法檢測各組小鼠腦組織中PI3K、AKT和mTOR蛋白表達水平取多聚甲醛固定的各組小鼠腦組織,經自來水充分沖洗,常規脫水、浸蠟和包埋,制備石蠟塊,然后以石蠟切片機將石蠟塊進行冠狀位連續切片,切片厚度5 μm,撈片后60 ℃烤片2 h, 常規脫蠟后, 進行抗原修復,采用免疫組織化學SP 法檢測各組小鼠腦組織中PI3K、 Akt 和mTOR 的表達。 PI3K、 AKT 和mTOR 一抗稀釋度為1∶300,4 ℃過夜;次日洗片后,孵育二抗工作液,室溫下孵育60 min,PBS緩沖液洗片后,DAB 顯色,蘇木精復染,1% 鹽酸乙醇分化,透明、脫水后中性樹膠封片。檢測吸光度(A) 值,并以A 值代表各蛋白表達水平。
1.9統計學分析采用SPSS 21.0 統計軟件對數據進行統計學分析。各組小鼠逃避潛伏期和小鼠海馬組織中PI3K、AKT 及mTOR 蛋白表達水平均呈正態分布,以±s表示,多組間樣本均數比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗。以P<0.05 為差異有統計學意義。
2 結 果
2.1各組小鼠逃避潛伏期Morris 水迷宮定位航行實驗中,隨著學習天數的增加,每組小鼠逃避潛伏期均縮短。模型組小鼠逃避潛伏期均長于對照組(P<0.05);與模型組比較,針藥組小鼠的逃避潛伏期明顯縮短(P<0.05)。見圖1。
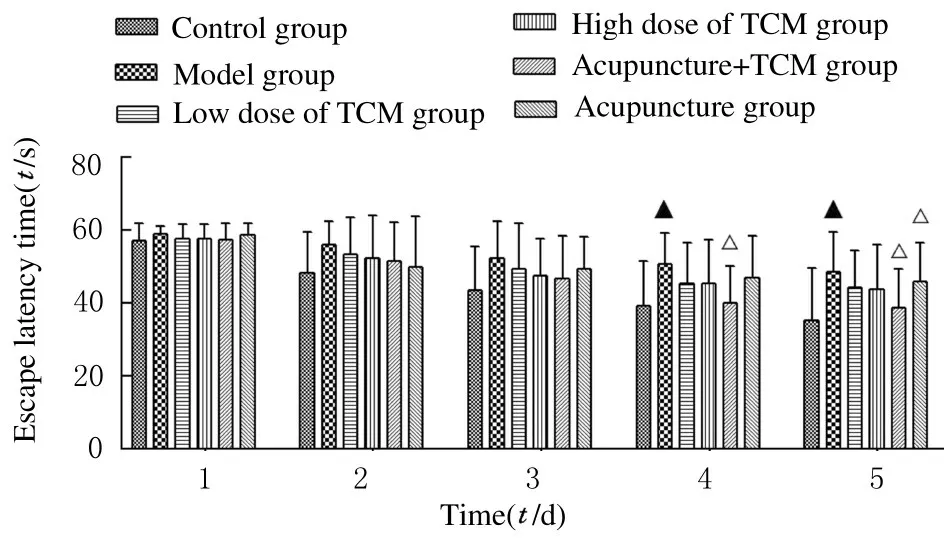
圖1 各組小鼠逃避潛伏期Fig.1 Escape latency time of mice in various groups
2.2各組小鼠海馬組織超微結構電鏡下可見對照組小鼠海馬神經元結構清晰,線粒體結構完整,核膜光滑,可見自噬泡;與對照組比較,模型組小鼠海馬組織中線粒體腫脹,核膜粗糙不完整,線粒體嵴斷裂變形,自噬泡減少;與模型組比較,中藥組、針藥組和針刺組小鼠海馬組織中可見神經元部分不規則變形、萎縮,胞質內可見較多自噬泡,病理改變均有改善, 尤以針藥組減輕最為明顯。見圖2。
2.3 Western blotting法檢測各組小鼠海馬組織中PI3K、AKT和mTOR蛋白表達水平與對照組比較, 其余各組小鼠海馬組織中PI3K、 AKT 和mTOR 蛋白表達水平明顯升高(P<0.05);與模型組比較,各劑量中藥組、針刺組和針藥組小鼠海馬組織中PI3K、AKT 和mTOR 蛋白表達水平明顯降低(P<0.05)。見圖3 和圖4。
2.4免疫組織化學法檢測各組小鼠海馬組織中PI3K、AKT和mTOR蛋白表達水平與對照組比較, 其余各組小鼠海馬組織中PI3K、 AKT 和mTOR 蛋白表達水平明顯升高(P<0.05);與模型組比較,各劑量中藥組、針刺組和針藥組小鼠海馬組織中PI3K、AKT 和mTOR 蛋白表達水平明顯降低(P<0.05)。各蛋白表達水平見圖5,各蛋白表達情況見圖6~圖8 (插頁一和插頁二)。
3 討 論
ApoE 缺陷型小鼠顯示出促動脈粥樣硬化的脂蛋白譜,最終導致動脈粥樣硬化。當飼喂高脂飲食時,ApoE 缺陷型小鼠表現出血腦屏障功能障礙和神經退行性變的跡象[11-12],出現認知功能障礙,已被驗證為實驗性AD 模型[13]。 本課題組前期研究[14] 顯示:ApoE 基因敲除小鼠認知能力的降低與海馬內自噬受損有關。針藥并用對ApoE 基因敲除小鼠進行干預可通過上調小鼠海馬組織中自噬水平從而改善其認知功能。
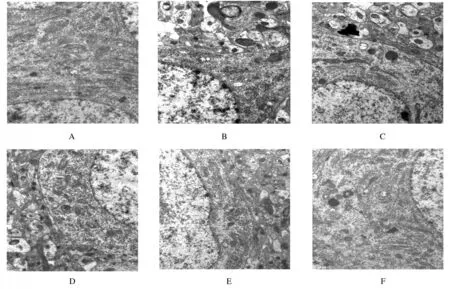
圖2 透射電鏡下觀察各組小鼠海馬組織超微結構(×20 000)Fig.2 Ultrastructures of hippocampus tissue of mice in various groups observed under transmission electron microscope(×20 000)
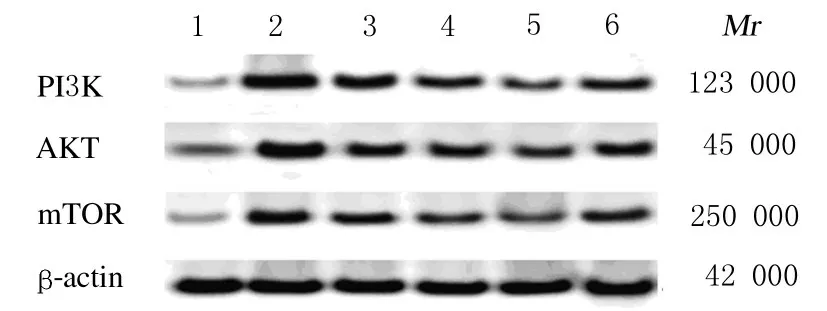
圖3 各組小鼠海馬組織中PI3K、AKT 和mTOR 蛋白表達電泳圖Fig.3 Electrophoregram of expressions of PI3K, AKT,and mTOR proteins in hippocampus tissue of mice in various groups

圖4 各組小鼠海馬組織中PI3K、AKT 和mTOR 蛋白表達水平Fig.4 Expression levels of PI3K, AKT,and mTOR proteins in hippocampus tissue of mice in various groups
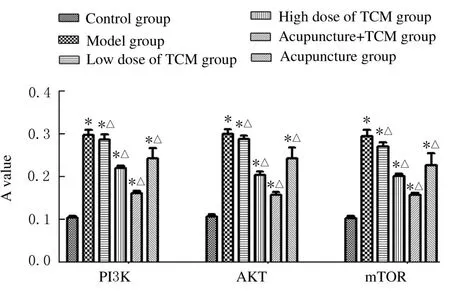
圖5 各組小鼠海馬組織中PI3K、AKT 和mTOR 蛋白表達水平Fig.5 Expression levels of PI3K, AKT, and mTOR proteins in hippocampus tissue of mice in various groups
基于痰瘀互結為認知功能障礙的發病關鍵。本研究采用針藥并用以 “化痰祛瘀,醒腦開竅”。二陳湯燥濕化痰、理氣和中,桃紅四物湯養血活血、祛瘀生新。基于痰瘀同屬于陰,同氣相求,相互為病,使疾病遷延難愈。因此治療時多聯合應用二陳湯和桃紅四物湯[14-15]。百會、關元二穴,一陰一陽,配伍為用,通達督任,使血脈充盈,腎精充沛,腦髓得養,共奏益髓健腦之功。豐隆為 “祛痰要穴”,有 “間接入腦” 一說,針刺豐隆可抑制炎癥因子的釋放,改善脂代謝,同時,也常用來治療認知功能障礙疾病[16-17]。針藥并舉,內外兼治,起到事半功倍的效果。中醫認為痰為濁邪,而心神性清凈,故痰濁致病,易蒙蔽清竅,阻遏清陽,而致健忘,癡呆。清代陳士鐸云認識到:“痰積于胸中,盤踞于心外, 使神明不清而成呆病矣”、 并提出“治呆無奇法,治痰即治呆。” 而大臨床上多應用具有化痰開竅作用的方劑如溫膽湯、 滌痰湯治療AD,且療效突出[18]。同時,《傷寒論》 曰:“陽明病,使人善忘者,必有蓄血,所以然者,本有久瘀血”。治療以抵當湯,祛逐瘀血,使氣血得以榮養腦髓,使腦絡復暢。《醫林改錯》 中也提到:“凡有瘀血皆令人善忘”。均證明血瘀也是本病形成的重要原因之一。痰濁與瘀血,由津液和血液運化失常所產生的病理產物,“津血同源”,故 “痰瘀同源”。痰瘀互為因果,相互影響,常相兼為病,進一步加重氣血運行障礙,使疾病遷延難愈。“痰” 和 “瘀” 為AD 病機的關鍵因素[19]。越來越多的證據表明,自噬功能障礙與異常的蛋白聚集所致的神經退行性疾病(如AD) 密切相關[20]。當自噬的調節能力下降時,影響細胞識別及降解受損線粒體的能力,從而使破損或衰老的細胞器、長壽命蛋白質、錯誤合成或折疊錯誤的蛋白質等物質的過度堆積,最終產生病理性產物 “垃圾”。這一病理過程與中醫的內生痰濁瘀血過程相同。
實驗小鼠因ApoE 基因被敲除而更容易出現脂質代謝紊亂,血脂異常堆積使得發生血管內皮炎性損傷進而受到氧化應激的損害,最終出現認知功能障礙。本研究采用Morris 水迷宮檢測小鼠水中學習尋找隱藏平臺的能力,以此來判定小鼠的空間學習和記憶能力。實驗結果顯示:對照組小鼠游泳動作嫻熟,速度快,往往很快就能找到平臺,即對照組小鼠的學習及記憶能力強; ApoE 基因敲除的模型組小鼠游泳動作笨拙,速度慢,需要花長時間才能找到平臺,說明ApoE 基因與記憶認知能力有相關性。張 寧 等[21]發 現:ApoE 基 因 敲 除 小 鼠 海 馬 神經組織中Aβ 表達水平明顯高于正常小鼠,ApoE 基因的異常表達與AD 的發病有密切關系。經過針藥并用干預后,小鼠逃避潛伏期縮短,證明基于化痰祛瘀法的針藥并用干預方案能夠改善APOE 基因敲除小鼠的認知功能。
研 究[22]證 明:損 害 神 經 元 的Aβ 異 常 沉 積 是誘導AD 發生發展的核心因素,而AD 患者腦組織中均有不同程度自噬功能的損傷,無法及時減少Aβ 的生成和清除Aβ,最終引發AD。電鏡下觀察小鼠海馬的超微結構結果顯示:對照組小鼠海馬內細胞器豐富且有大量的自噬泡和溶酶體;ApoE 基因敲除小鼠海馬內的自噬泡和溶酶體的數量減少,提示ApoE 基因敲除可能損害了小鼠海馬組織中神經元,并且自噬過程發生了異常變化;而經過針藥干預后,海馬組織中的自噬泡及溶酶體數量增多,提示針藥干預可以增強自噬途徑以此來改善ApoE基因敲除小鼠的學習和記憶能力。為探討可能的作用機制,本研究采用Western blotting 和免疫組織化學法檢測各組小鼠海馬組織中PI3K、 AKT 和mTOR 蛋白的表達情況。
PI3K/AKT/mTOR 信號通路作為與細胞自噬密切相關的轉導通路,參與和調節許多細胞活性,如細胞存活、增殖和生長等[23]。PI3K 分為Ⅰ型、Ⅱ型和Ⅲ型,而PI3K/AKT/mTOR 通路是指Ⅰ型PI3K,PI3K 作為自噬的負調節因子,其磷酸化水平在調節細胞增殖和死亡中發揮著關鍵作用。AKT 參與各種信號通路的調節, 包括細胞增殖、生長、存活、血管生成和化療耐藥等[24],AKT是PI3K 的下游效應子和mTOR 的上游調節分子。mTOR 作為AKT 的直接靶點,被AKT 磷酸化激活后,不同的下游通路得到調控,特定的蛋白質合成得到控制,進而參與了細胞的自噬和凋亡。此外,mTOR 可抑制自噬體復合物形成所需的相關蛋白,從而抑制自噬,被認為是自噬的負調節物。多數藥物通過下調PI3K/Akt/mTOR 途徑或抑制mTOR 從而誘導自噬[25-26]。本研究結果顯示:模型組小鼠海馬組織中PI3K、AKT 和mTOR 蛋白表達水平明顯高于對照組,說明ApoE 基因敲除小鼠PI3K/AKT/mTOR 的信號通路被激活,該結果與張利達等[27]的實驗結果一致。采用針藥并用干預后,針藥組小鼠海馬組織中PI3K、AKT 和mTOR的蛋白表達明顯低于模型組,由此推測化痰祛瘀法針藥并用可能通過抑制PI3K/AKT/mTOR 的信號通路來增強細胞自噬現象,以此改善認知障礙。
綜上所述, 化痰祛瘀法針藥并用可以上調PI3K、AKT 和mTOR 蛋白表達水平,抑制PI3K/AKT/mTOR 信號通路的異常激活,緩解或增強細胞的自噬途徑作用, 以此達到恢復認知能力的作用。

