多重復合誘變選育金霉素高產菌株
蔡玉鳳

摘 要: 為提高金色鏈霉菌產金霉素水平,增大突變多樣性,研究常壓室溫等離子體(ARTP)、紫外線與氯化鋰復合誘變對構建金色鏈霉菌突變庫的影響。結合前體物及高濃度產物耐受性確定篩選模型,通過初篩及搖瓶復篩,選育獲得2株菌落形態特性改變、金霉素效價較出發菌株提高20%以上,且其高效價特性穩定的高產金霉素突變菌株。基于多重復合誘變和前體/產物耐受構建了高產菌株選育模型,不僅突變庫的多樣性更高,而且簡便快捷,提高了篩選效率,并減少篩選工作量,對金霉素及其他鏈霉菌來源抗生素的生產成本降低和產能提高都具有一定的應用價值和指導意義。
關鍵詞: 金霉素;常壓室溫等離子體誘變;耐受性;復合誘變;篩選
中圖分類號: R978文獻標志碼: A文章編號: 0253-2301(2020)06-0001-06
DOI:10.13651/j.cnki.fjnykj.2020.06.001
Breeding of High-yield Aureomycin Strain by Multiple Complex Mutagenesis
CAI Yu-feng
(Fuzhou Industrial Microorganism Technology Co., Ltd., Fuzhou, Fujian 350007, China)
Abstract:In order to improve the production level of aureomycin by? Streptomyces aureus? and increase the diversity of mutations, the effects of atmospheric pressure room temperature plasma (ARTP), ultraviolet radiation and lithium chloride mutagenesis on the construction of the mutant library of streptomyces aureus were studied. The screening model was established by overcoming the tolerance of precursors and a high concentration of products. Then, after the primary screening and shake flask re-screening, two mutant strains with high yield of aureomycin and stable high potency were selected, of which the colonial morphological characteristics were changed and the aureomycin potency was increased by more than 20% compared with the original strain. Based on the multiple complex mutagenesis and precursor/product tolerance, the screening model of high-yield strains was established, which not only increased the diversity of the mutant library, but also improved the screening efficiency and reduced the screening workload. It had certain application value and guiding significance for reducing the production cost and increasing the production capacity of aureomycin and other antibiotics from streptomyces.
Key words:Aureomycin; ARTP mutation; Tolerance; Complex mutagenesis; Screening
金霉素chlortetracycline分子式為C 22 H 23 ClN 2O 8,分子量478.88,結構式如圖1所示,是由金色鏈霉菌 Streptomyces aureofaciens 發酵產生的四環素類廣譜抗生素。金霉素以其抑菌、促生長、飼料利用率高、在肌體內殘留量低的特點以及其生產技術成熟和生產成本低的優點,成為在飼料工業中用量最大的抑菌促生長劑[1] 。金色鏈霉菌是重要的藥用微生物,屬于高度好氣、革蘭氏陽性放線菌。然而,目前金霉素生產菌株產金霉素水平相對較低(金霉素發酵效價常在 18 000 μg·mL-1 左右)[2] ,嚴重影響了生產效益。
抗生素的高產菌株誘變育種方法包括物理或化學誘變[3] 、原生質體誘變[4-5] 等,程序簡單,突變類型豐富,被廣泛應用于科研及生產領域高產菌株的選育。但是金色鏈霉菌經過多次傳統誘變,經常出現誘變效率低、負變率高、易回復突變等現象,且反復誘變常產生誘變飽和效應,使產量難以提高。與傳統常規誘變方法相比,常壓室溫等離子體(atmospheric and room temperature plasma,ARTP)誘變系統具有操作簡便、設備簡單、條件溫和、安全性高、誘變快速、產生突變的多樣性大等特點,已成功應用于細菌、藻類、真菌、放線菌等多種微生物的菌種選育,并篩選到高產突變株[6-10] 。紫外線誘變中加入誘變劑氯化鋰可以提高誘變效率,誘變效果更好[11] 。常壓室溫等離子體、紫外線和氯化鋰復合處理金色鏈霉菌,誘變損傷更多樣化,其誘變效應顯著,獲得比單一誘變更多的突變類型,從而增加誘變庫的多樣性,大大提高獲得高產突變株的概率。
1 材料與方法
1.1 試驗材料
1.1.1 試驗菌株 金色鏈霉菌菌株FJ0084(由工業微生物教育部工程研究中心保藏提供)。
1.1.2 培養基 斜面及固體平板培養基:麩皮30g·L-1 ,硫酸鎂0.01g·L-1 ,磷酸二氫鉀0.01g·L-1 ,磷酸氫二胺0.03g·L-1 ,瓊脂20g·L-1 ,pH自然。
種子培養基: 玉米淀粉30g·L-1 ,花生餅粉10g·L-1 ,黃豆餅粉15g·L-1 ,酵母粉5g·L-1 ,硫酸銨4g·L-1 ,碳酸鈣4g·L-1 ,氯化鈉3g·L-1 ,硫酸鎂0.1g·L-1 ,磷酸二氫鉀0.1g·L-1 ,豆油0.8g·L-1 ,pH自然,裝量為25 mL三角瓶(250 mL)。
發酵培養基: 玉米淀粉80g·L-1 ,花生餅粉30g·L-1 ,玉米粉20g·L-1 ,蛋白胨15g·L-1 ,黃豆餅粉15g·L-1 ,玉米漿8g·L-1 ,酵母粉3g·L-1 ,碳酸鈣5g·L-1 ,氯化鈉3.4g·L-1 ,硫酸銨4g·L-1 ,硫酸鎂0.2g·L-1 ,磷酸二氫鉀0.1g·L-1 ,淀粉酶0.02g·L-1 ,豆油25g·L-1 ,pH自然,裝量為25 mL三角瓶(250 mL)。
1.1.3 單孢子懸液制備 將培養好的金色鏈霉菌斜面加入20 mL無菌水,輕輕刮下成熟孢子,倒入帶有玻璃珠的100 mL三角瓶中振搖20 min,制備濃度 107~ 108 個·mL-1 單孢子懸液。
1.2 試驗方法
1.2.1 金色鏈霉菌FJ0084的培養方法 斜面活化培養:接種后于34℃培養箱,培養4 d;搖瓶種子培養:培養好的菌株斜面加入5 mL無菌水,刮下成熟孢子,制備得孢子懸液,接種1 mL至25 mL種子培養基中,30℃、270r·min-1 培養22 h;搖瓶發酵培養:以10%的移種量移入發酵培養基中,30℃、270r·min-1 培養6 d。
1.2.2 金霉素耐受性試驗 制備不同濃度金霉素耐受性種子培養基,終濃度為0、 2 000 、 3 000 、 4 000 、 5 000 μg·mL-1 ,將金色鏈霉菌的單孢子菌懸液接種于金霉素耐受性種子培養基,30℃、270r·min-1 培養16 h,然后稀釋涂布于平板34℃培養5 d,觀察菌落形態并計算菌落數。
1.2.3 NaCl耐受試驗 大多數微生物在0.5%~3.0%的鹽濃度范圍內可正常生長[12] ,為提高金色鏈霉菌對前體物的耐受性,制備濃度0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%的NaCl平板,將金色鏈霉菌的單孢子菌懸液稀釋涂布于NaCl平板,34℃培養7 d,觀察菌落形態并計算菌落數。
1.2.4 ARTP誘變處理 ARTP誘變儀設置:以氦氣作為工作載氣,設定功率為110 W,工作氣量10 SLM。取900 μL單孢子懸液,加入100 μL 50%甘油,充分混勻后吸取10 μL均勻涂在載片上,使孢子懸液均勻覆蓋在載片的表面,處理時間梯度設為0、20、40、60、80、100、120 s。處理結束后將載片上的孢子全部洗脫下來,適當梯度稀釋后并取100 μL涂布于平板培養基,每組3個平行,
34℃避光培養5 d,通過平板菌落計數,計算致死率,繪制致死率曲線。
1.2.5 紫外線 LiCl復合誘變 取單孢子懸液于無菌培養皿中(每皿加5 mL),在磁力攪拌器攪拌下,置于30 cm處,功率20 W的紫外燈下,照射時間為0、10、20、30、40、50、60 s。適當梯度稀釋后涂布至含有1.0% LiCl的分離平板上,每組3個平行,34℃避光培養5 d,通過平板菌落計數,繪制致死率曲線。
1.2.6 ARTP 紫外線 LiCl復合誘變 將單孢子菌懸液進行ARTP誘變處理后再進行紫外線誘變,接種于金霉素耐受性種子培養基,30℃、270r·min-1 培養8 h,進行適當梯度稀釋后涂布至含有1.0% LiCl和2.0% NaCl的分離平板上,每組3個平行,34℃避光培養5 d,挑取單菌落,通過搖瓶發酵,計算致死率和突變率。
1.2.7 高產菌的發酵篩選 根據菌落生長的形態、顏色、大小和背部色素,挑取單菌落,按1.2.1方法培養,6 d后按1.3.1方法測定其效價,從初篩高于對照10%以上的突變菌株中進行搖瓶復篩,每批3個平行樣,選取搖瓶效價高、發酵穩定的菌株進行保藏傳代。
1.2.8 穩定性試驗 對誘變復篩后的高產突變株傳5代,按1.2.1方法培養發酵,6 d后按1.3.2方法測定其效價,主要考察突變株孢子的外觀及發酵水平的穩定性。
1.3 測定方法
1.3.1 化學法測定金霉素效價 化學測定法的原理是根據金霉素在酸性溶液中加熱脫去一分子水,生成黃色的脫水金霉素,其比色度與含量成正比,此性質符合比爾定律,因此用比色法來測定金霉素的效價[13] 。取10 g發酵液經草酸酸化過濾后,分別吸取0.1 mL濾液和5 mL 2mol·L-1 鹽酸溶液于2個100 mL容量瓶中,一份作為空白對照,另一份于沸水浴中加熱5 min,冷卻后加蒸餾水定容至刻度,搖勻后于440 nm波長測定吸光值,將吸光值代入公式(1)中計算發酵液效價。
效價(μg·mL-1 )= A-b k × V2 V1 (1)
式中, b 為金霉素工作曲線回歸方程中的截距; k 為金霉素工作曲線回歸方程中的斜率; A 為測得的吸光值; V 1為吸樣體積; V 2為容量瓶體積。
1.3.2 HPLC法測定金霉素效價 參照中國藥典2005年版第二部金霉素的高效液相色譜測定法[14] ,色譜柱:C8(75 mm×4.6 mm,3.5 μm),柱溫45℃;檢測波長為280 nm,流速:0.4mL·min-1 ;流動相∶ 高氯酸∶ 二甲亞砜∶ 水(8∶525∶ 467) 為流動相(pH<2.0);流速為1.0mL·min-1 ;發酵液樣品處理參照化學測定法處理,根據估計效價將濾液適當稀釋后取10 μL進樣測定。
2 結果與分析
2.1 金霉素耐受性選擇試驗
金霉素作為金色鏈霉菌的次級代謝產物,產量與其對終產物的耐受性有關,因此取其產物鹽(金霉素鹽酸鹽)為底物,用于高耐受突變株的選育。金色鏈霉菌在不同濃度的金霉素耐受性培養基上的生長情況如表1所示,隨著金霉素濃度的增大,金色鏈霉菌單菌落數逐漸減少,生長緩慢產孢少;金色鏈霉菌在對照平板培養基的菌落形態如圖2a所示,圖2b、2c、2d、2e分別為2 000、3 000、 4 000 、5 000μg·mL-1 金霉素耐受性培養基上金色鏈霉菌的菌落形態。由于鹽酸金霉素的室溫溶解度只有 8 600 μg·mL-1 ,只能過濾除菌,且不可高溫滅菌,金霉素耐受性培養基終濃度最多增大到 5 000 μg·mL-1 。因此,金霉素耐受性選擇培養基耐受濃度設置為 5 000 μg·mL-1 作為后續篩選高產菌株的選擇壓力濃度。
2.2 NaCl耐受試驗
氯離子為金霉素合成的前體物,因此從對氯離子耐受的突變株中獲得高產金霉素菌株的可能性更高。金色鏈霉菌在對照平板培養基的菌落形態如圖3a所示,隨著氯化鈉濃度的增大,金色鏈霉菌生長緩慢,菌落數減少,產孢少,菌落形態、顏色、大小也明顯受濃度影響,金色鏈霉菌在2.0% NaCl培養基上基本表現為4種菌落形態(圖3b、3c、3d、3e),圖3b形態菌落較小而突起,黑色,表面光滑;圖3c形態菌落黃褐色突起,表面光滑;圖3d形態菌落略有皺褶,白色菌絲;圖3e形態菌落較小,白色。當氯化鈉濃度增加到3.5%時,只有4個透明小菌落,可能是高滲溶液的Na +離子影響了細胞和培養基的滲透壓,抑制了菌體生長繁殖。為便于挑選突變菌株,盡可能提高金色鏈霉菌對前體物 Cl - 離子的耐受性,因此選擇NaCl的耐受濃度為2.0%。
2.3 ARTP誘變處理
不同ARTP誘變處理時間對金色鏈霉菌致死情況如圖4所示,誘變40 s時致死率已達79.1%,當誘變時間為120 s時已完全致死。現代育種理論認為,在更高的致死率下,雖然突變率可能較高,?但負突變率也很高,而正突變率卻很低,當致死率在70%~80%時,產量性狀的正突變率較高[15] 。因此,致死率過高或過低都不利于突變菌株的篩選,為利于突變菌株的進一步篩選,選擇誘變時間為 40 s。
2.4 紫外線 LiCl復合誘變處理
從圖5可以看出,金色鏈霉菌對紫外線非常敏感,在紫外線的作用下,照射時間越長,致死率越高,紫外線照射處理20 s,致死率就達到78.6%,而處理50 s,幾乎全部致死,為提高獲得高產菌株的概率,選擇紫外線照射時間為20 s。
2.5 ARTP 紫外線 LiCl復合誘變
將金色鏈霉菌單孢子菌懸液先通過ARTP誘變處理40 s后,進行紫外線照射20 s,結合前體物及高濃度產物耐受性選育,每組3個平行,ARTP 紫外線 LiCl復合誘變致死率達到91.6%,挑取?2 355 株突變株,通過搖瓶發酵,進行突變率的統計,金色鏈霉菌菌株正突變率達5.7%。
2.6 高效價菌株的發酵篩選
研究過程中發現菌落生長的形態、顏色、大小及背部色素對金色鏈霉菌的效價有一定的影響,因此通過前體物、高濃度產物耐受性選育,以及菌落形態的確定,可以建立簡便快捷且高效率的高產菌株篩選方法,為突變菌株的初篩提供依據。經發酵復篩,獲得2株生長較好且效價高于對照20%以上的突變菌,結果見表2,其中FAL 065變株為淺綠色菌落,孢子較為飽滿,背部色素較深(圖6b);FAU 083變株為鼠灰色銅錢狀菌落,中心有小孔,孢子飽滿(圖6c)。其中FAL 065變株的菌落顏色與出發菌株差異較大,說明重復合誘變方法確實使金色鏈霉菌損傷更多樣化,遺傳信息多樣性更好,產生了新的遺傳性狀,其誘變效應顯著,且可以有效地篩選到高產菌株。
2.7 穩定性試驗
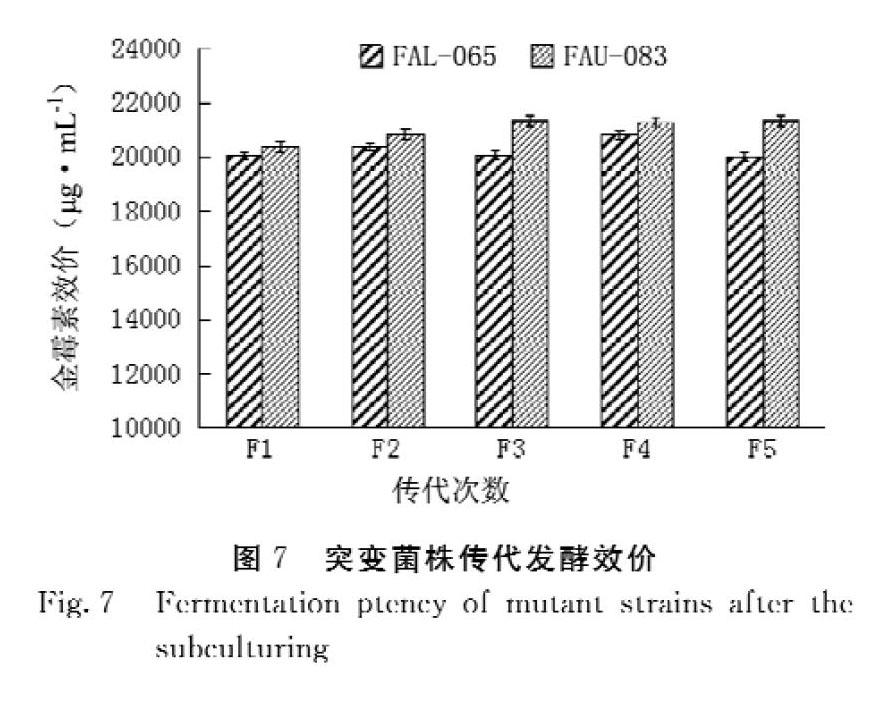
為了確保篩選到的高產突變株具有遺傳穩定性,對誘變選育后產量較高的菌株進行傳代試驗。共傳5代,每代做3個平行,結果如圖7所示。從第1代到第5代,FAL 065菌株產量平均為 20 274 μg·mL-1 , T 值為 0.236 7 ,? P > 0.05表示差異性不顯著,且突變株孢子外觀性狀穩定, FAU 083 菌株產量平均為 21 037 μg·mL-1 , T 值為 0.168 8 ,? P > 0.05表示差異性不顯著,說明這兩株突變菌株遺傳穩定性較好。
3 結論
應用常壓室溫等離子體(ARTP)、紫外線和氯化鋰對金色鏈霉菌進行復合誘變處理,增大了突變的多樣性,結合前體物及高濃度產物耐受性選育,建立了簡便快捷且高效率的高產菌株篩選模型,提高篩選效率,減少篩選工作量。最終獲得2株金霉素效價較出發菌株提高20%以上、高效價且遺傳穩定的菌株FAL 065、FAU 083,其中FAL 065變株為淺綠色菌落,孢子較為飽滿,背部色素較深,且性狀穩定,產量平均為 20 274 μg·mL-1 ,FAU 083變株為鼠灰色銅錢狀菌落,中心有小孔,孢子飽滿,產量平均為 21 037 μg·mL-1 。本研究未能解除高滲溶液對菌體生長的影響,可尋找其他帶前體物Cl -的鹽溶液進行耐受性選育。多重復合誘變方法損傷更多樣化,可以有效地篩選到高產菌株且遺傳穩定,其誘變效應顯著,這不僅對金色鏈霉菌,對其他產抗生素鏈霉菌的工業遺傳育種也同樣具有重要的參考價值。
參考文獻:
[ 1] 扶教龍,儲炬,張明,等.金霉素發酵條件優化[J].中國醫藥工業雜志,2002,33(12):583-587.
[ 2]陳梁軍.金霉素發酵工藝研究[J].海峽藥學,2010,6(22):22-25.
[ 3]王鵬飛,謝昌賢,劉運添,等.氯化鋰、紫外線對金色鏈霉菌( Streptomyces aureofaciens )產金霉素特性的誘變作用[J].微生物學雜志,2013,33(1):86-88.
[ 4]繆克排.金色鏈霉菌發酵條件優化及高產菌株選育的新方法[D].杭州:浙江大學,2005.
[ 5]賀筱蓉,李永泉,趙小立,等.原生質體誘變選育去甲基金霉素高產菌[J].杭州大學學報(自然科學版),1997,24(2):170-177.
[ 6]楊立鵬,李小剛,魏愛英,等.基于常壓室溫等離子體誘變技術選育高產色氨酸突變株的研究[J].發酵科技通訊,2015,44(1):28-32.
[ 7]FANG M,JIN L,ZHANG C,et al.Rapid Mutation of Spirulina platensis by a New Mutagenesis System of Atmospheric and Room Temperature Plasmas (ARTP) and Generation of a Mutant Library with Diverse Phenotypes [J].? PLOS ONE ,2013, 8(10):1-12.
[ 8]祝金山,吳燁飛,陸建衛.常壓室溫等離子體誘變選育核黃素高產突變株[J].發酵科技通訊,2020, 49(1): 58-62.
[ 9]袁紅梅,薛正蓮,楊心萍.常壓室溫等離子體和紫外誘變選育腺苷高產菌株[J].發酵科技通訊,2019,48(2):100-105.
[10]田淑翠,牛延寧,常忠義,等.常壓室溫等離子體(ARTP)誘變茂源鏈霉菌菌株[J].中國生物工程雜志,2016,36(9):47-53.
[11]徐親民.抗生素工藝學[M].北京:中國建材工業出版社,1994:8.
[12]施巧琴,吳松剛.工業微生物育種學[M].北京:科學出版社, 2003.
[13]王鵬飛.金霉素生產菌種的選育及發酵工藝優化研究[D].呼和浩特:內蒙古大學,2013.
[14]國家藥典委員會.中華人民共和國藥典 [M] .二部.北京:化學工業出版社,2005:539.
[15]卜美玲.納他霉素高產菌株的誘變選育及發酵工藝的優化[D].洛陽:河南科技大學,2012,37(4):81-86.
(責任編輯:柯文輝)

