一種基于端到端神經網絡的連續血壓估計模型
萬 培,桑勝波,b,張成然,b,張 博,b
(太原理工大學 a.信息與計算機學院; b.新型傳感器與智能控制教育部和山西省重點實驗室,山西 晉中 030600)
0 概述
近年來,伴隨著中國經濟的發展以及人口老齡化速度的加快,心血管疾病的患者日益增多,心血管健康的管理對連續血壓監測的要求越來越高。連續血壓測量可通過持續反饋顯著降低血液循環系統的風險,它能夠通過對慢性高血壓、壓力和急性血壓變化等疾病的即時護理來提高生活健康質量。基于袖帶加壓系統的傳統血壓測量不適合連續測量和普遍使用,特別是在可穿戴的小型傳感應用中。
使用心電圖(Electrocardiogram,ECG)和從容積脈搏波(Photoplethysmography,PPG)獲取脈搏波傳輸時間(Pulse Transmit Time,PTT)估計血壓方法,和基于PPG波形特征參數估計血壓方法在測量動脈僵硬度或發現動脈疾病的背景下被廣泛研究,單個動脈部位的脈搏波傳導速度可用于連續血壓估計[1-2]。收縮壓上升時間、舒張壓時間、2/3寬度、1/2脈搏振幅等多項脈搏波傳導參數被認為是從單個PPG信號中估計血壓的可能候選者。文獻[3-4]驗證了使用以PTT作為主要特征,從PPG信號中提取的參數作為輔助特征,運用神經網絡算法估計血壓的模型比僅使用PTT的模型[5]具有更高的精度。文獻[6]使用傳統的決策樹和boosting等時域方法對PPG波形進行建模。文獻[7]使用頻域方法從PPG波形中提取必要的特征。與基于ECG和PPG特征參數工程的方法相比,這些方法在性能上沒有明顯的改進。最近的研究表明,神經網絡可以自動提取必要的特征,而無需任何復雜的特征工程[8]。
上文討論的模型均未考慮提取特征參數相對時間的變化。人體的動脈壓力由自主神經系統和腎-體液機制調節,該機制包括多個反饋控制回路[9],其效果也可以在ECG和PPG信號中被視為調制[10],同時考慮它們的相關特征和時域變化可以提高BP的估計精度。對于復雜時間序列的建模,研究人員發現長短期記憶網絡(LSTM)[11]非常有效。文獻[12]研究結果表明,通過識別ECG和PPG的特征參數與使用深層LSTM網絡分析參數可以提高血壓估計的準確性。本文構建一個基于ECG和PPG波形的端到端神經網絡的連續血壓估計模型,該模型可以自動提取ECG和PPG波形必要的特征,其中較低層次提取必要的特征,較高層次提取特征的時域變化。
1 數據收集和預處理
1.1 數據源
本文利用Physionet的重癥監護多參數智能監測(MIMIC)I數據庫收集ECG、PPG和相應的動脈血壓(ABP)信息[13],總共收集并預處理來自不同年齡組和性別的ICU的69名患者的數據。以125 Hz的采樣頻率對ECG和PPG信號進行采樣,表1為患者的簡要描述。從表1可以明顯看出,該數據以60歲~80歲年齡組內的患者為主。在40歲~60歲和60歲~80歲年齡組中SBP的標準偏差高于DBP的相應標準偏差。

表1 Mimic I數據庫患者數據Table 1 Patient data of MIMIC I database
1.2 預處理
為消除基線漂移和噪聲,使用Tunable-Q小波變換(TQWT)對加窗信號進行帶通濾波[14]。TQWT擁有小波去噪的所有優點[15]以及小波基的可調性。在TQWT中使用Q值生成的Daubechies小波基來執行離散小波變換(DWT)。通過改變Q值,可以在頻域內對小波分解子帶進行移位,在盡可能保留形態輪廓的同時有效地去除基線漂移。Q選擇和濾波過程如圖1所示,ECG信號和PPG信號使用相同的方法。
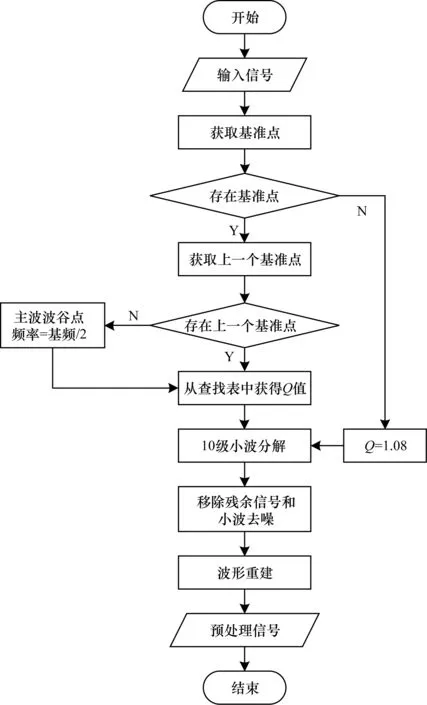
圖1 預處理方法流程Fig.1 Procedure of preprocessing method
Q選擇和濾波過程如下:
1)對加窗的ECG或PPG信號進行傅里葉變換,并歸一化處理幅度。
2)選擇頻率為1.0 Hz~3.5 Hz范圍內的峰值,選擇標準化值大于0.4的第1個峰值作為基準點。
3)選擇在步驟2)中的基準點頻率以下的凹拐點,并選擇左端最近的凹拐點作為主波波谷點。如果沒有找到凹拐點,則簡單地選擇基頻的一半作為主波波谷點。
4)使用選擇的基準點頻率以及主波波谷點的頻率從查找表中選擇Q值。查找表包括掃描范圍1.0~1.4內的Q值計算的10級子帶(小波分解)的中心頻率和-3 dB位置截止頻率。對于Q=1.0,10級子帶的中心頻率和-3 dB位置截止頻率分別為0.812 9 Hz和0.430 9 Hz,對于Q=1.4,10級子帶的中心頻率和-3 dB位置截止頻率分別為1.949 1 Hz和1.339 7 Hz。
5)選擇提供最接近基準點的中心頻率的Q值作為Q值的上限Qmax。然后在1.0~Qmax范圍內選擇另一個Q值,該值對應于最接近左端的凹拐點頻率的-3 dB位置截止頻率,該Q值即為需要的Q值。這樣既不衰減基波峰值,又保留了ECG和PPG信號的振幅。
6)如果沒有檢測到基準點,則選擇Q值為1.08。對于Q=1.08,第10級子帶的中心頻率和-3 dB位置截止頻率分別為1.002 0 Hz和0.573 5 Hz。在這種情況下,很可能ECG或PPG信號被偽像嚴重破壞,并且可能無法提取到需要波形的大多數特征。去除含有直流分量和基線漂移的剩余信號,使用預先設置的軟Rigrsure閾值[16]的小波去噪。最后得到了既無基線漂移又無高頻噪聲的ECG和PPG信號。
2 連續血壓估計模型
本文構建的基于端到端神經網絡的人體血壓估計模型包含兩個層次結構,下層使用ANN從ECG和PPG波形的單個實例中學習波形特征,上層使用LSTM學習下層提取的特征之間的時間關系。圖2為ECG和PPG波形特征提取示意圖,圖3為輸入數據準備過程的流水線,圖4為基于ECG和PPG波形的端到端神經網絡的連續血壓估計模型。

圖2 ECG和PPG波形特征提取示意圖Fig.2 Schematic diagram of ECG and PPG waveformfeature extraction

圖3 輸入數據準備過程的流水線框圖Fig.3 Block diagram of input data preparation process

圖4 基于端到端神經網絡的連續血壓估計模型Fig.4 Continuous blood pressure estimation modelbased on end-to-end neural network
2.1 特征變量選擇
根據血流動力學理論,當外周阻力較低及血管彈性較好時,脈搏波波形特征是主波窄而高,重搏波波峰和波谷都很突出。隨著外周阻力和血管壁硬化程度的增加,重搏波的波峰和波谷相對主波的位置逐漸抬高,最后混為一體不易區分,使整個脈搏波波形呈饅頭形。
本文基于脈搏波分析,從PPG和ECG的每一拍中計算出10個信息特征,如表2和圖2所示。依據血流動力學理論確定10項與血壓相關性較好的特征參數作為血壓估計模型中的特征變量。
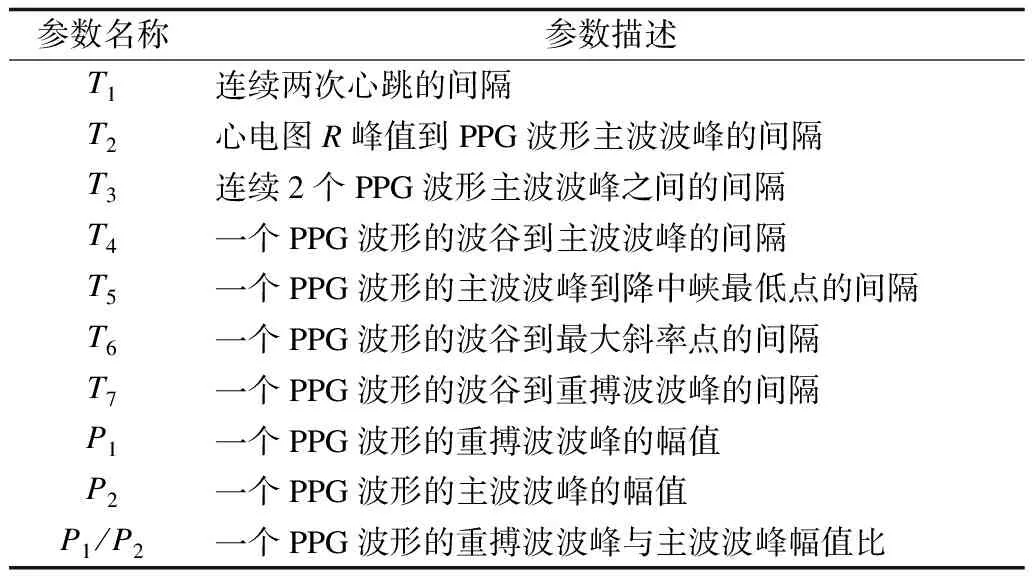
表2 ECG和PPG波形中選定特征的定義Table 2 Definitions of selected features in ECG and PPG
2.2 非均勻波形分割
本文算法對PPG和ECG波形進行非均勻波形分割,用于訓練神經網絡,分割的主要原因是ECG和PPG信號頻率的變化。心率可以低于每分鐘60次(對于心動過緩患者),由于強烈的共感神經刺激[17],心率可以上升到每分鐘200次。例如,取一個長度恒定2 s(250個樣本)的窗口,該窗口內波形的周期數可能在2個~6個周期內變化。這種不同的循環次數將在提取特征時對高HR的信號產生更大的誤差。因此,使用一個長度為連續3個心電或PPG峰(2個周期)的可變窗口,然后重新采樣到256個樣本。為了訓練學習模型,準備好輸入波形,然后反饋給神經網絡。
輸入數據的準備過程如下:
1)PPG節段長度為連續3個收縮峰(2個周期)pwi(n),i=1,2,…,M,其中M為序列波形段數,對應ECG段ewi(n),i=1,2,…,M,分別從預處理后的PPG和ECG信號pf(n)和ef(n)中提取,也可以用3r峰長度的心電段代替相應的PPG信號。
2)段長li,i=1,2,…,M由提取的ECG和PPG波形計算得到,并除以256進行歸一化。將ECG和PPG信號重采樣至256個樣本,將ECG與PPG重采樣波形ewi(mi)、pwi(mi)、歸一化段長li串聯,得到具有512個特征的向量xi,該向量是基于波形的特征向量。

1)對由3個連續峰值偏移一個峰值的M組進行上述處理,形成M個特征向量。峰的選擇為0-1-2、1-2-3、2-3-4,直到(M-1)-M-(M+1)。

2.3 血壓估計模型處理
在準備模型的輸入和輸出后,每個患者的數據分為70%用于訓練,10%用于驗證,20%用于測試。數據準備短(M=10,從16 s窗口提取,或2 000個樣本125 Hz)和長(M=32,從40 s窗口提取,或5 000個樣本125 Hz)序列,并且對兩者進行訓練。端到端神經網絡主要由兩個堆疊的LSTM層組成,并與它們連接了呈時間分布的ANN。ANN由128個具有ReLU激活功能的神經元的隱藏層組成。損失函數使用均方誤差(MSE),梯度優化使用Adam優化器[18],初始學習率為0.001。對于正則化,M=10和M=32,梯度的L2范數被約束為3和5。第1個LSTM層是雙向的[19],用于模擬2個方向的時間變化。
3 血壓估計模型的評估
使用平均絕對誤差(MAE)和均方根誤差(RMSE)作為度量來評估本文提出的模型。MAE和RMSE定義為:
(1)
(2)
其中,yM和zM分別是時間序列的第M個元素的實際值和估計的BP(SBP或DBP)。對本文模型的性能在AAMI標準上進行評估,同時對血壓估計模型進行Bland-Altman分析和Pearson相關系數分析。
3.1 與其他模型比較
表3為不同神經網絡架構的對比分析。從表3可以看出,AdaBoost模型對于DBP估計具有可接受的誤差,但是對于SBP估計具有較高的誤差。基于LSTM的模型可以對時間特征的變化進行建模,從而提高精度。在MAE和RMSE方面,本文端到端神經網絡模型比其他模型表現更好。

表3 不同血壓估計模型的比較分析Table 3 Comparative analysis of differentblood pressure estimation models mmHg
3.2 AAMI標準的績效評估
醫學儀器促進協會(AAMI)標準要求血壓測量裝置的誤差(ME)和誤差標準偏差(SDE)值分別低于5 mmHg和8 mmHg[20]。表4顯示了根據AAMI標準對不同模型的評估,從表4可以看出,端到端神經網絡模型滿足SBP估計的AAMI標準,所提出的模型具有可忽略的ME和最小的SDE。隨著2個模型的序列長度M從10增加到32,端到端神經網絡模型的預測能力明顯增加。

表4 基于AAMI標準(ME<5 mmHg,SDE<8 mmHg)的性能評估Table4 Performance evaluation based on AAMI standard (ME<5 mmHg,SDE<8 mmHg) mmHg
3.3 統計分析
對短序列數據(M=10)進行Bland-Altman檢驗和Pearson相關檢驗。圖5為基于端到端神經網絡模型SBP和DBP估計的Bland-Altman。對于本文提出的模型,發現SBP和DBP的一致性極限[μ-1.96,μ+1.96]分別為[-4.076,4.933]和[-4.816,4.736],這意味著95%的估計SBP誤差小于4.78 mmHg,95%的測量DBP值誤差小于4.50 mmHg,表明該模型是一個好的估計模型。圖6為基于端到端神經網絡模型SBP和DBP估計的回歸示意圖。SBP和DBP的Pearson相關系數分別為r=0.990和r=0.991,2個系數都非常接近1.0,表明目標和估計的BP之間存在高線性。

圖5 SBP和DBP估計的Bland-Altman 示意圖 Fig.5 Bland-Altman schematic diagram of SBP andDBP estimation

圖6 SBP和DBP估計的回歸示意圖Fig.6 Regression diagram of SBP and DBP estimation
3.4 實驗分析
為驗證所建立的血壓估算模型的可靠性,本文對采用歐姆龍 HEM-7136型電子血壓計與本文系統測試者同時進行檢測以分析該設計的準確性。其中,以歐姆龍 HEM-7136型電子血壓計測得數據作為標準值,本文設計測量數據為估計值。實驗基于計算機平臺,組合使用橈動脈脈搏傳感器(合肥華科電子技術研究所的HK-2000B型傳感器)、心電圖機(三銳科技醫用ECG-2301單道心電圖機)對年齡在21歲~35歲之間的健康男性7名和女性6名進行檢測,采樣頻率設置為400 Hz,記錄被測者的脈搏波和心電信號,使用基于端到端神經網絡的連續血壓估計模型對信號進行處理,得到血壓估計值,同時使用歐姆龍 HEM-7136型電子血壓計測量被測者的收縮壓和舒張壓各3次,取平均值作為血壓計測量值。連續測量5天,共65組可對比數據,具體數據情況如表5所示。基于端到端神經網絡模型的連續血壓估計模型的舒張壓和收縮壓的平均絕對誤差分別為3.037 3 mmHg和2.504 9 mmHg,測量結果滿足BP估計的AAMI標準,具有一定的臨床意義。

表5 血壓估計模型的測量數據分析Table 5 Analysis of measured data of blood pressureestimation model mmHg
4 結束語
本文提出一種新的端到端神經網絡模型,對ECG和PPG波形進行無袖連續血壓估計。該模型能夠在不需要任何特征工程的情況下提取必要的波形特征,以及學習時間特征的變化,滿足BP估計的AAMI標準,其Pearson相關性測試顯示相關系數接近1.0,表明實際BP和估計BP之間具有高線性。為驗證血壓模型的有效性,對測試者連續測量5天的實驗結果表明,血壓估計模型誤差在±5 mmHg以內,具有一定的準確性和可靠性,達到了較好的效果。

