轉RD29A:DREB1A融合基因小麥的獲得及其抗旱性研究
柳 娜,楊文雄,王世紅,張雪婷,楊長剛
(甘肅省農業科學院小麥研究所,甘肅蘭州 730070)
小麥是我國以及世界范圍內最主要的糧食作物。干旱是導致小麥產量減少的最主要環境因素[1]。通過品種改良提高小麥抗旱能力,增加干旱環境下的小麥產量對保證國家糧食安全具有重要的意義。傳統農作物育種存在效率比較低和周期較長的缺點。隨著分子生物學技術以及遺傳轉化技術的發展,轉基因已經越來越多的運用于植物的品種改良。與傳統育種相比,轉基因技術針對性強、效率高,并且所需周期極大地縮短。理論上轉基因技術可以用于轉化任何供體基因組,從而能夠有效地利用不同物種間的優良基因[2]。植物能夠通過生理及分子水平的改變適應干旱環境的變化。不同種類的植物誘導不同類型基因的變化來響應外界脅迫[3]。轉錄因子調控相關下游干旱相關基因介導植物干旱響應[4]。干旱應答元件結合蛋白質(Dehydration-responsive element-binding protein )是一類包含有AP2的DNA結合域的轉錄因子[5]。在擬南芥中,DREB1A通過結合到A/GCCGAC的核心序列,調控下游基因的表達,以響應干旱、高鹽和冷脅迫[6]。外源擬南芥DREB1A的轉基因能夠提高水稻、番茄、小麥等作物對環境脅迫的適應能力[1,3,7-9]。目前在小麥遺傳轉化過程中,通常采用強啟動子CaMV35S驅動外源基因在轉基因小麥中表達。CaMV35S啟動子是一種組成性表達的啟動子,因此CaMV35S驅動的基因往往在轉基因植物的各個組織中和不同的生理階段高表達,而這種持續性的高表達往往影響了轉基因植物的其他生長發育表型,最終導致了轉基因植物的生長發育受到嚴重影響[3,10-12]。RD29A是一類響應干旱以及逆境特異誘導型啟動子,僅僅在干旱或者逆境誘導下特異表達[13]。利用干旱誘導型啟動子RD29A取代CaMV35S啟動子驅動DREB1A的表達,能夠顯著降低外源轉基因對植物生長的影響[7]。RD29A:DREB1A轉基因番茄的生長發育沒有受到顯著的影響,但抗旱和抗冷性明顯提高[3]。以上研究說明,用啟動子RD29A替代CaMV35S能夠在不嚴重影響植物生長的情況下發揮DREB1A抗旱的作用。然而有關外源RD29A:DREB1A導入后小麥的抗旱性及產量相關農藝性狀變化的研究目前尚不多見。本研究利用轉基因技術將RD29A:DREB1A導入到小麥品種隴春30中,對轉基因小麥抗旱生理指標進行了考察,同時篩選得到生長表型正常、抗旱性強的轉基因植株,以期為小麥抗旱分子育種研究奠定基礎。
1 材料與方法
1.1 供試材料
轉基因小麥受體材料為甘肅省審定的優良品種隴春30。擬南芥所用生態型為Col-0。受試材料均于甘肅農業科學院抗旱棚下植于塑料盆中。實驗用土取自于大田中的耕層土壤。土壤風干后進行過篩處理。設正常水分處理(土壤相對含水量70%左右)和干旱處理(土壤相對含水量35%~50%),選擇生長一致的盆栽小麥于開花后第3天開始隔日稱重控制水分,干旱期間利用土壤養分,不另施肥。
1.2 啟動子和基因克隆引物以及轉基因鑒定引物
RD29A啟動子為利用RD29A-F:TGTTT AAGGTGGAGAAGCTG以及RD29A-R:ATC TTTTTTTTTGCTTTTTGGAACTCATGTCG引物從擬南芥生態型Col-0基因組DNA中擴增得到。DREB1A序列為利用DREB1A-F:AT GAACTCATTTTCTGCTTT和DREB1A-R:ATAACTCCATAACGATACGT從擬南芥擬南芥生態型Col-0中cDNA擴增所得,引物DREB1A-F:ATGAACTCATTTTCTGCTTT,DREB1A-R:ATAACTCCATAACGATACGT。轉基因小麥陽性單株PCR鑒定引物為RD29A-F:TGTTTA AGGTGGAGAAGCTG,載引物為R:GGGTT TCTACAGGACGTAAC。將RD29A啟動子序列以及DREB1A基因序列通過同源重組克隆到pBI121載體,同時將4×MYC標簽通過同源重組整合到DREB1A基因序列末端。
1.3 培養基
小麥轉基因所用培養基為脫分化培養基、繼代培養基、分化培養基和生根培養基,詳細配方參考文獻[14]。
1.4 基因轉入方法
利用擬南芥生態型Col-o基因組DNA和cDNA分別擴增獲得RD29A啟動子以及DREB1A基因。將構建完成的RD29A:DREB1A-4MYC-pBI121質粒利用基因槍轉化到受體品種隴春30中,并對后代進行分化和篩選。
1.5 Southern印記
利用CTAB法提取3周大小轉基因小麥葉片基因組DNA。利用HindⅢ(Takara)過夜消化基因組DNA。消化好的DNA電泳后轉移到尼龍膜上(Roche)。將標記好的探針與尼龍膜孵育并完成雜交后洗脫顯影[15]。
1.6 熒光定量PCR檢測
利用植物總RNA提取試劑盒(Takara)提取總RNA,并利用反轉錄試劑盒進行反轉錄(Takara)。熒光定量PCR加測引物qDREB1A-F:TTCGGTTTCCTCAGGCGGTG,qDREB1A-R:TGTTTGGTTCTCTAACCTCA;ACTIN-F:GT TCCAATCTATGAGGGATACACG, ACTIN-R: GAACCTCCACTGAGAACAA[16]。
1.7 轉基因小麥生理指標測定
利用三葉期小麥進行干旱處理,干旱處理停止澆水7 d后進行復水。對照和干旱處理材料分別取0.5 g用于生理指標分析。脯氨酸含量測定參考張忠殿等[17]的方法。可溶性糖含量參考Hakimi 等[18]的方法提取和測定。H2O2含量參考Luna等[19]的方法進行測定。MDA含量參考Sairam等[20]的方法進行提取和測定。超氧化物歧化酶(SOD)、過氧化氫酶(CAT)和過氧化物酶(POD)活性按照Zhang等[21]的方法提取和測定。所有指標測定均進行三次生物學重復。
1.8 轉基因小麥種植及其產量性狀測定
用T3代純合家系考察轉基因小麥產量。對照和轉基因每個家系分別挑選9株生長一致的幼苗種植人工氣候室的花盆中。人工氣候室光照強度為500 μmol·m-2·s-1,光照時間為8:00-18:00,溫度為25 ℃,相對濕度為50%±10% 。設正常水分處理(土壤相對含水量70%左右)和干旱處理(土壤相對含水量35%~50%)。選擇生長一致的盆栽小麥從開花后3 d開始,隔日稱重控制水分,干旱期間利用土壤養分,不另施肥。小麥自然成熟后對株高、穗長、穗粒數、千粒重以及地上生物量進行考察[22]。
1.9 數據分析
利用t-test方法對數據進行分析,數據處理采用Microsoft Excel 軟件,采用GraphPad Prism8進行繪圖。
圖1 轉基因再生苗和再生根的培養Fig.1 Culture of transgenic regenerated seedling and regenerated roots
2 結果與分析
2.1 轉基因小麥鑒定與獲得
將RD29A:DREB1A轉入受體品種隴春30中后,經過分化和篩選,共獲得287株再生植株(圖1)。利用RD29A啟動子擴增引物F端以及MYC的R端引物對移栽成活T0代轉基因小麥進行轉基因鑒定。PCR檢測結果表明,T0代轉基因材料共有15株檢測到目標條帶。進一步通過Southern檢測,篩選到3株單拷貝插入的T0代轉基因小麥,分別命名為L4、L17和L31(圖2B)。同時利用RD29A啟動子擴增引物F端以及載體的R端引物進行PCR擴增檢測外源基因的插入,結果顯示,隴春30沒有檢測到條帶,而L4、L17和L31三個轉基因家系均檢測到外源轉基因的插入(圖2C)。為了進一步檢測外源基因是否能夠在轉基因小麥中成功表達,利用MYC抗體對受體品種隴春30及L4、L17和L31三個轉基因家系進行了蛋白水平的檢測,以ACTIN蛋白作為內參。在隴春30、L4、L17以及L31中都檢測到ACTIN蛋白的表達。而利用MYC抗體檢測結果表明,在隴春30中并沒有檢測到MYC信號,而L4、L17以及L31三個轉基因家系均檢測到了MYC蛋白的表達(圖2D)。以上結果說明,L4、L17以及L31三個轉基因家系中DREB1A蛋白能夠成功表達。
已有研究表明,RD29A啟動子是一個鹽、溫度以及干旱特異誘導的啟動子[13]。因此,為了進一步驗證L4、L17以及L31三個轉基因家系中RD29A驅動的DREB1A在干旱脅迫下的表達模式,將L4、L17以及L31三個轉基因家系幼苗在人工氣候室進行干旱處理,對DREB1A基因的表達進行了檢測。在干旱處理12 h后,L4、L17以及L31三個轉基因家系中,DREB1A都表現出極強的干旱誘導表達。相比于未干旱處理,干旱脅迫下DREB1A的表達增強了6~7倍(圖2E),說明L4、L17以及L31三個轉基因家系中,DREB1A基因的表達受干旱誘導。以上結果表明,L4、L17以及L31三個轉基因家系中RD29A:DREB1A基因成功導入,并且在干旱誘導下能夠成功表達外源DREB1A蛋白。因此,后續對L4、L17以及L31三個轉基因家系可進一步進行純合家系的篩選。
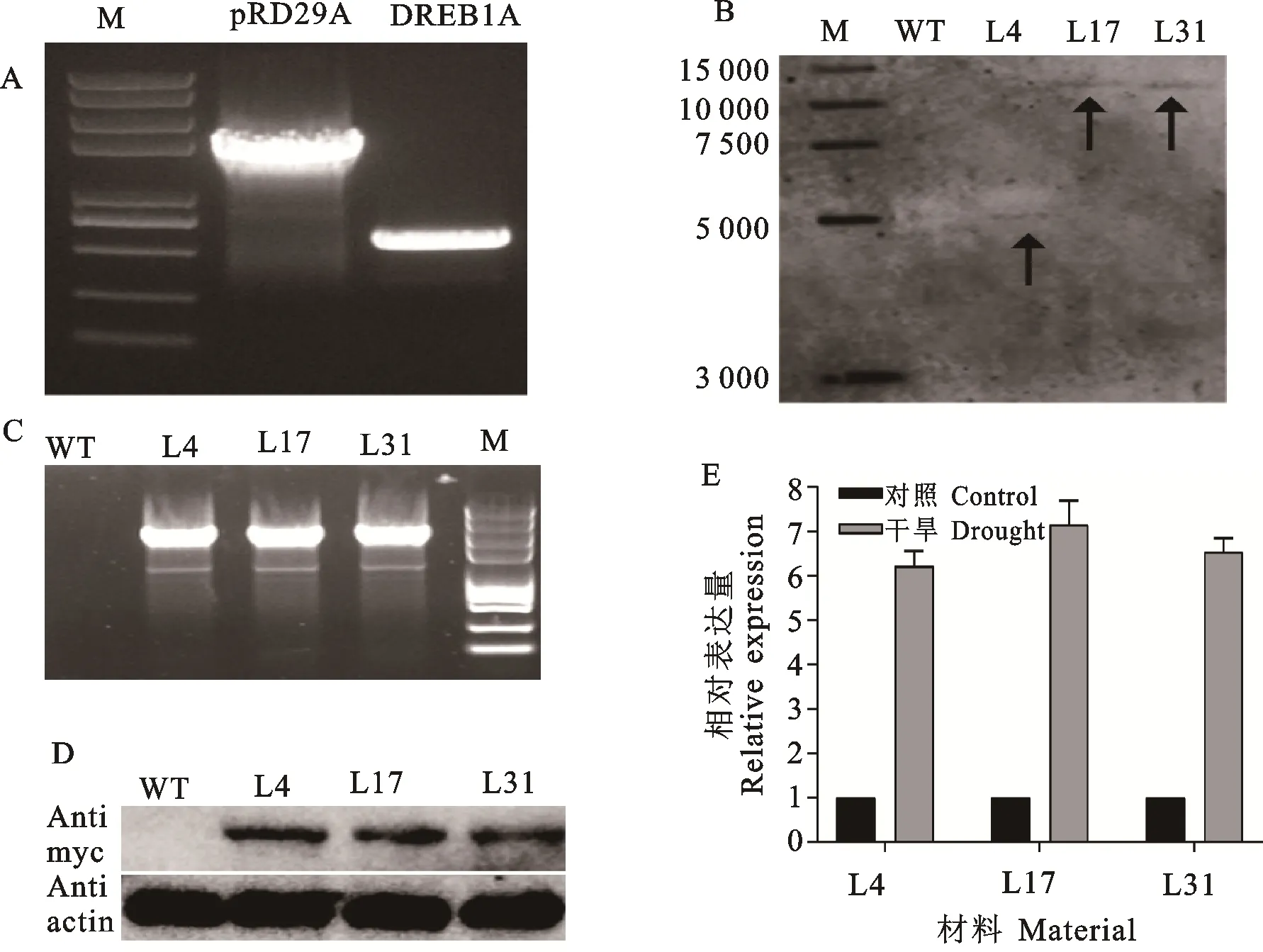
a:RD29A啟動子和 DREB1A基因的克隆。B: RD29A:DREB1A轉基因植株Southern檢測。箭頭指示為Southern檢測條帶。C: RD29A:DREB1A轉基因植株PCR鑒定。D: RD29A:DREB1A轉基因植株蛋白表達檢測。ACTIN作為內參。E: RD29A:DREB1A轉基因植株 DREB1A基因表達檢測。ACTIN作為內參。正常生長幼苗作為對照,對照表達量設定為1。非轉基因受體品種隴春30作為對照(WT)。
2.2 轉基因家系純合材料的鑒定
將L4、L17及L31三個轉基因家系從T1代繁殖得到T2代,利用載體特異引物從T2代中利用PCR鑒定出9株陽性單株并繁殖到T3代,再從T3代中分別挑取24株幼苗繼續鑒定,檢測沒有分離則認為該家系為純合家系。利用PCR鑒定方法,分離出L4-3-2、L15-5-7以及L31-4-7三個轉基因純合家系(圖 3)。
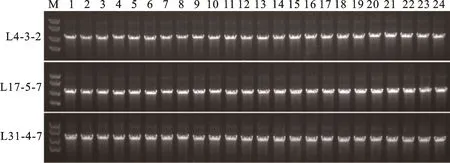
1~24代表轉基因植物PCR鑒定條帶。M:DNA分子量標準。
2.3 轉基因小麥的生理抗旱性
2.3.1 轉基因小麥的脯氨酸和可溶性糖酸含量對干旱脅迫的反應
與正常供水對照相比,在干旱處理下,隴春30及轉基因純合家系L4-3-2、L15-5-7和L31-4-7的脯氨酸和可溶性糖含量均顯著增加, 但三個轉基因純合家系的脯氨酸和可溶性糖酸含量的增加幅度要顯著高于隴春30(圖4A和圖4B),表明轉基因家系在干旱脅迫下具有更強的滲透調節 能力。
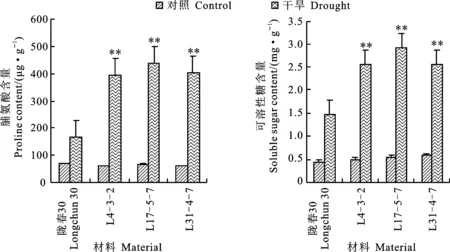
**表示干旱條件下轉基因材料與隴春30差異在0.01水平上顯著(P<0.01)。下圖同。
2.3.2 轉基因小麥的H2O2含量、MDA含量和相對導電率對干旱脅迫的反應
在對照條件下,隴春30及三個轉基因家系L4-3-2、L15-5-7和L31-4-7間H2O2含量、MDA含量和相對導電率均相近,差異均較小(圖5)。在干旱脅迫下,隴春30的H2O2含量較對照提高了近4倍,而三個轉基因家系中H2O2含量的提高幅度顯著低于隴春30(圖5A);隴春30中 MDA含量相對于對照提高了約2.5倍,而三個轉基因家系的MDA含量提升均不到1.0倍(圖5B);隴春30中相對導電率較對照增加了4倍,達到20%,而三個轉基因家系的相對導電率雖然也有增加,但增加幅度明顯小于隴春30(圖5C)。這表明在干旱脅迫下轉基因小麥的活性氧累積較少,膜脂過氧化程度輕,膜透性受干旱脅迫影 響小。
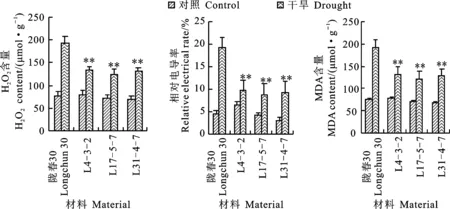
圖5 轉基因小麥的H2O2含量、相對電導率和MDA含量Fig.5 H2O2 content,MDA content and relative electrical conductivity in transgenic wheat
2.3.3 轉基因小麥的抗氧化酶活性對干旱脅迫的反應
在對照條件下,隴春30及三個轉基因家系L4-3-2、L15-5-7和L31-4-7間SOD、CAT和POD活性均相當(圖6)。在干旱脅迫下,隴春30和三個轉基因家系的SOD、CAT和POD活性較對照均顯著提高,但三個轉基因材料的三種酶活性的提高幅度均高于隴春30(圖6),表明干旱脅迫下轉基因小麥具有更強的活性氧清除能力,有利于適應干旱脅迫。
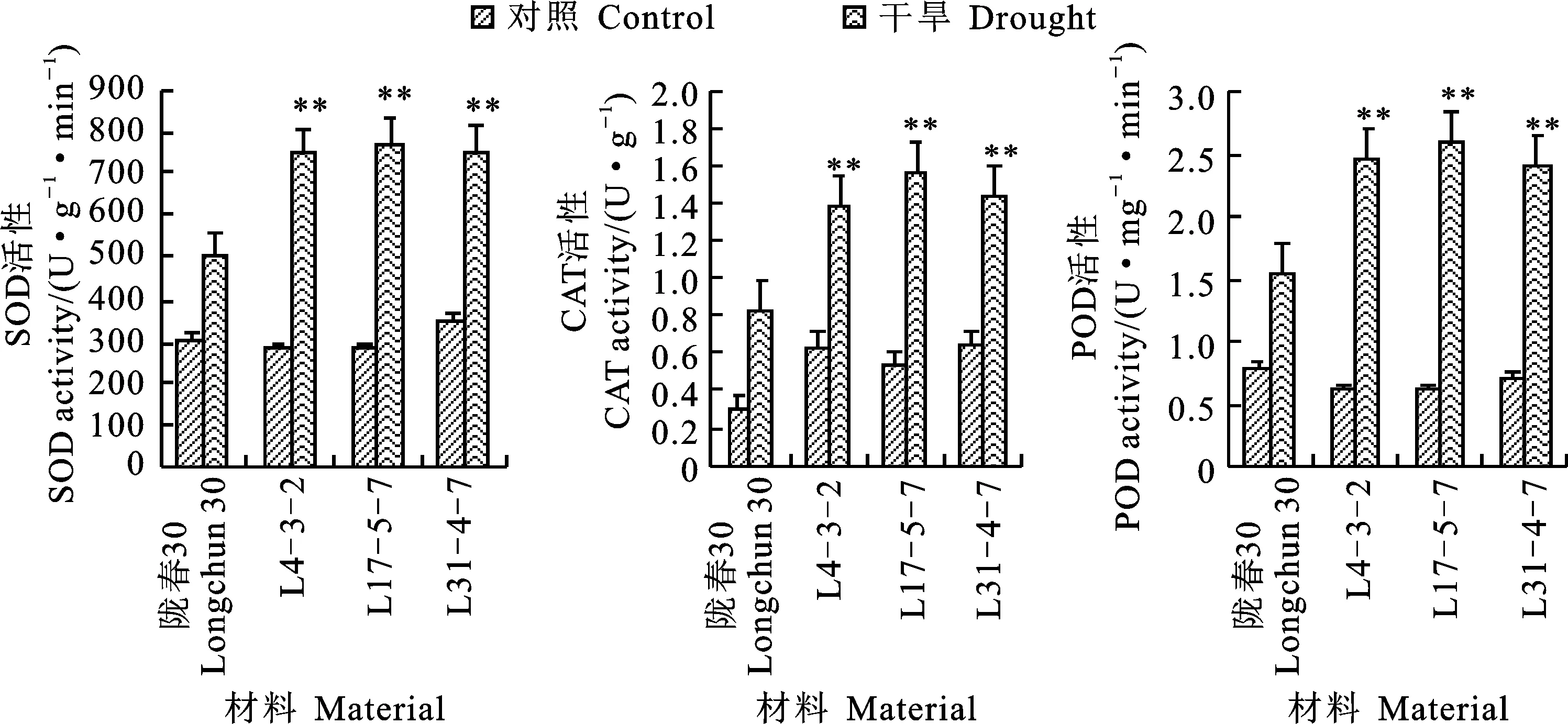
圖6 轉基因小麥的SOD、CAT和POD活性Fig.6 Activities of SOD,CAT and POD in transgenic wheat
2.4 轉基因小麥產量性狀考察
在對照條件下,三個轉基因家系的株高、穗長、穗粒數、千粒重以及地上生物量較受體品種隴春30均略微降低(表1)。但在干旱脅迫下,所有材料的各指標均較對照有所下降,但相比于隴春30,三個轉基因家系株高、穗長、穗粒數、千粒重和地上生物量分別增加6%~7%、7%~8%、 10%~12%、9%~12%及9%~12%(表1),說明RD29A:DREB1A外源基因的導入對小麥的生長發育影響并不十分明顯,但在干旱脅迫下,轉基因小麥的農藝性狀相比受體隴春30受到的抑制效應較小,表現出較好的抗旱能力。
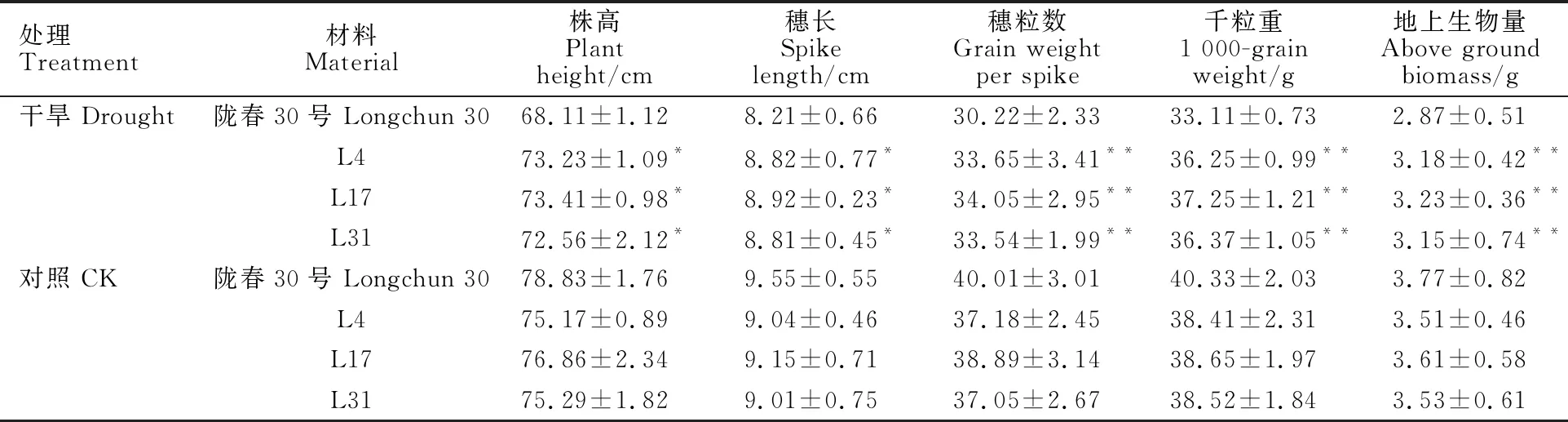
表1 轉基因小麥產量性狀考察Table 1 Investigation of yield traits of transgenic wheat
3 討 論
小麥容易受到干旱環境的影響,導致產量降低。利用轉基因技術將外源基因導入小麥進行遺傳改良,能夠極大地加速小麥的育種進程。作物的產量是一個比較復雜的性狀。作物產量的提高是作物遺傳改良的主要目標。在本研究中,通過轉基因技術將擬南芥基因RD29A:DREB1A轉入到受體品種隴春30中,篩選獲得抗旱性強、產量高且沒有明顯生長發育表型的純合轉基因家系,為培育抗旱小麥品種奠定了基礎。
DREB蛋白在提高植物抗逆中起著重要作用[6,12,23-26]。DREB基因能夠明顯提高小麥對干旱和逆境脅迫的抗性[27-30]。然而由于DREB作為一個重要轉錄因子,可能通過調控多個途徑的基因表達而參與到其他生物學過程中,通常利用CaMV35S驅動DREB所得到的轉基因植株可能由于過量異位表達DREB導致轉基因植物的生長發育表型受到影響[31]。因此DREB的本底表達量和干旱脅迫的特異響應表達量對于利用DREB轉基因的作物改良起到非常重要的作用。目前已經在多種植物利用特異誘導型的啟動子誘導DREB的表達進行轉基因,使得轉基因植物抗旱抗逆境脅迫增強,卻不明顯影響植株生長發育[3,7,32-33]。轉基因植株中 DREB1A蛋白與對照ACTIN相比,處于較低的水平(圖1D)。而在干旱脅迫下轉基因植株的DREB1A轉錄受到了強烈的誘導(圖1E)。因此,我們獲得了本底蛋白表達低、但能夠受到干旱脅迫特異誘導表達的轉基因植株。DREB的過量表達能夠影響植物的生長發育,本實驗所獲得的RD29A:DREB1A的轉基因小麥由于本底DREB1A表達不高,生長發育沒有受到太大的影響,然而卻能夠特異響應干旱脅迫,表現出較強的抗旱性。
干旱能夠誘導植物脯氨酸以及可溶性糖的含量的增加[34-35]。植物能夠通過調整細胞脯氨酸以及可溶性糖的含量改變細胞滲透壓,從而適應干旱脅迫[36]。因此,脯氨酸以及可溶性糖的含量在植物抗旱過程中起到重要作用。RD29A:DREB1A轉基因小麥脯氨酸和可溶性糖含量在干旱脅迫下顯著高于野生型,表明RD29A:DREB1A轉基因小麥在干旱脅迫下具有更強的調節細胞滲透壓的能力(圖4)。
MDA是細胞體內脂質過氧化的標記物[37]。H2O2含量以及MDA含量升高能夠導致細胞膜的損傷。干旱脅迫處理能夠誘導H2O2以及MDA的含量升高,導致細胞膜結構損傷。細胞膜結構損傷會引起相對導電率的變化。 在干旱脅迫下,RD29A:DREB1A轉基因小麥的H2O2含量、MDA含量和相對導電率相比野生型都有顯著下降,表明轉基因小麥在干旱脅迫下細胞膜的損傷程度低于野生型(圖5)。
干旱脅迫導致細胞內的活性氧水平上升[38]。活性氧的積累對植物細胞造成損傷[39]。植物在干旱脅迫下對細胞內活性氧的清理可增強抗旱作用。SOD、CAT和POD在清除細胞過量活性氧的過程中起到重要作用。RD29A:DREB1A轉基因小麥的SOD、CAT和POD在干旱脅迫下表現出更強的活性,說明轉基因小麥在干旱脅迫下具有更強的清除活性氧的能力(圖6)。以上結果表明,在干旱脅迫下RD29A:DREB1A轉基因小麥通過增強細胞滲透調節能力、減少活性氧的含量以及降低細胞受損程度,從生理水平上更加適應干旱脅迫,能夠更好地維持正常細胞功能。因此,RD29A:DREB1A轉基因小麥在生理水平表現出較強的抗旱能力。
本試驗中DREB1A轉基因是由特異啟動子驅動,然而轉基因植株中DREB1A具有一定的本底表達量,因此導致植株的生長發育受到輕微的影響(表1)。已報道RD29A:DREB1A轉基因番茄的生長表型也受到輕微的影響[3]。但是由于RD29A:DREB1A外源基因受到干旱的特異誘導,因此轉基因植株在干旱脅迫下表現出更強的抗旱能力,使產量性狀得到改善。這表明利用RD29A:DREB1A外源基因能夠更好地替代CaMV35S強啟動子,使得轉基因小麥既能提高抗旱能力,又能維持自身正常生長發育。
4 結 論
在本試驗中,我們利用了擬南芥RD29A:DREB1A外源基因基因對隴春30進行遺傳改造,所獲得的純合轉基因家系在生理水平對干旱有更強的抗性,同時能夠改善干旱脅迫下的產量性狀,并且對植物自身發育影響較小,為小麥選育抗旱脅迫相關品種奠定了基礎。
干旱脅迫是一個復雜的生理過程,植物通過多個基因在不同的層次響應干旱脅迫,通過單基因的導入并不能夠完全實現對作物抗旱的遺傳改良。因此,需要不斷加深抗旱分子機理研究,促進分子育種發展以全面、有效地實現品種改良和 選育。

