CGRP、AchE在功能性排便障礙大鼠模型中的表達
李雪,耿學斯,程一乘,劉薇,劉立陽,劉仍海△
功能性排便障礙(FDD)是慢性便秘中最常見的類型,表現為直腸推進力不足和(或)排出阻力增加,在慢性便秘中占25%~74%[1]。由于FDD 常反復發作,嚴重影響患者的生活質量,目前FDD 的病因和發病機制尚不明確。研究顯示,FDD 患者具有較高的焦慮抑郁傾向,而發生負性生活事件、精神刺激及應對障礙時,腦-腸軸可異常分泌腦腸肽,參與FDD的形成[2-3]。腦腸肽是腦-腸軸各通路作用的物質基礎及重要作用靶點,在外周及中樞廣泛地參與胃腸道生理活動和各種功能的調節。其中降鈣素基因相關肽(CGRP)及乙酰膽堿酯酶(AchE)作為腦腸肽能釋放神經傳遞介質或調節介質,調節胃腸功能,也可以直接作用于胃腸道感覺神經末梢或平滑肌細胞的相應受體而調節腸道的感覺和運動,同時亦參與中樞神經系統調節胃腸道功能[4-5]。然而,CGRP、AchE在FDD 中的作用尚不明確。本課題組前期研究發現,采用低纖維飲食聯合亞甲藍肛周注射法能夠改變大鼠的糞便性狀及排便功能,模擬FDD的病理狀態。本研究采用此造模方法,觀察FDD模型大鼠結、直腸中CGRP、AchE的表達,探討兩者在FDD中的作用及FDD發生的可能機制。
1 材料與方法
1.1 實驗動物 SD 雄性大鼠24 只,SPF 級,8 周齡,體質量180~200 g,購自北京維通利華實驗動物技術有限公司,動物許可證編號:SCXK(京)2016-0006,飼養于SPF級動物房,溫度22~25 ℃,濕度50%~70%,晝夜光照恒定12 h/12 h。動物實驗處理均嚴格遵循動物保護原則及北京中醫藥大學實驗動物倫理委員會的要求。
1.2 實驗試劑與儀器 亞甲藍注射液(濟川藥業集團),2%利多卡因注射液(哈藥集團三精制藥公司)。大鼠AchE酶聯免疫吸附試驗(ELISA)試劑盒購自Solarbio 公司,Trizol 總RNA提取試劑盒(天根生化科技有限公司),PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBR Premix Ex TaqTMⅡ(Tli RNaseH Plus)ROX plus、DL2000 DNA Marker 均購自MDL 公司,CGRP 兔多克隆抗體(北京博奧森生物技術有限公司),DAB 試劑盒(北京中杉金橋生物技術有限公司),UltraPure Agarose、SuperScript ⅢRT 逆轉錄試劑盒均購自ABIinvitrogen公司。
EG1150型石蠟包埋儀、RM2235型石蠟切片機、DM3000型正置熒光顯微鏡、G1150H 型均為德國Leica 公司產品;ABI7500 型實時熒光定量PCR 儀(美國Applied Biosystems 公司);Tanon1600型凝膠成像系統V.1.100(上海天能科技有限公司);loveq-va5型直腸壓力測試計(韓國OMOMED公司)。
1.3 動物模型的制備、分組及給藥 24只SD大鼠適應性飼養3 d 后,采用隨機數字表法分為空白對照組、低纖維飲食組、利多卡因組、模型組,每組6只。各組均自由飲水,空白對照組采用普通飼料飼養;低纖維飲食組、利多卡因組、模型組采用低纖維飼料飼養,并于飼養第63天,分別予以利多卡因組2 mL 2%利多卡因注射液、模型組2 mL 0.1%亞甲藍注射液(由2%利多卡因溶液配制)肛周及直腸周圍間隙注射1次。低纖維飲食配方為:41.5%玉米淀粉,24.5%牛奶酪蛋白,10.0%蔗糖,10.0%糊精,7.0%礦物混合物,6.0%玉米油和1%纖維素混合物[科澳協力飼料有限公司,許可證號SCXK(京)2014-0010]。實驗第77天取材,各組大鼠取結腸、直腸組織,一部分固定于10%福爾馬林溶液中用于制備石蠟切片,另一部分置于-80 ℃冰箱中待用。
1.4 檢測指標及方法
1.4.1 一般行為表現及排便情況 每日觀察各組大鼠精神狀態、活動情況、進食量、飲水量、毛發光澤程度等情況。觀察大鼠糞便性狀,記錄大鼠24 h糞便總質量。
1.4.2 排便功能檢測 采用模擬球囊排出法和肛管直腸壓力測定法檢測。分別于實驗第0、62、76天時進行測定,需輔助大鼠排盡直腸內糞便,并將大鼠固定。選取直徑4~5 mm干黃豆,經石蠟油潤滑后將干黃豆置入直腸內2 cm 處,記錄黃豆排出時間。肛管內置入無菌導尿管(規格:8Fr)并與直腸壓力測試儀連接,測量大鼠肛管直腸靜息壓。
1.4.3 大鼠結、直腸組織中AchE 的含量 采用ELISA 法檢測。各組取6只大鼠,取組織勻漿,嚴格按照試劑盒說明書步驟進行測定。
1.4.4 大鼠結、直腸組織中CGRPmRNA 的表達情況 采用實時熒光定量PCR(qPCR)法檢測。從-80 ℃冰箱中取出大鼠結、直腸組織樣本,每組6 只,加入液氮后研磨粉碎,加入Triozol 提取組織中的總RNA。cDNA 反轉錄,實驗操作按產品說明書進行。于qPCR 儀上進行PCR 反應,反應條件:95 ℃預變性5 min;95 ℃變性10 s,58 ℃退火20 s,72 ℃延伸20 s,40個循環。引物由北京Invitrogen公司合成,引物序列見表1。每個樣本設3個復孔。采用2-ΔΔCt法進行相對定量分析。

Tab.1 Primer sequence of qPCR表1 qPCR引物序列
1.4.5 免疫組化法檢測大鼠結、直腸組織中CGRP 蛋白的表達 石蠟切片經脫蠟、水化后,水浴加熱抗原修復15 min,CGRP 兔抗鼠多克隆抗體(1∶1 000)4 ℃孵育過夜,羊多克隆二抗(1∶500)37 ℃孵育30 min,辣根酶標記鏈霉卵白素工作液室溫孵育30 min,DAB 顯色劑顯色,蘇木素復染,脫水,透明,中性樹膠封片。采用IPP 6.0圖像分析軟件,以積分光密度(IOD)對CGRP蛋白表達進行半定量分析[6]。
1.4.6 Western blot 法檢測大鼠結、直腸組織中CGRP蛋白的表達 各組選取3只大鼠,取大鼠結、直腸組織,加入裂解液冰上研磨制備勻漿,取上清液BCA法進行蛋白定量。各組取20 μg/孔樣品蛋白,進行SDS-聚丙烯酰胺凝膠電泳(80 V,100 min)分離后,濕轉法轉移到PVDF膜上,封閉液室溫搖床搖2 h。加入特異性識別抗體(1∶1 000),4 ℃封閉過夜。TBS震蕩洗膜后,加入二抗(1∶10 000),室溫避光孵育1 h,洗膜后加ECL發光液反應3~5 min,調整膠片曝光時間(5 min),加入顯影液、定影液,清水浸泡后晾干。采用凝膠成像儀采集圖像并進行分析。以β-actin蛋白作為內參。實驗重復3次。
1.5 統計學方法 采用SPSS 21.0 軟件進行統計描述與分析,計量資料以均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間多重比較行LSD-t檢驗;不同時間點比較采用重復測量設計的方差分析;2組間比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠一般行為表現及排便情況 空白對照組大鼠飲水、進食情況良好,毛發光澤,精神狀態佳,未見精神萎靡或躁動,排便及排尿情況可,無死亡,活動無異常;與空白對照組比較,其余各組大鼠進食量減少,毛發光澤度差,脫毛情況嚴重,精神狀態較差,活動量減少;其中,利多卡因組和模型組較低纖維飲食組大鼠毛發更為稀疏,且偶有躁動。
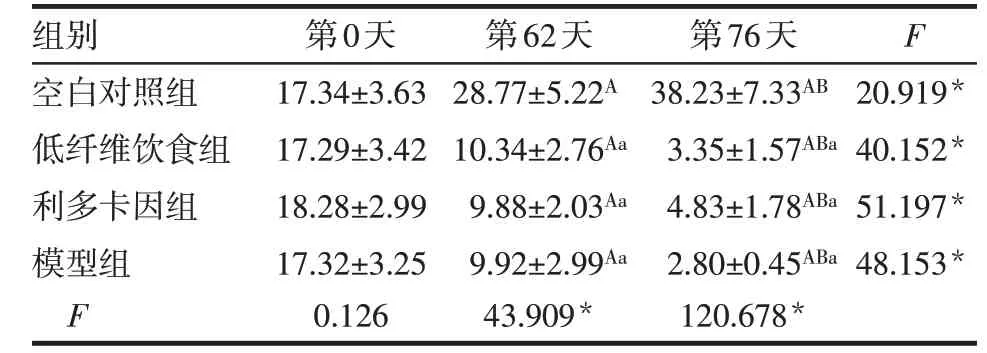
實驗開始前,各組大鼠糞便成型,呈褐色,各組大鼠糞便質量差異無統計學意義;實驗第62 天,空白對照組大鼠糞便質量升高,低纖維飲食組、利多卡因組及模型組降低(均P<0.05)。肛周注射后(實驗第76 天),與空白對照組比較,低纖維飲食組、利多卡因組及模型組大鼠糞便出現不同程度的變干變硬,其中低纖維飲食組和利多卡因組糞便呈深褐色,模型組糞便呈黑褐色,糞便質量均明顯降低(P<0.05);與低纖維飲食組比較,利多卡因組糞便性狀變化不大,模型組大鼠糞便更為干硬,體積小,但糞便質量差異均無統計學意義,見表2。
2.2 各組大鼠排便功能變化情況
2.2.1 各組大鼠模擬球囊排出情況 肛周注射前(實驗第0天、第62天),各組大鼠模擬球囊排出時間差異均無統計學意義;肛周注射后(實驗第76 天),空白對照組和低纖維飲食組大鼠模擬球囊排出時間仍無明顯變化(P>0.05);利多卡因組和模型組大鼠模擬球囊排出時間增長(P<0.05),且模型組大鼠模擬球囊排出時間均長于其他3組(P<0.05),見表3。
Tab.2 Comparison of stool weight of rats between four groups表2 4組大鼠糞便質量的比較(n=6,g,±s)
Tab.2 Comparison of stool weight of rats between four groups表2 4組大鼠糞便質量的比較(n=6,g,±s)
*P<0.05;F組間=52.332*,F時間=153.139*,F交互=9.362*;組內比較:A與第0天比較,B與第62天比較,P<0.05;組間比較:a與空白對照組比較,P<0.05
組別空白對照組低纖維飲食組利多卡因組模型組F第0天17.34±3.63 17.29±3.42 18.28±2.99 17.32±3.25 0.126第62天28.77±5.22A 10.34±2.76Aa 9.88±2.03Aa 9.92±2.99Aa 43.909*第76天38.23±7.33AB 3.35±1.57ABa 4.83±1.78ABa 2.80±0.45ABa 120.678*F 20.919*40.152*51.197*48.153*
Tab.3 Comparison of simulated balloon expulsion times between four groups of rats表3 4組大鼠模擬球囊排出時間的比較(n=6,s,±s)

Tab.3 Comparison of simulated balloon expulsion times between four groups of rats表3 4組大鼠模擬球囊排出時間的比較(n=6,s,±s)
*P<0.05;F組間=34.916*,F時間=13.327*,F交互=9.743*;組內比較:A與第0天比較,B與第62天比較,P<0.05;組間比較:a與空白對照組比較,b與低纖維飲食組比較,c與利多卡因組比較,P<0.05
組別空白對照組低纖維飲食組利多卡因組模型組F第0天298.13±28.77 301.34±31.48 297.38±26.69 301.99±29.56 0.037第62天327.00±42.01 321.17±44.30 323.36±39.56 325.67±41.29 0.023第76天331.17±55.77 329.00±54.88 426.36±76.20AB 579.39±85.12ABabc 17.343*F 1.022 0.613 10.361*43.328*
2.2.2 各組大鼠肛管直腸靜息壓情況 肛周注射前(實驗第0天、第62天),各組大鼠肛管靜息壓差異無統計學意義;肛周注射后(實驗第76 天),空白對照組和低纖維飲食組大鼠肛管靜息壓仍無明顯變化(P>0.05);利多卡因組和模型組大鼠肛管靜息壓降低(P<0.05)。肛周注射后利多卡因組和模型組大鼠肛管靜息壓均低于空白對照組和低纖維飲食組,模型組大鼠肛管靜息壓低于利多卡因組(P<0.05),見表4。
Tab.4 Comparison of the resting pressure of anorectal canal between four groups of rats表4 4組大鼠肛管直腸靜息壓情況的比較(cmH2O,±s)

Tab.4 Comparison of the resting pressure of anorectal canal between four groups of rats表4 4組大鼠肛管直腸靜息壓情況的比較(cmH2O,±s)
*P<0.05;F組間=32.364*,F時間=17.413*,F交互=11.899*;組內比較:A與第0天比較,B與第62天比較,P<0.05;組間比較:a與空白對照組比較,b與低纖維飲食組比較,c與利多卡因組比較,P<0.05;1 cmH2O=0.098 kPa
組別空白對照組低纖維飲食組利多卡因組模型組F n 6 6 6 6第0天5.49±0.35 5.57±0.37 5.36±0.28 5.57±0.33 0.528第62天5.36±0.42 5.42±0.20 5.42±0.23 5.45±0.38 0.083第76天5.37±0.25 5.44±0.30 4.48±0.18ABab 3.14±0.22ABabc 118.106*F 0.261 0.447 30.451*111.920*
2.3 各組大鼠結、直腸組織中AchE 含量情況 結腸組織中,模型組AchE含量低于空白對照組和低纖維飲食組(P<0.05),與利多卡因組差異無統計學意義。直腸組織中,利多卡因組AchE含量低于空白對照組(P<0.05),與低纖維飲食組差異無統計學意義;模型組AchE 含量低于空白對照組、低纖維飲食組和利多卡因組(P<0.05);各組大鼠直腸組織中AchE含量均明顯低于結腸組織(P<0.05)。見表5。
Tab.5 Comparison of AchE contents in the colon and rectum tissues of rats between four groups表5 4組大鼠結、直腸組織中AchE含量的比較(ng/L,±s)

Tab.5 Comparison of AchE contents in the colon and rectum tissues of rats between four groups表5 4組大鼠結、直腸組織中AchE含量的比較(ng/L,±s)
*P<0.05;a與空白對照組比較,b與低纖維飲食組比較,c與利多卡因組比較,P<0.05;表6、7同
組別空白對照組低纖維飲食組利多卡因組模型組F n 6 6 6 6結腸7.04±0.39 7.19±1.62 5.91±0.76 4.04±0.58ab 13.742*直腸5.64±0.37 4.96±0.39 4.57±0.27a 2.73±0.52abc 58.789*t 6.379*3.278*4.070*4.119*
2.4 各組大鼠結、直腸組織中CGRPmRNA 的表達情況 結腸組織中,低纖維飲食組、利多卡因組及模型組CGRPmRNA 表達量均高于空白對照組(P<0.05),3組間差異無統計學意義;直腸組織中,空白對照組、低纖維飲食組、利多卡因組及模型組CGRPmRNA表達量依次升高,組間多重比較差異均有統計學意義。除利多卡因組直腸組織CGRPmRNA 表達量低于結腸組織外,其余各組結、直腸組織中CGRPmRNA表達量差異均無統計學意義,見圖1、2,表6。

圖1 4組大鼠結腸組織中CGRP電泳圖

圖2 4組大鼠直腸組織中CGRP電泳圖
2.5 CGRP 在各組大鼠結、直腸組織中的表達情況 CGRP 免疫陽性神經纖維呈棕黃色,聚集或分散于結腸及直腸黏膜腺體之間。結腸組織中,模型組CGRP 表達水平高于空白對照組、低纖維飲食組和利多卡因組(P<0.05),空白對照組、低纖維飲食組和利多卡因組間差異無統計學意義;直腸組織中,利多卡因組和模型組CGRP表達水平均高于空白對照組和低纖維飲食組,模型組高于利多卡因組(P<0.05);低纖維飲食組與空白對照組間差異無統計學意義。空白對照組、低纖維飲食組、利多卡因組直腸組織中CGRP表達水平均高于結腸組織,模型組結、直腸組織中CGRP 表達水平差異無統計學意義,見圖3、表7。
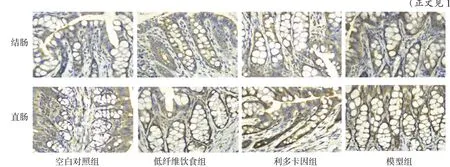
Fig.3 CGRP expression levels in the colorectal and rectal tissues of rats in each group(IHC,×400)圖3 CGRP在各組大鼠結、直腸組織中表達情況(IHC,×400)
Tab.6 Comparison of CGRP mRNA expression levels in the colorectal and rectal tissues between four groups of rats表6 4組大鼠結、直腸組織中CGRP mRNA表達量的比較(±s)

Tab.6 Comparison of CGRP mRNA expression levels in the colorectal and rectal tissues between four groups of rats表6 4組大鼠結、直腸組織中CGRP mRNA表達量的比較(±s)
組別空白對照組低纖維飲食組利多卡因組模型組F n3 3 3 3結腸1.02±0.04 7.28±3.43a 7.19±0.06a 8.45±0.05a 11.564*直腸1.05±0.05 2.32±0.27a 5.17±0.13ab 8.30±0.08abc 1 264.738*t 0.812 2.497 24.436*2.754
Tab.7 Comparison of CGRP integrated optical density values in the colorectal and rectal tissues between four groups of rats表7 4組大鼠結、直腸組織中CGRP表達水平的比較(IOD,±s)
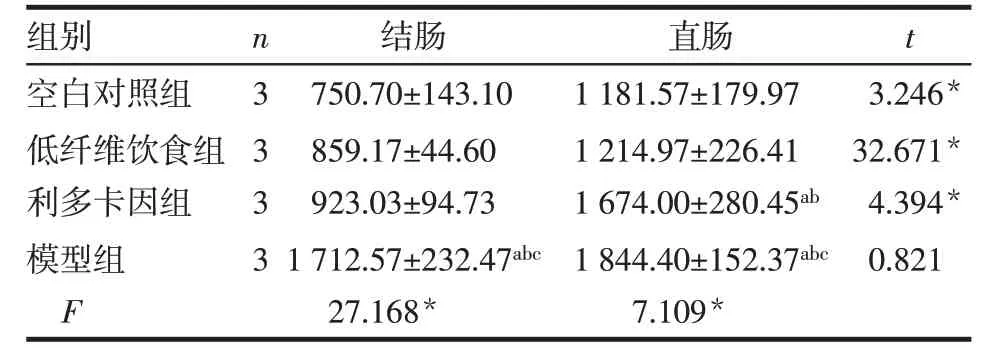
Tab.7 Comparison of CGRP integrated optical density values in the colorectal and rectal tissues between four groups of rats表7 4組大鼠結、直腸組織中CGRP表達水平的比較(IOD,±s)
組別空白對照組低纖維飲食組利多卡因組模型組F n 3 3 3 3結腸750.70±143.10 859.17±44.60 923.03±94.73 1 712.57±232.47abc 27.168*直腸1 181.57±179.97 1 214.97±226.41 1 674.00±280.45ab 1 844.40±152.37abc 7.109*t 3.246*32.671*4.394*0.821
2.6 CGRP 蛋白在各組大鼠結、直腸組織中的表達情況 各組結、直腸組織中CGRP 蛋白表達差異均無統計學意義,見圖4、5,表8。

Fig.4 The expression of CGRP protein in the colon tissue of rats in four group圖4 4組大鼠結腸組織中CGRP蛋白的表達情況

Fig.5 The expression of CGRP protein in rectal tissue ofrats in four group圖5 4組大鼠直腸組織中CGRP蛋白的表達情況
Tab.8 Relative expression levels of CGRP protein in colon and rectum tissues of rats in four group表8 4組大鼠結、直腸中CGRP蛋白的相對表達量(±s)

Tab.8 Relative expression levels of CGRP protein in colon and rectum tissues of rats in four group表8 4組大鼠結、直腸中CGRP蛋白的相對表達量(±s)
均P>0.05
組別空白對照組低纖維飲食組利多卡因組模型組F n3 3 3 3結腸0.28±0.12 0.31±0.21 0.30±0.23 0.47±0.14 0.702直腸0.16±0.05 0.16±0.12 0.23±0.11 0.46±0.30 2.039 t 1.599 1.074 0.476 0.052
3 討論
FDD是一類以長期的排便困難、排便不暢、排便次數減少、糞便干結及量少等功能型便秘為主要臨床表現,伴盆底肌不松弛甚至反常收縮、直腸推力不足的功能性疾病。目前,國際上沒有公認的FDD 模型,關于動物模型的研究大多著眼于功能性便秘的模型,包括慢傳輸型、出口梗阻型、瀉劑型等。國內有研究通過使用直腸縮窄法構建出口梗阻型便秘模型,但是出口梗阻型便秘并不能完全解釋FDD[7-8]。本課題組采用低纖維飲食聯合肛門局部注射亞甲藍法建立FDD 大鼠模型,結果顯示,低纖維飲食組和利多卡因組大鼠盡管排便功能與空白對照組均無明顯差異,但是糞便干結、變細,顏色變深,糞便質量明顯低于空白對照組,符合功能性便秘的臨床特點,而模型組除出現了糞便質量降低,顏色變深,糞便變硬等功能性便秘的特點外,同時還出現了排便功能的異常,更符合FDD 中排便推動力不足的臨床特點[9-10]。FDD 的發病機制尚不清楚,目前普遍認為腦-腸軸調節機制是其主要的神經機制。腦-腸軸的紊亂是產生復雜胃腸道狀態的關鍵因素,研究提示FDD 以腸道動力異常和內臟感覺異常為主要表現,而這些表現與腦-腸軸中腦腸肽的異常表達有關[11]。
CGRP 作為一種內源性神經肽,廣泛分布于中樞和外周神經系統,在腸神經系統內,其主要分布于黏膜下叢的初級傳入神經細胞內,傳遞腸腔或腸壁的各種物理性和化學性刺激信號,參與調節胃腸道的功能活動。一方面,CGRP 對肌肉的松弛作用較收縮作用強10 倍,CGRP 能抑制結腸縱行肌、環行肌、直腸縱行肌和肛門內括約肌的收縮,同時外周應用CGRP可以抑制結腸運動,使結腸轉運時間延長,排便次數減少[12]。在本研究中,FDD 大鼠結腸中CGRPmRNA表達量較空白對照組升高;免疫組化結果顯示CGRP 蛋白表達水平較其余組升高,但蛋白免疫印跡結果顯示各組CGRP蛋白表達水平無明顯差異,2 種檢測方法的結果差異可能與樣本量較小有關,本研究免疫組化結果與以往研究中慢性便秘患者結腸組織CGRP的表達基本一致[12];同時,本研究在大鼠直腸組織中亦發現了類似結果,提示CGRP 表達上調對結腸及直腸的運動具有一定的抑制作用,導致大鼠產生了一系列功能性便秘的癥狀[13]。另一方面,CGRP 也是促炎癥性感覺性神經肽,在腸道感覺神經的逆向性釋放下可引起神經源性炎癥。本研究結果顯示,FDD 大鼠結腸及直腸組織中CGRP mRNA 及蛋白(免疫組化法)表達水平較空白對照組升高,提示FDD 大鼠結腸及直腸中可能存在低炎癥表現。由于CGRP通過傷害性信息的傳導來傳遞腸腔或腸壁的各種物理性和化學性刺激信號,同時在痛覺的產生與傳遞過程中使炎性介質的釋放增加或加強致疼痛效應,以增加內臟的痛覺,筆者認為這種低炎癥表現也可能是導致FDD 腸道動力異常和腹痛的原因[14-15]。此外,與低纖維飲食組比較,模型組大鼠結腸組織中CGRPmRNA 無明顯變化,而直腸組織中其表達水平明顯升高,提示FDD大鼠直腸中的CGRP對腸道功能的調節作用及促炎癥作用,可能與正常大鼠及低纖維飲食誘導的功能性便秘大鼠均存在差異。
CGRP 作為調控胃腸道功能的重要神經遞質,其對胃腸道運動的抑制作用可能與減少腸神經系統中膽堿能神經傳遞有關[5]。乙酰膽堿(acetylcholine,Ach)是腸壁內最經典的胃腸動力興奮性神經遞質,目前普遍認為其對腸道運動起著主要調節作用[16]。AchE是Ach的水解酶,既可以作為膽堿能神經元的標志物,也能夠用于研究生理或病理狀態下胃腸運動的變化[17]。AchE作用于平滑肌M受體,可開放質膜上L型Ca2+通道使Ca2+內流而加強腸肌收縮,在胃腸蠕動中發揮啟動性作用,也可以通過調節釋放其他興奮性遞質,進而調節腸神經系統的紊亂[18]。有研究表明,慢性便秘結腸Ach的釋放明顯降低,通過對膽堿能的調節可明顯改善便秘的癥狀[19]。本研究結果顯示,FDD大鼠結腸組織中AchE含量低于空白對照組和低纖維飲食組,直腸組織中AchE含量低于空白對照組、低纖維飲食組和利多卡因組;各組大鼠直腸組織中AchE 含量均明顯低于結腸組織,提示FDD 大鼠結、直腸組織中CGRP 的表達異常可導致AchE 活性降低,且其對直腸組織中AchE 活性的抑制作用更為顯著。
綜上所述,在FDD 大鼠模型中,大鼠糞便干結、排便功能下降,結、直腸CGRP mRNA 及蛋白表達水平均升高,AchE 含量降低,CGRP 與AchE 的異常分泌可能與FDD發病的神經機制有關。

