酶解牡丹籽蛋白抗氧化特性的研究
王穎穎,李迎秋
(齊魯工業大學(山東省科學院) 食品科學與工程學院,濟南 250353)
牡丹籽油因富含不飽和脂肪酸(>90%),尤其是對人體營養與健康有益的α-亞麻酸(>40%),已被應用于各種食品和保健品中[1]。而從榨油后殘留的牡丹籽粕中提取的牡丹籽蛋白具有合理的氨基酸組成和良好的功能特性,是一種優質的蛋白質資源,可作為食品工業中功能蛋白的替代物[2]。
部分食品在運輸貯藏過程中易受到溫度、水分和光等外界因素的影響,常會發生脂質或者蛋白氧化,從而導致食品的品質降低,貨架期縮短,并產生對人體健康有害的代謝物[3-4]。因合成抗氧化劑存在對人體的安全風險,所以用于減少食品氧化的天然抗氧化劑受到大多數研究者的青睞。大量研究表明,天然抗氧化劑的添加對食品表現出保鮮、延緩氧化、產品護色等方面的良好效果[5]。而由酶解天然蛋白質制得的活性肽作為抗氧化劑應用于食品行業中也具有良好的抗氧化效果[6-7]。如由堿性蛋白酶和復合蛋白酶順序酶解得到的玉米蛋白水解物,在生雞肉糜中僅添加0.05%即可有效地延緩脂質的氧化,提高生雞肉糜的外觀和食用品質,延長生雞肉糜的儲存期。部分學者也從牡丹籽中分離得到可清除體內自由基、具有抗氧化作用的牡丹籽抗氧化肽,顯示了牡丹籽蛋白能夠作為水溶性抗氧化劑的新資源[8]。因此,為了提高牡丹籽加工副產物的綜合利用率和產品附加值,本研究的目的是為了探討蛋白酶和水解時間對牡丹籽蛋白水解物分子量大小、氨基酸組成和抗氧化性能的影響,以期為牡丹籽蛋白水解物作為抗氧化劑應用于食品工業中提供理論基礎和數據支持。
1 試驗儀器與材料
PB-10標準型pH計 德國賽多利斯有限公司;UV-1900雙光束紫外-可見分光光度計 上海元析儀器有限公司;TGL-16M臺式高速冷凍離心機 上海盧湘儀離心機儀器有限公司;L-8800氨基酸自動分析儀 日本日立公司;SCIENTZ-18N普通型冷凍干燥機 寧波新芝凍干設備股份有限公司;RE-52A旋轉蒸發器 上海亞榮生化儀器廠。
牡丹籽:購于山東菏澤華瑞科技有限公司;堿性蛋白酶和中性蛋白酶:購于諾維信(中國)有限公司;正己烷、三氯乙酸(TCA)、硫酸亞鐵(FeSO4·7H2O)、H2O2、氯化亞鐵(FeCl2)、鐵氰化鉀(K3[Fe(CN)6])、氯化鐵(FeCl3):購自國藥集團化學試劑有限公司;2,2'-聯氮-雙(3-乙基苯并噻唑啉-6-磺酸)二胺鹽(2,2'-azino-bis(3-ethylbenzothi azoline-6-sulfonic acid) diammonium salt,ABTS):購自上海阿拉丁生化科技股份有限公司;1,10-菲啰啉和菲啰嗪:購自美國Sigma公司;其他試劑均為分析純。
2 試驗方法
2.1 牡丹籽蛋白的制備
2.1.1 牡丹籽脫脂
將脫殼的牡丹籽在高速粉碎機中進行粉碎,取已粉碎的牡丹籽粉100 g于錐形瓶中并加入300 mL正己烷與之充分混勻,放置搖床中,在室溫下脫脂2 d,脫脂完全后的牡丹籽粉在通風櫥中干燥至正己烷完全揮發后過80目篩子,即可得到脫脂牡丹籽粉。
2.1.2 牡丹籽蛋白的制備
取80 g脫脂牡丹籽粉于1 L的燒杯中,加入800 mL的蒸餾水充分攪拌均勻后,用1.0 mol/L的NaOH將溶液的pH值調節至9.50,置于50 ℃的水浴鍋中提取3.5 h,提取結束冷卻至室溫之后,將其在4 ℃,6000 r/min下離心5 min得到上清液。用1.0 mol/L的HCl調節上清液的pH值至3.60(等電點),再次離心(6000 r/min, 5 min)得到沉淀,最后將沉淀用蒸餾水洗至中性于-80 ℃冷凍干燥即得牡丹籽蛋白,樣品儲存在-20 ℃冰箱中備用。
2.2 蛋白酶活力的測定
采用福林酚比色法對蛋白酶進行酶活檢測[9],并計算其酶活力。
X=[(A×K)/10]×4×n。
式中:X為樣品酶活力,U/g;A為樣品吸光度值;K為根據標準曲線求得的吸光常數;4為反應總體積,mL;10為反應時間10 min;n為稀釋倍數。
2.3 牡丹籽蛋白的酶解
稱取2 g凍干的牡丹籽蛋白溶于100 mL的蒸餾水配制2%的蛋白溶液(W/V),調節溶液的pH值后置于已設定溫度的水浴鍋中一段時間,使其達到堿性蛋白酶(pH 8.0,60 ℃)和中性蛋白酶反應(pH 7.0, 55 ℃)的最適條件。然后添加相同酶活(3000 U/g)的堿性蛋白酶和中性蛋白酶于混合溶液中并在恒溫水浴鍋中進行酶解。反應過程中,通過連續加入1 mol/L NaOH溶液來維持酶解液的pH值恒定。分別在1,2,3,4 h收集水解液,并在100 ℃下加熱10 min使酶失活。冷卻至室溫后,在8000 r/min (4 ℃)下離心20 min取上清液,將所得上清液冷凍干燥,在-20 ℃保存至下次使用。
2.4 SDS-PAGE凝膠電泳
使用不連續緩沖液系統在15%分離凝膠和3%濃縮凝膠上進行還原性SDS-PAGE電泳。取2.3.3中等體積(100 μL)的水解液(20 mg/mL)與100 μL還原性樣品緩沖液混合在100 ℃下煮沸5 min,冷卻至25 ℃后,每種樣品混合物各上樣10 μL,在分離凝膠上以30 mA運行2 h,然后在濃縮凝膠上以15 mA運行1 h。,將凝膠染色并脫色過夜即可顯示條帶。
2.5 氨基酸組成的測定[10]
分別稱取牡丹籽蛋白和水解產物各0.05 g于10 mL的水解管中,每管中加入10 mL 6 mol/L的HCl充分混勻,連續吹入氮氣3次后,封口在110 ℃下進行酸水解22~24 h。水解結束后用雙層濾紙過濾并用超純水定容至50 mL,各取1~2 mL濾液在50 ℃下旋轉蒸發以除去HCl后,加入適量0.02 mol/L的HCl將樣品溶液稀釋5倍,最后通過0.22 μm微濾膜過濾上樣。氨基酸含量計算公式為氨基酸(g)/蛋白質(100 g)。
2.6 ABTS自由基清除能力測定[11]
ABTS自由基溶液的配制:向燒杯中加入200 mL濃度為7 mmol/L的ABTS溶液和3.52 mL濃度為2.45 mmol/L的過硫酸鉀,超聲2 min使之充分混合,置于黑暗處避光反應12~16 h,之后用濃度為0.05 mol/L,pH 7.4的磷酸鹽緩沖液稀釋使其在734 nm波長條件下的吸光度值為0.70±0.02,即為ABTS自由基溶液,在室溫條件下靜置30 min即可使用。
分別稱取一定量的TPSP、堿性蛋白酶和中性蛋白酶水解物溶于蒸餾水中,配制成濃度為0.5 mg/mL的溶液。取0.15 mL上述樣品與2.85 mL ABTS自由基溶液混合均勻,在室溫下避光反應10 min,待其穩定后在734 nm處測定樣品的吸光度值At。空白組是用0.15 mL的蒸餾水代替樣品溶液,測得空白組的吸光值為A0,每組測定重復3次。ABTS自由基清除率的計算公式:
ABTS自由基清除率(%)=[(A0-At)/A0]×100。
2.7 ·OH自由基清除能力測定[12]
將TPSP、堿性蛋白酶和中性蛋白酶水解物溶于蒸餾水中配制成濃度為1.5 mg/mL的溶液。依次取1 mL 0.75 mmol/L 1,10-菲啰啉,2 mL 0.2 mol/L磷酸鹽緩沖溶液(PB,pH 7.4),1 mL 0.75 mmol/L FeSO4·7H2O和1 mL上述樣品溶液混勻,最后加入1 mL 0.01%(V/V)H2O2溶液,于37 ℃水浴鍋中反應1 h,在536 nm處測定溶液的吸光值A1;空白組取1.0 mL水代替樣品測定吸光值A2;對照組取2.0 mL水代替樣品和H2O2測定吸光值A3,每組測定重復3次。·OH自由基清除率的計算公式:
·OH自由基清除率(%)=[(A1-A2)/(A3-A2)]×100。
2.8 Fe2+鰲合能力測定[13]
取1 mL濃度為0.5 mg/mL的樣品溶液與2 mL 0.05 mmol/L FeCl2溶液及2 mL 0.5 mmol/L菲啰嗪溶液混勻,在室溫下反應15 min,于562 nm處測定吸光值A1。以1 mL蒸餾水代替樣品,測定吸光值A0,每組測定重復3次。Fe2+鰲合率的計算公式:
Fe2+鰲合率(%)=[(A0-A1)/A0]×100。
2.9 還原力測定[14]
取1 mL樣品溶液(1.5 mg/mL)與2.5 mL濃度為0.2 mol/L的磷酸鹽緩沖液(pH 6.6)及2.5 mL 的1% K3Fe(CN)6,在恒溫50 ℃水浴鍋中反應20 min,隨后迅速使之冷卻,并加入2.5 mL 10%的TCA溶液,以3000 r/min的轉速離心10 min后分別取上清液2.5 mL,然后加入2.5 mL的蒸餾水及0.5 mL的0.1% FeCl3溶液,使之充分混合均勻,于室溫下反應10 min后,在700 nm處測定吸光值,用蒸餾水調零,每個測定重復3次。
3 結果與分析
3.1 酶活測定
由于蛋白酶在實驗室存放過程中其酶活力會逐漸喪失,故需要在試驗前測定堿性蛋白酶和中性蛋白酶。由酪蛋白濃度與吸光值得到的標準曲線方程為y=0.0104-0.0087(R2=0.9956)見圖1,計算所得K值為97.90,從而得到試驗中堿性蛋白酶活力為1.8×105U/g,中性蛋白酶的酶活力為1.1×105U/g。
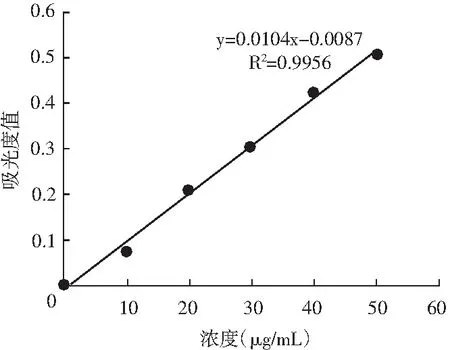
圖1 酪氨酸標準曲線Fig.1 The standard curve of tyrosine
3.2 SDS-PAGE電泳分析
分子量的大小和氨基酸組成是影響多肽生物活性和功能特性的兩個重要因素。以往的研究表明,蛋白質水解物擁有高含量低分子量肽的抗氧化作用強于高分子量肽。堿性蛋白酶和中性蛋白酶酶解牡丹籽蛋白還原性SDS-PAGE電泳見圖2。

圖2 牡丹籽蛋白水解物的SDS-PAGE電泳圖Fig.2 SDS-PAGE electrophoretogram of TPSP hydrolysates
由圖2可知,在還原性條件下,牡丹籽蛋白(TPSP)的電泳條帶主要包括60,48,38,23 kDa 4個條帶。根據Gao等先前的結果,60 kDa條帶是TPSP中的主要組分,其主要由酸性亞基(38 kDa)和堿性亞基(23 kDa)組成。在中性蛋白酶水解物中分子量為48,38,23 kDa的3個條帶消失,一些小分子量條帶經中性蛋白酶酶解后出現在分子量15 kDa以下,而60 kDa的條帶隨著時間的增加并未發生改變。對于堿性蛋白酶水解物,在牡丹籽蛋白中出現的所有蛋白質條帶均完全消失,產生的低分子量條帶(<15 kDa)強度隨著水解時間的增加而逐漸增加。Shazly等[15]也得到了類似的結果。他們報道稱在還原條件下,堿性蛋白酶可廣泛水解所有酪蛋白組分,產生<3.5 kDa的分子量條帶在SDS-PAGE圖譜中。在長達4 h的水解過程中,經堿性蛋白酶水解的水解物中觀察到了從較高分子量帶向較低分子量帶的明顯轉變,說明堿性蛋白酶具有較強的水解牡丹籽蛋白的能力,這可能是因為堿性蛋白酶是一種非特異性的內肽酶,適于生產小分子量肽,同時這也可能有利于獲得具有較高活性的抗氧化肽。
3.3 氨基酸組成分析

Table 1 牡丹籽蛋白水解物的氨基酸組成Table 1 The amino acid composition of TPSP hydrolysates
除了分子量外,氨基酸的組成也會影響肽的抗氧化活性[16]。由表1可知,堿性蛋白酶和中性蛋白酶水解未對牡丹籽蛋白的氨基酸組成的種類造成影響,但對氨基酸的含量產生了顯著的影響。牡丹籽蛋白及其酶解產物均含有豐富的天冬氨酸(Asp)、谷氨酸(Glu)、亮氨酸(Leu)和精氨酸(Arg)。其中,Asp和Glu在牡丹籽蛋白中共占整個氨基酸含量的22.67%,而在堿性蛋白酶和中性蛋白酶水解物中占據23.33%~28.61%。牡丹籽蛋白及其酶解產物富含酸性氨基酸(Asp+Glu=NCAA),這可能是因為酸性氨基酸為牡丹籽蛋白中典型的氨基酸。之前的研究報道在油菜籽蛋白和澳大利亞菜籽粕蛋白及其水解物中也存在高含量的酸性氨基酸[17-18]。另外,呈味氨基酸Asp、Glu、甘氨酸(Gly)和丙氨酸(Ala)在堿性蛋白酶水解物和中性蛋白酶水解物中分別占據30.15%~36.03%和29.38%~32.79%,說明牡丹籽蛋白水解物均能夠提高原料的鮮味和甘味,可用來開發調味料。
疏水氨基酸(HAA)在堿性蛋白酶水解物中的含量隨著酶解的進行逐漸增加,占總氨基酸含量的23.85%~28.26%,而在中性蛋白酶水解物中HAA的含量呈現先增加后減少的趨勢,在酶解3 h時達到最大值25.56%。早有研究表明NCAA側鏈中的羧基和氨基被認為是金屬離子的螯合劑[19]。同時,也有研究報道稱蛋白質水解產物的HAA具有供電子能力,從而賦予肽較強的自由基清除能力。因此,牡丹籽蛋白酶解產物中高含量的NCAA和HAA相對于未水解蛋白,這可能說明堿性蛋白酶和中性蛋白酶酶解有利于提高牡丹籽蛋白的抗氧化活性。除此之外,與牡丹籽蛋白相比(63.03%),總氨基酸含量(64.62%~69.31%)在堿性蛋白酶和中性蛋白酶水解物中均有所提升,除了中性蛋白酶在水解1 h時(62.31%)略微下降。而且,堿性蛋白酶和中性蛋白酶水解物含有豐富的必需氨基酸,其EAA/TAA的比值(30.31%~31.68%)明顯高于未水解蛋白(28.31%),這說明堿性蛋白酶和中性蛋白酶水解有利于提高牡丹籽蛋白的營養價值。
3.4 抗氧化活性的分析
3.4.1 ABTS自由基的清除活性
濃度為0.5 mg/mL的牡丹籽蛋白及其酶解產物對ABTS自由基清除效果見圖3。
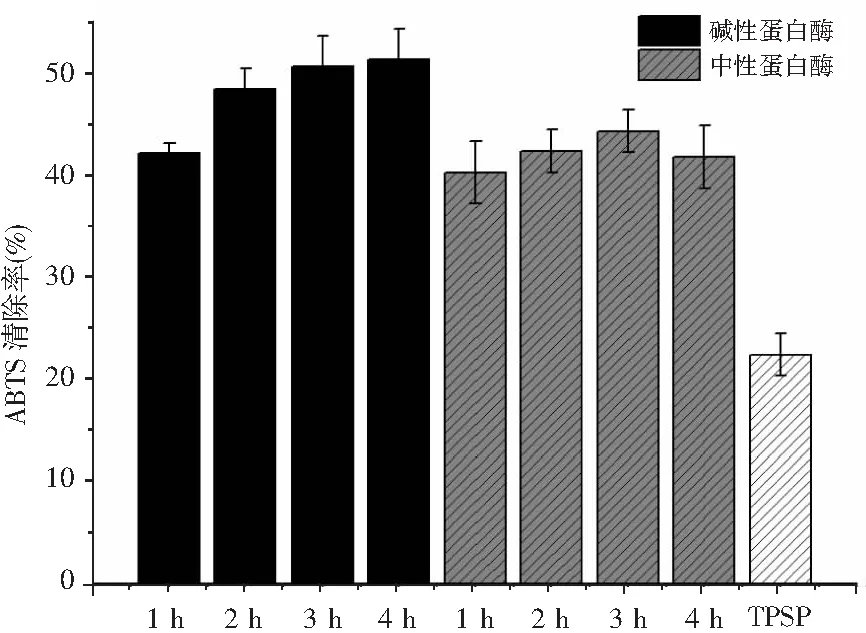
圖3 牡丹籽蛋白水解物的ABTS自由基清除率Fig.3 ABTS free radical scavenging rate of TPSP hydrolysates
堿性蛋白酶和中性蛋白酶水解有利于提高牡丹籽蛋白對ABTS自由基的清除活性。隨著酶解反應的進行,中性蛋白酶水解物對ABTS自由基清除能力呈現先增加后減小的趨勢,在水解3 h時達到最大值44.23%,而隨著水解反應時間增加到4 h,其清除率從44.23%下降到41.73%。而與中性蛋白酶相比,堿性蛋白酶水解牡丹籽蛋白4 h后的水解物對ABTS自由基的清除能力最高,達到了51.22%。堿性蛋白酶水解物對ABTS自由基的清除能力隨著水解時間的增加而增加。牡丹籽蛋白水解物對ABTS自由基清除活性的差異可能是由于酶的種類和水解時間對肽的分子量大小和氨基酸組成造成的影響。Rajapakse等報道稱蛋白水解物的自由基清除作用與HAA或肽的疏水性有關。由表1可知,HAA的含量在堿性蛋白酶水解物中(23.85%~28.26%)明顯高于中性蛋白酶水解物(23.10%~25.56%)。因此,高含量的HAA增強了堿性蛋白酶水解物在脂類食品體系中的溶解度,從而促進其與引起氧化損傷的自由基之間更好地相互作用。而中性蛋白酶在酶解4 h時對ABTS自由基清除能力低于水解3 h,表明有限的水解相比于過度水解可導致更好的抗氧化能力,因為過度水解可導致肽的HAA或活性基團被水解酸,中性蛋白酶水解物在4 h時HAA含量的下降證明了這一點。
3.4.2 ·OH自由基清除活性
作為在人體內產生的活性氧種類之一,·OH自由基可以很容易地與生物分子發生反應,例如氨基酸、蛋白質、DNA,并導致機體生理異常。因此,清除·OH自由基可以防止某些疾病的產生。牡丹籽蛋白及其酶解產物(濃度1.5 mg/mL)對·OH自由基的清除能力見圖4。
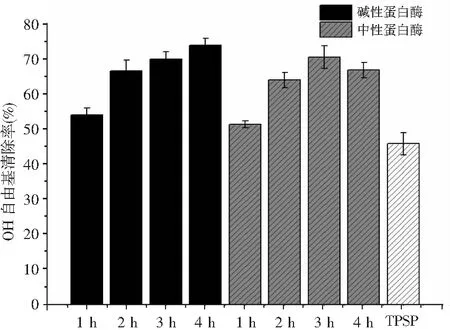
圖4 牡丹籽蛋白水解物的·OH自由基清除活性Fig.4 ·OH free radical scavenging activity of TPSP hydrolysates
由圖4可知,堿性蛋白酶和中性蛋白酶水解產物清除·OH自由基的效果相當。在水解的1 h時,堿性蛋白酶和中性蛋白酶酶解并未明顯提高蛋白的·OH自由基清除能力,而隨著水解反應的進一步進行,水解物的·OH自由基清除活性顯著性增加。當水解反應到3 h時,堿性蛋白酶和中性蛋白酶水解物對·OH自由基的清除能力從45.69%(TPSP)分別增加到69.81%和70.3%。在整個水解過程中,中性蛋白酶水解物的最大清除率發生在水解3 h時。然而,對于堿性蛋白酶水解物,·OH自由基清除能力的變化趨勢與ABTS自由基清除活性相似,隨著水解時間的增加而增加,在水解反應4 h時達到最大清除率73.66%。堿性蛋白酶和中性蛋白酶在酶解1 h后可提高蛋白的·OH自由基清除能力,這可能是由于隨著水解反應的進行更多的HAA被釋放出來。
3.4.3 Fe2+螯合能力
過渡金屬鐵和銅等過渡金屬離子可作為Fenton反應的催化劑,促進超氧陰離子的產生和過氧化氫向羥基自由基的轉化,從而引發脂質過氧化反應。因此,具有螯合金屬離子能力的水解產物可以有效地減少脂質氧化。牡丹籽蛋白及其酶解產物(濃度0.5 mg/mL)對Fe2+的螯合能力見圖5。

圖5 牡丹籽蛋白水解物的Fe2+螯合能力Fig.5 Fe2+ chelating capacity of TPSP hydrolysates
由圖5可知,堿性蛋白酶和中性蛋白酶水解僅1 h,Fe2+的螯合能力分別從45.12%(TPSP)提高到63.36%和60.80%。隨著酶解反應進行到3 h,其螯合率分別達到最大值70.39%和67.77%。這一結果說明,與未水解蛋白相比,水解肽作為電子或氫原子供體的能力有所提高。通常情況下,Fe2+的螯合能力歸功于蛋白水解物中存在有高含量的NCAA,其側鏈中的羧基和氨基被認為是金屬離子的螯合劑。經氨基酸組成(見表1)分析證實,堿性蛋白酶和中性蛋白酶水解物均含有豐富的NCAA。
3.4.4 還原力
在測定自由基清除劑還原力試驗中,強還原物質可以用作電子和氫的良好供體,使游離自由基變為穩定的物質,從而阻礙自由基鏈式反應的進行,并與過氧化物的前體物質結合,防止過氧化物的產生,從而達到抗氧化劑的作用[20]。有關研究顯示物質的抗氧化活性與還原力之間存在著正相關性關系。還原性物質可以將溶液中的Fe3+還原為Fe2+,而自身發生氧化,使溶液的顏色發生改變,通過在700 nm波長下測定其吸光值可計算出鐵被還原的程度,從而得到該物質的還原力的大小。牡丹籽蛋白及其酶解產物(濃度1.5 mg/mL)的還原力效果見圖6。在中性蛋白酶水解的1,2,3 h內,所對應的還原力值從0.3850~0.3670無明顯變化,而在水解4 h后出現最大值0.4127。相反,在堿性蛋白酶水解的4 h,還原力值從0.3533增加到0.4473。經堿性蛋白酶和中性蛋白酶水解后的水解物還原力得到明顯提高。蛋白質水解產物還原能力的提高可以解釋為蛋白質的肽鏈斷裂被水解成小分子肽,從而具有抗氧化活性的氨基酸(如天冬氨酸、谷氨酸和組氨酸)的釋放和自由基清除能力的提高。

圖6 牡丹籽蛋白水解物的還原力Fig.6 Reducing capacity of TPSP hydrolysates
4 結論
堿性蛋白酶具有較強的水解牡丹籽蛋白的能力,僅在酶解1 h即可完全水解牡丹籽蛋白的所有條帶。且其水解物具有較好的清除ABTS、·OH自由基和鰲合Fe2+的能力。堿性蛋白酶水解物中豐富的酸性氨基酸(Asp+Glu=NCAA)可作為Fe2+的鰲合劑,可以有效地抑制過渡金屬離子(尤其是過渡金屬鐵)作為Fenton反應催化劑,引發的超氧陰離子及羥基自由基的產生,從而減少脂質過氧化反應。高含量的疏水性氨基酸(HAA)可以增強堿性蛋白酶水解物在脂類食品體系中的溶解度,從而促進其與引起氧化損傷的自由基之間更好地相互作用。因此,上述結果表明牡丹籽蛋白經堿性蛋白酶解后得到的水解物具有抑制食品因油脂或蛋白質氧化造成的腐敗變質的潛力。本研究可為牡丹籽蛋白水解物作為一種天然抗氧化劑添加到食品中的實際應用效果提供參考依據。今后有必要開展堿性蛋白酶水解物在食品及其調味品中的實際應用研究,以拓展牡丹籽蛋白肽作為天然抗氧化劑在食品中的應用和開發。

