生長(zhǎng)抑素和耐熱木聚糖酶的融合表達(dá)及性質(zhì)研究
黃坤龍 蘇小運(yùn) 姚斌
(中國(guó)農(nóng)業(yè)科學(xué)院飼料研究所 農(nóng)業(yè)部飼料生物技術(shù)重點(diǎn)開放實(shí)驗(yàn)室,北京 100081)
生長(zhǎng)抑素又名生長(zhǎng)激素釋放抑制因子,是抑制動(dòng)物生長(zhǎng)的一類激素。1968年在綿羊下丘腦中發(fā)現(xiàn)[1],隨后被分離、提取并命名為生長(zhǎng)抑素(Somatostatin,SS)[2]。一般認(rèn)為,SS是一組在分子結(jié)構(gòu)上密切相關(guān)和生物效應(yīng)上相似的物質(zhì),并且所有哺乳動(dòng)物SS的氨基酸序列都相同,沒有種屬差異,其中SS-14是SS的主要生物活性結(jié)構(gòu)[3-4],它是分子量為1.639 kD的14肽。天然SS-14成環(huán)狀,在3位和14位半胱氨酸之間形成二硫鍵。除SS-14以外,還有SS-28和 SS-25等其它形式。
SS廣泛分布在動(dòng)物機(jī)體的神經(jīng)系統(tǒng)、外周神經(jīng)系統(tǒng)、大腦皮層和消化道等。SS通過其受體(Somatostatin receptor,SSR)發(fā)揮作用實(shí)現(xiàn)對(duì)腦垂體功能的調(diào)節(jié)以及抑制胃的蠕動(dòng)、胃酸分泌、腸道對(duì)糖類氨基酸以及電解質(zhì)的吸收。實(shí)驗(yàn)表明SS免疫可以中和體內(nèi)SS,進(jìn)而促進(jìn)動(dòng)物生長(zhǎng)和提高生產(chǎn)性能。用SS抗體免疫幼虹鱒魚五周后,較對(duì)照組體重有所增加[5]。利用SS免疫豬[6]、羔羊和小牛,對(duì)其生長(zhǎng)有一定的促進(jìn)作用[7-10]。SS的免疫方式可以分為被動(dòng)免疫和主動(dòng)免疫[7-10],其中被動(dòng)免疫為給動(dòng)物注射SS抗血清,即注射抗體,動(dòng)物直接對(duì)SS產(chǎn)生免疫力,但該法的缺點(diǎn)在于抗血清對(duì)動(dòng)物作用時(shí)間短,需要不斷加強(qiáng)免疫及改善在動(dòng)物生產(chǎn)性能上的應(yīng)用。另外一種免疫方式是主動(dòng)免疫,通過導(dǎo)入抗原物質(zhì)來激發(fā)動(dòng)物主動(dòng)對(duì)外來SS抗原產(chǎn)生抗體,作用時(shí)間比較長(zhǎng),更具應(yīng)用價(jià)值。
植物源性的飼料包含大量的木聚糖。木聚糖是一種雜聚多糖[11],其主鏈?zhǔn)怯蛇拎咎峭ㄟ^β-1,4糖苷鍵連接而形成的,在主鏈的吡喃木糖環(huán)的2號(hào)和3號(hào)位有不同的取代基。這些取代基包括4-O-甲基-D-葡萄糖醛酸殘基、α-L-阿拉伯糖殘基、O-乙酰基等,其中α-L-阿拉伯糖殘基上又可與阿魏酸和香豆酸等酯化[12-13]。木聚糖是半纖維素的主要成分,它對(duì)維持細(xì)胞纖維的凝聚力和細(xì)胞壁的完整性起著非常重要的作用,半纖維素是植物細(xì)胞壁的主要組成成分,也是自然界中除纖維素之外第二豐富的再生資源[14]。木聚糖酶能夠有效地降解木聚糖主鏈的β-1,4糖苷鍵,從而起到破壞植物細(xì)胞壁、促進(jìn)營(yíng)養(yǎng)物質(zhì)釋放的重要作用。目前木聚糖酶研究最多的為GH10和GH11家族,GH10家族主要來源于細(xì)菌、真菌和植物,催化結(jié)構(gòu)域?yàn)棣谅菪挺抡郫B片層構(gòu)成的八桶狀結(jié)構(gòu),有的木聚糖酶最適溫度達(dá)到100℃,而GH11家族則耐堿和耐熱性相對(duì)較差[15]。
在飼料里添加木聚糖酶可以有效地降低動(dòng)物消化道中食糜的黏度、提高干物質(zhì)的消化率和營(yíng)養(yǎng)吸收,從而提高飼料的利用率。國(guó)內(nèi)外大量的研究表明,在飼料里添加木聚糖酶能夠顯著提高動(dòng)物的生產(chǎn)性能。汪敬等[16]在飼糧中添加富含木聚糖酶的酶制劑,使23-38 kg的生長(zhǎng)肥育豬日增重和飼料轉(zhuǎn)化率分別提高8.4%和4.3%。可見,在單胃動(dòng)物家畜的日糧中添加木聚糖酶能有效消除抗?fàn)I養(yǎng)因子的負(fù)作用并提高飼料利用率和動(dòng)物的生產(chǎn)性能。
SS-14是只有14個(gè)氨基酸的小肽,在體內(nèi)穩(wěn)定性較差,Spencer等[17]曾使用α-球蛋白和BSA作為載體蛋白進(jìn)行了SS的偶聯(lián)成功制備了抗原,但制備成本高的問題卻沒有得到解決。Ding等[18]為了改善SS的代謝動(dòng)力學(xué),將人血清白蛋白(HSA)和兩拷貝SS-14融合表達(dá),但HSA有585個(gè)氨基酸,相較于SS的14個(gè)氨基酸較多,SS氨基酸所占融合蛋白氨基酸比例2.3%,而且HSA只能單純的作為蛋白質(zhì)來源,不能發(fā)揮其它作用;而木聚糖酶在飼料中廣泛添加,且具有很好的促生長(zhǎng)作用。因此,本研究嘗試使用木聚糖酶和SS-14融合來制備SS的融合蛋白,具體為將嗜熱細(xì)菌Caldicellulosiruptor bescii來源的木聚糖酶CbXyn10C與SS進(jìn)行融合表達(dá),以期獲得具有SS抗原性與免疫原性的重組蛋白,且融合蛋白又保留木聚糖酶的活性,為提高飼料利用率和提高動(dòng)物生長(zhǎng)和生產(chǎn)性能提供新思路。
1 材料與方法
1.1 材料
1.1.1 菌株、質(zhì)粒和實(shí)驗(yàn)動(dòng)物 畢赤酵母(Pichia pastoris)GS115、表達(dá)質(zhì)粒pPIC9和細(xì)菌C. bescii來源的木聚糖酶基因CbXyn10C由本實(shí)驗(yàn)室保存;大腸桿菌Escherichia coliTrans1-Tl和質(zhì)粒pEASY-T3購(gòu)自北京全式金生物技術(shù)有限公司。20-25 g重、6周齡BALB/c雄性小鼠由北京維通利華實(shí)驗(yàn)動(dòng)物技術(shù)有限公司提供。
1.1.2 主要培養(yǎng)基 LB培養(yǎng)基:蛋白胨1%,酵母提取物0.5%,NaCl 1%,固體培養(yǎng)基另添加2%瓊脂粉;YPD培養(yǎng)基:酵母提取物1%,蛋白胨2%,葡萄糖2%;BMGY種子培養(yǎng)基:蛋白胨2%,酵母提取物1%,甘油1%,生物素4 mg/L,YNB 13.4 g/L;BMMY誘導(dǎo)培養(yǎng)基:蛋白胨2%,酵母提取物1%,生物素4 mg/L,YNB 13.4 g/L,甲醇0.5%;MD固體培養(yǎng)基:葡萄糖20 g/L,瓊脂糖20 g/L,YNB 13.4 g/L,生物素4 mg/L。
1.1.3 試劑和儀器 櫸木木聚糖(Beechwood xylan)購(gòu)自Sigma公司;生物素購(gòu)自國(guó)藥集團(tuán)化學(xué)試劑有限公司;質(zhì)粒小提試劑盒購(gòu)自北京天根生化科技有限公司;DNA膠回收試劑盒購(gòu)自O(shè)MEGA公司;Taq酶和限制性內(nèi)切酶(EcoRI和NotI)購(gòu)自Fermentas公司;限制性內(nèi)切酶BglII 購(gòu)自TaKaRa公司;T4 DNA連接酶購(gòu)自New England Biolab公司;蛋白Marker購(gòu)自北京GeneStar生物公司,PVDF膜(0.45 μm)購(gòu)自Amersham Biosciences公司;生長(zhǎng)抑素SS-14和針對(duì)SS-14的兔IgG多克隆抗體一抗(效價(jià)1∶64 000),由南京金斯瑞生物科技有限公司制備;二抗為羊抗兔IgG-HRP或羊抗鼠IgG-HRP,分別購(gòu)自Sigma和北京陸橋技術(shù)股份有限公司;弗氏完全佐劑和不完全佐劑均為Sigma公司產(chǎn)品;DAB購(gòu)自上海生工生物工程有限公司;引物由上海捷瑞生物工程有限公司合成;測(cè)序由北京擎科生物技術(shù)有限公司完成。其他試劑均為國(guó)產(chǎn)分析純。主要儀器如下:PCR擴(kuò)增儀(美國(guó)Bio-Rad公司,型號(hào)T100),電轉(zhuǎn)儀(美國(guó)Bio-Rad公司,型號(hào)411 BR0167),凝膠成像系統(tǒng)(美國(guó)Bio-Rad公司,型號(hào)1708195),高速冷凍離心機(jī)(日本 HIMAC公司,型號(hào)CR2IGIII),酶標(biāo)儀(美國(guó)Thermo公司,型號(hào)HIMFDG),水浴鍋(上海森信公司,型號(hào)DLL-8D),恒溫培養(yǎng)箱(北京利康公司,型號(hào)SPX-250),渦旋混合器(北京同正公司,型號(hào)HQ-60-II)。
1.2 方法
1.2.1 表達(dá)載體pPIC9-CbXyn10C-SS的構(gòu)建 本實(shí)驗(yàn)室此前在大腸桿菌和畢赤酵母中均實(shí)現(xiàn)了CbXyn10C的重組表達(dá)[19]。以在畢赤酵母中進(jìn)行工程表達(dá)的質(zhì)粒pPIC9-CbXyn10C為模板,利用特異性引物CbXyn10C-F分別和CbXyn10C-R1、CbXyn10C-R2、CbXyn10C-R3進(jìn) 行3輪PCR擴(kuò) 增以獲得CbXyn10C-SS基因,具體方法如表1所示。PCR擴(kuò)增程序?yàn)椋?5℃,5 min;95℃,30 s,60℃,30 s,72℃,75 s,30個(gè) 循 環(huán);72℃,10 min。1%瓊脂糖凝膠電泳并切膠回收目的條帶。CbXyn10C-SS基因與酵母表達(dá)載體pPIC9,分別用EcoRI和NotI進(jìn)行雙酶切,電泳、切膠回收目的片段,用T4連接酶連接、轉(zhuǎn)化大腸桿菌Trans1-T1并篩選得到重組質(zhì)粒pPIC9-CbXyn10C-SS。
1.2.2CbXyn10C和CbXyn10C-SS蛋 白 在 畢 赤 酵母中的表達(dá)與純化 將pPIC9-CbXyn10C、pPIC9-CbXyn10C-SS分別用SacI單酶切以線性化質(zhì)粒,電擊轉(zhuǎn)化GS115感受態(tài)細(xì)胞并涂布于MD平板,30℃培養(yǎng)3 d。挑取單克隆于BMGY培養(yǎng)基中培養(yǎng)2 d,更換至BMMY誘導(dǎo)培養(yǎng)基繼續(xù)培養(yǎng)2 d。12 000×g離心,收集培養(yǎng)液上清篩選產(chǎn)酶克隆。將高酶活轉(zhuǎn)化子在200 mL液體培養(yǎng)基中培養(yǎng)、誘導(dǎo),同法收集培養(yǎng)液上清即為粗酶液,將其用10 kD的超濾膜包濃縮。濃縮后的酶液再對(duì)磷酸-檸檬酸緩沖液(100 mmol/L,pH7.5)超濾以脫鹽。將獲得的重組蛋白進(jìn)行SDS-PAGE電泳驗(yàn)證蛋白的大小及純度。
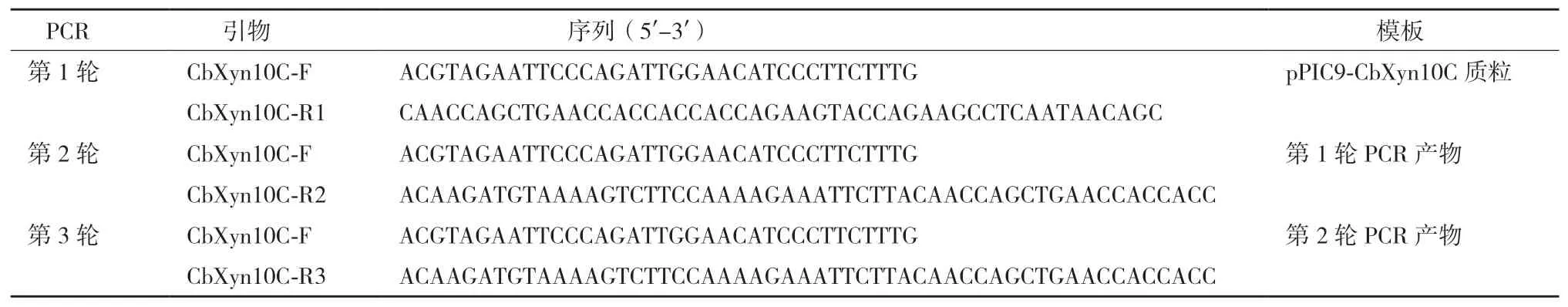
表1 PCR擴(kuò)增獲得CbXyn10C-SS基因
1.2.3CbXyn10C-SS融合蛋白中生長(zhǎng)抑素抗原性分析 將1.6 μg的CbXyn10C和CbXyn10C-SS蛋 白 分別進(jìn)行SDS-PAGE電泳,將蛋白電轉(zhuǎn)移到PVDF膜上(轉(zhuǎn)印條件:25 V,1.5A,7 min),5%脫脂牛奶4℃過夜封閉。將PVDF膜與抗SS的一抗(500×稀釋)在37℃孵育2 h,PBST(10 mmol/L磷酸鹽緩沖液,pH7.4,0.05% Tween-20)中洗膜3次,每次10 min。再將膜與HRP標(biāo)記的羊抗兔IgG在37℃孵育2 h,洗滌3次。最后將膜在含有DAB溶液中孵育,當(dāng)見到顯色條帶時(shí)立即用蒸餾水沖洗膜以終止反應(yīng)。
1.2.4CbXyn10C-SS融合蛋白中生長(zhǎng)抑素免疫原性分析 取6只6周齡BALB/c雄性小鼠,將小鼠分為2組,每組3只,第1組免疫CbXyn10C-SS蛋白,剩余小鼠做對(duì)照組,編為第2組。免疫程序如下,首免:將CbXyn10C-SS用20 mmol/L PBS稀釋至2 mg/mL,取300 μL蛋白溶液與300 μL弗氏完全佐劑混合,利用微量乳化器乳化制成濃度為1 μg/μL的疫苗,200 μL/只,頸部、背部皮下多點(diǎn)注射。二免:14 d后進(jìn)行二免,取2 mg/mL的CbXyn10C-SS 150 μL與150 μL弗氏不完全佐劑混合,利用微量乳化器乳化制成濃度為1 μg/μL的疫苗,100 μL/只,皮下多點(diǎn)注射。三免:14 d后進(jìn)行三免,方法同二免。三免7 d后斷尾采血,3 000×g離心5 min以收集血清,ELISA法檢測(cè)抗體效價(jià),如效價(jià)符合要求則三免后8 d眼眶采血收集每只小鼠血清,-20℃保存?zhèn)溆谩J褂冒唿c(diǎn)免疫(Dot-blot)方法對(duì)小鼠血清中針對(duì)SS-14的抗體進(jìn)行檢測(cè),方法如下:將倍比稀釋的SS-14(1 μg、0.5 μg、0.25 μg和0.125 μg)分 別點(diǎn)樣至PVDF膜上,室溫晾干,將膜在5%脫脂牛奶中于37℃封閉1 h。將封閉好的膜與2 000×稀釋的一抗在37℃下孵育2 h。使用PBST洗滌膜3次,每次10 min;再將膜與2 000×稀釋的HRP標(biāo)記的兔抗鼠IgG孵育2 h,PBST洗滌3次,每次10 min;將膜浸泡于DAB溶液中直到出現(xiàn)斑點(diǎn),用蒸餾水沖洗膜以終止反應(yīng)。
1.2.5CbXyn10C和CbXyn10C-SS融合蛋白木聚糖酶比活的測(cè)定 將5 mg/mL的櫸木木聚糖分別與CbXyn10C-SS蛋白(0.1 μmol/L)在和CbXyn10C-SS融合蛋白(0.1 μmol/L)在0.1 mol/L磷酸-檸檬酸緩沖溶液中混合孵育,90℃ 和95℃反應(yīng)10 min,加人1.5 mL二硝基水楊酸(DNS)[20],沸水浴煮5 min,冷卻后測(cè)定OD540,根據(jù)木糖對(duì)DNS的標(biāo)準(zhǔn)曲線計(jì)算酶活。酶活單位定義為:1個(gè)木聚糖酶活性單位(U)為以0.5%可溶性櫸木木聚糖為底物,在最適pH和最適溫度條件下每分鐘水解木聚糖生成1 μmol木糖所需的酶量。
1.2.6CbXyn10C與CbXyn10C-SS酶學(xué)性質(zhì)分析 最適pH:將5 mg/mL的櫸木木聚糖和適當(dāng)稀釋的酶液在不同緩沖液pH條件(100 mmol/L,Gly-HCl緩沖液:pH 2.0-3.0;檸檬酸-磷酸氫二鈉緩沖液:pH 3.0-7.5;Tris-HCl緩 沖 液:pH 8.0;Gly-NaOH緩 沖 液:pH 9.0-10.0)下于80℃反應(yīng)10 min。最適溫度:在最適pH(6.0)條件下將CbXyn10C、CbXyn10C-SS在不同溫度(40℃、50℃、60℃、70℃、75℃、80℃、85℃、90℃、95℃和100℃)下分別反應(yīng)10 min,測(cè)定酶活。pH穩(wěn)定性:將酶液稀釋至合適濃度在不同pH的緩沖液下37℃處理1 h后,在最適溫度和最適pH下測(cè)定剩余酶活。溫度穩(wěn)定性:將酶液分別在80℃和90℃下孵育,定時(shí)取出樣品并在最適條件下測(cè)定殘余酶活。金屬離子和化學(xué)試劑對(duì)酶活的影響:在酶促反應(yīng)體系中加入終濃度為5 mmol/L的不同金屬離子(Li+、Na+、K+、Pb+、Mg2+、Mn2+、Fe3+、Cr3+、Cu2+、Co2+、Zn2+、Ni+和Ca2+),在 該 酶的最適條件下測(cè)定酶活。動(dòng)力學(xué)常數(shù):以底物濃度為0.125-5 mg/mL、最適溫度和最適pH下分別測(cè)量CbXyn10C與CbXyn10C-SS的酶活,利用雙倒數(shù)作圖法計(jì)算得到KM、Vmax和kcat的值。
2 結(jié)果
2.1 融合基因CbXyn10C-SS的克隆及表達(dá)載體的構(gòu)建
以本室所存質(zhì)粒pPIC9-CbXyn10C為模板進(jìn)行3輪PCR擴(kuò)增,成功獲得CbXyn10C-SS融合基因。序列分析表明(圖1),CbXyn10C基因全長(zhǎng)為1 020 bp,編碼339個(gè)氨基酸,理論分子量為39.23 kD,等電點(diǎn)為6.21。在CbXyn10C和SS-14之間設(shè)計(jì)了GGGGS的柔性連接肽(linker)序列。CbXyn10C-SS融合基因全長(zhǎng)為1 077 bp,編碼358個(gè)氨基酸(圖1),SS氨基酸所占融合蛋白氨基酸比例4.0%;理論分子量大小為41.28 kD,等電點(diǎn)為6.73。對(duì)本研究中構(gòu)建得到的重組質(zhì)粒載體pPIC9-CbXyn10C-SS基因測(cè)序表明,CbXyn10C-SS融合基因以正確的閱讀框與酵母表達(dá)載體pPIC9的α因子信號(hào)肽序列的3'端融合,重組質(zhì)粒的構(gòu)建正確(圖2)。
2.2 CbXyn10C和CbXyn10C-SS蛋白的表達(dá)純化

圖1 CbXyn10C-SS的基因和所編碼融合蛋白的氨基酸序列
將構(gòu)建的表達(dá)質(zhì)粒pPIC9-CbXyn10C和pPIC9-CbXyn10C-SS用SacI線性化并切膠回收,分別轉(zhuǎn)化至畢赤酵母GS115感受態(tài)細(xì)胞,使用甲醇進(jìn)行重組蛋白的誘導(dǎo)表達(dá)。在搖瓶中進(jìn)行高酶活轉(zhuǎn)化子的培養(yǎng),BMMY中培養(yǎng)48 h后離心得粗酶液濃度75 mg/L,粗酶液經(jīng)過濃縮、脫鹽等處理后,通過SDSPAGE電泳驗(yàn)證重組蛋白的分子量大小和純度(圖3-A)。可見,CbXyn10C和CbXyn10C-SS在畢赤酵母中得到了成功的重組表達(dá)。CbXyn10C的表觀分子量為40 kD,而CbXyn10C-SS的表觀分子量為42 kD。這與計(jì)算的結(jié)果基本一致。由于分子中含有SS-14分子,因此CbXyn10C-SS比CbXyn10C大~2 kD。
2.3 CbXyn10C-SS木聚糖酶-生長(zhǎng)抑素融合蛋白的抗原性
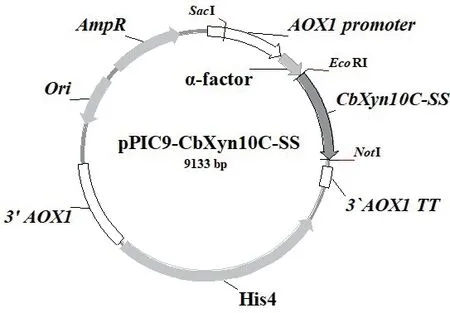
圖2 重組表達(dá)質(zhì)粒pPIC9-CbXyn10C-SS示意圖
在將CbXyn10C-SS進(jìn)行成功的重組表達(dá)后,首先需要驗(yàn)證重組蛋白是否具有抗原性。因此,將CbXyn10C和CbXyn10C-SS首先通過SDS-PAGE電泳,再將其轉(zhuǎn)印到PVDF膜上,使用針對(duì)SS的抗體作為一抗、HRP標(biāo)記的羊抗兔IgG為二抗進(jìn)行免疫印跡操作。如圖3-B,在CbXyn10C-SS的目標(biāo)位置處出現(xiàn)了單一條帶,而對(duì)照CbXyn10所在位置則沒有出現(xiàn)顯色條帶,這證明CbXyn10C-SS蛋白上的生長(zhǎng)抑素仍然保留了良好的抗原性,可用于下一步實(shí)驗(yàn)。
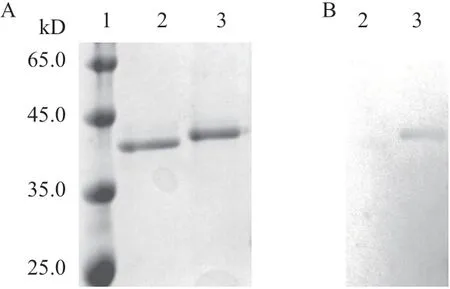
圖3 CbXyn10C-SS的重組表達(dá)和抗原性分析
2.4 CbXyn10C-SS的免疫原性
將CbXyn10C-SS應(yīng)用于畜禽的口服免疫,其首要條件是該融合蛋白需要具備一定的免疫原性。因此,將融合蛋白CbXyn10C-SS首先采用皮下和腹腔注射對(duì)小鼠進(jìn)行了免疫,在三免后的第7天,使用ELISA法檢測(cè)到小鼠的血清中產(chǎn)生了針對(duì)融合蛋白CbXyn10C-SS的抗體,ELISA效價(jià)>1∶5 000,這表明木聚糖酶生長(zhǎng)抑素的融合蛋白CbXyn10C-SS能夠刺激機(jī)體發(fā)生免疫反應(yīng)。隨后使用斑點(diǎn)免疫法對(duì)融合蛋白刺激小鼠所產(chǎn)生的抗體中是否含有針對(duì)生長(zhǎng)抑素的特異抗體進(jìn)行了研究。將倍比稀釋的SS-14點(diǎn)于PVDF膜上,依次采用適當(dāng)稀釋的免疫小鼠血清和HRP標(biāo)記的羊抗鼠IgG作為一抗和二抗進(jìn)行反應(yīng);以未免疫小鼠的血清作為陰性血清對(duì)照。由圖4可以看出:對(duì)于1.0-0.125 μg點(diǎn)膜的樣品,使用CbXyn10C-SS免疫小鼠的血清中存在抗體可特異的與SS發(fā)生結(jié)合,而相同條件下,在陰性血清對(duì)照則未能檢測(cè)到顯色反應(yīng)(效果最佳),這說明CbXyn10C-SS蛋白對(duì)小鼠的皮下多點(diǎn)注射和腹腔免疫能使小鼠產(chǎn)生特異針對(duì)SS的抗體。
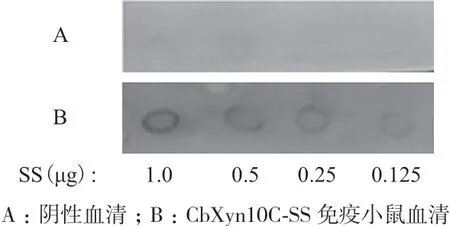
圖4 CbXyn10C-SS免疫小鼠血清針對(duì)生長(zhǎng)抑素的斑點(diǎn)免疫實(shí)驗(yàn)
2.5 木聚糖酶CbXyn10C-SS的生化和酶動(dòng)力學(xué)性質(zhì)
本課題組前期研究發(fā)現(xiàn)木聚糖酶CbXyn10C具有較好的熱穩(wěn)定性和pH穩(wěn)定性;為了評(píng)估融合表達(dá)SS后重組酶性質(zhì),首先測(cè)定了CbXyn10C-SS的生化性質(zhì)。CbXyn10C-SS的最適作用pH為6.0(圖5-AB),在pH 5.0-8.0時(shí)均具有較高酶活;它還具有較好的pH穩(wěn)定性(圖5-A-B),在pH 3.0-12.0均能保持72.2% 以上的剩余酶活。可見,CbXyn10C-SS和未融合SS的CbXyn10C具非常相似的最適pH值和pH穩(wěn)定性,說明C端融合SS沒有對(duì)其最適pH值和pH穩(wěn)定性發(fā)生顯著影響。對(duì)最適溫度的研究表明,CbXyn10C-SS較CbXyn10C的最適溫度為95℃下降了5℃(圖5-C)。CbXyn10C在90℃穩(wěn)定性相對(duì)較好(圖5-D),處理60 min仍能保持50%左右的酶活,而CbXyn10C-SS的熱穩(wěn)定相對(duì)略差,處理60 min僅保持16%左右的相對(duì)酶活。但在80℃(制粒所用溫度)孵育30 min兩個(gè)酶的殘余酶活均沒有顯著下降,只在較長(zhǎng)時(shí)間(60 min)孵育后,CbXyn10C-SS的酶活下降至~80%,而CbXyn10C的酶活仍然無顯著下降。實(shí)驗(yàn)說明C端融合的SS短肽序列對(duì)于蛋白維持高溫下的結(jié)構(gòu)穩(wěn)定性存在一定的負(fù)面影響,但仍然能維持飼料制粒需求(80℃,5 min)。CbXyn10C與CbXyn10C-SS的比活分別為 437.2 U/mg和 349.7 U/mg。利用雙倒數(shù)法作圖計(jì)算,得到CbXyn10C的KM、Vmax和kcat值則分別為0.90 mg/mL、1 000 μmol/min·mg和653.8 s-1,而CbXyn10C-SS的KM、Vmax和kcat值分別0.58 mg/mL、526 μmol/min·mg和362.1 s-1。
和未融合表達(dá)SS的木聚糖酶相比,金屬離子和化學(xué)試劑的存在對(duì)于木聚糖酶CbXyn10C-SS活性的影響和CbXyn10C差別不大,但可見對(duì)絕大多數(shù)的金屬離子和化學(xué)試劑,CbXyn10C-SS的剩余酶活比例均略低于CbXyn10C,說明C端融合了SS對(duì)于CbXyn10C的整體結(jié)構(gòu)有所影響,金屬離子和化學(xué)試劑對(duì)木聚糖酶的酶活有輕微的負(fù)面作用。β-巰基乙醇對(duì)兩個(gè)酶均具有顯著、相似程度的促進(jìn)作用(圖6)。
3 討論
SS的免疫方式主要包括被動(dòng)免疫和主動(dòng)免疫,主動(dòng)免疫是通過導(dǎo)入抗原物質(zhì)來激發(fā)動(dòng)物主動(dòng)對(duì)外源SS抗原產(chǎn)生抗體,作用時(shí)間比較長(zhǎng),因此相對(duì)具有更普遍的應(yīng)用價(jià)值。SS主動(dòng)免疫的方式主要包括注射、口服等形式[6,8,21],均可使機(jī)體產(chǎn)生抗體。注射免疫雖然有使用劑量小的優(yōu)點(diǎn),但可能會(huì)引起動(dòng)物的應(yīng)激反應(yīng),影響動(dòng)物的正常生長(zhǎng),而口服免疫則可與飼料或水混合進(jìn)行免疫,不存在這個(gè)問題,但口服免疫的缺點(diǎn)使用劑量大是其制約性瓶頸,即需要大量SS蛋白。目前,人工合成SS成本過高,不利于生產(chǎn)中廣泛利用,貢長(zhǎng)慧等[22]在大腸桿菌中將SS與LTB融合表達(dá)出現(xiàn)包涵體,需破碎與純化增加成本,雖然Ding等[18]將人血清白蛋白(HSA)和兩拷貝SS-14融合表達(dá),經(jīng)高細(xì)胞密度發(fā)酵72 h,可達(dá)150 mg/L,但融合蛋白中SS所占比例低,且HSA在飼料中作為外源蛋白添加不經(jīng)濟(jì)。
木聚糖酶是一種在飼料中已經(jīng)得到廣泛應(yīng)用的酶蛋白制劑。研究表明,其通過降低動(dòng)物消化道中食糜的黏度、提高干物質(zhì)的消化率和營(yíng)養(yǎng)吸收,從而提高飼料的利用率。木聚糖酶和HSA均為蛋白,都可作為蛋白載體。此前,已有使用木聚糖酶作為載體融合表達(dá)其它基因例如抗菌肽基因的研究,但目前未見融合表達(dá)SS的報(bào)道。因此我們采用了耐熱性較好的熱泉細(xì)菌C. bescii來源的木聚糖酶CbXyn10C作為蛋白載體,將它的基因和SS-14融合構(gòu)建質(zhì)粒載體并轉(zhuǎn)化畢赤酵母進(jìn)行高效表達(dá)。與未融合SS的木聚糖酶CbXyn10C相比,融合蛋白CbXyn10C-SS的最適作用pH均為6.0,pH穩(wěn)定性幾乎沒有下降,在酸性條件下(pH 3.0-6.0)能保持72%以上的剩余酶活,堿性條件下(pH 7.0-12.0)也能保持84%以上的剩余酶活。雖然融合了SS之后,木聚糖酶的最適作用溫度由95℃ 下降到90℃;熱穩(wěn)定性方面,從90℃熱處理60 min剩余50%左右的相對(duì)酶活下降到剩余16%左右的相對(duì)酶活,但80℃處理30 min,兩個(gè)酶的殘余酶活均無顯著下降,說明即使在C端融合了SS-14使得酶的熱穩(wěn)定性略有下降,但仍足以滿足飼料制粒的要求[23-24]。
雖然搖瓶發(fā)酵中CbXyn10C-SS的表達(dá)量不高僅為75 mg/L,但本實(shí)驗(yàn)室已經(jīng)通過發(fā)酵罐高密度發(fā)酵予以解決,得到大量表達(dá)的重組融合蛋白。用于木聚糖酶-SS融合蛋白對(duì)于小鼠動(dòng)物模型實(shí)驗(yàn)以及在家畜、家禽飼喂實(shí)驗(yàn),以探索CbXyn10C-SS使用劑量對(duì)動(dòng)物生長(zhǎng)性能的影響。我們也注意到,當(dāng)木聚糖酶的C端融合了SS短肽之后,木聚糖酶的酶活和熱穩(wěn)定性略有下降,這可能是C端融合的SS短肽通過和木聚糖酶的核心結(jié)構(gòu)部分氨基酸殘基的互作,從而對(duì)其完整性和穩(wěn)定性有一定的負(fù)面影響,這可以在隨后的實(shí)驗(yàn)中通過融合蛋白三維晶體結(jié)構(gòu)的解析和定點(diǎn)突變等加以改進(jìn)。
融合表達(dá)的CbXyn10C-SS既表現(xiàn)出SS的抗原性和免疫原性,又具有木聚糖酶的活性和良好的熱穩(wěn)定性。木聚糖酶可以與SS融合表達(dá)而很好的保持了木聚糖酶的活性,同時(shí)SS的抗原性和免疫原性又沒有損失,那么其它飼料用酶[25],如植酸酶[26]、葡聚糖酶[26]、甘露聚糖酶[27]、淀粉酶[28]、纖維素酶[29]、果膠酶[30]等,是不是也可以與SS融合表達(dá),既保持酶和飼料中底物的反應(yīng)特性,又具有SS的免疫原性;同樣,其它功能性的多肽是不是也可以這樣使用,這些都有待于進(jìn)一步的實(shí)驗(yàn)探索。
4 結(jié)論
本研究在探索飼用酶和功能肽的融合表達(dá)上進(jìn)行了有益的嘗試,成功地將耐熱木聚糖酶CbXyn10C和SS-14進(jìn)行了融合表達(dá),融合蛋白CbXyn10C-SS具有抗原性且能刺激小鼠產(chǎn)生特異抗體,具有免疫原性;融合蛋白的理化、酶學(xué)性質(zhì)和CbXyn10C非常相似,因此理論上同時(shí)具有木聚糖酶和生長(zhǎng)抑素抗原的功能,在養(yǎng)殖業(yè)中具有潛在的應(yīng)用價(jià)值。

