CRISPR/Cas9構建srtA基因敲除的金黃色葡萄球菌
蔣成輝 曾巧英 王萌 潘陽陽 劉旭明 尚天甜
(甘肅農業(yè)大學動物醫(yī)學院,蘭州 730070)
金黃色葡萄球菌(Staphylococcus aureus)是一種重要的病原菌,可引起人和動物化膿感染、肺炎、腸炎、心內膜炎、敗血癥及膿毒癥等[1-2]。近年來由于抗生素的濫用,導致金黃色葡萄球菌耐藥性產生,以耐甲氧西林金黃色葡萄球菌(MRSA)最為常見,由此導致的疾病逐漸增多,治療效果越來越不顯著。因此,迫切需要尋找新的抗金黃色葡萄球菌的藥物靶點和策略來控制病原菌的感染。表面蛋白是革蘭氏陽性菌的一種重要毒力因子,在細胞粘附、生物被膜形成、抵抗吞噬及入侵宿主細胞等方面發(fā)揮著重要的作用[3]。分選酶(srt)廣泛的存在于革蘭氏陽性菌中,它可將攜帶有LPXTG基序分選信號的表面蛋白錨定到細菌細胞壁肽聚糖上。金黃色葡萄球菌分選酶A(srtA)是細菌將表面致病性蛋白錨定到細胞壁上的關鍵酶[4]。研究表明通過抑制金黃色葡萄球菌Newman菌株srtA基因可降低金黃色葡萄球菌對機體的感染能力[5]。因此srtA是一個有潛在應用價值的藥物治療靶標[6]。
CRISPR/Cas9(Clustered regulatory interspaced short palindromic repeats/CRISPR-associated protein 9)是一種編輯效率較高的新型基因組靶向修飾技術。該技術僅通過一段sgRNA來識別靶位點,利用Cas9蛋白進行切割,產生雙鏈DNA斷裂(Double-strand breaks,DSBs),真核生物可通過非同源末端連接(Non-homologous end joining,NHEJ)修復方式和同源重組方式(Homology-directed repair,HDR)進行自我修復從而達到高效的基因編輯效果,目前應用已趨于成熟。原核生物除變形菌門、厚壁菌門、放線菌門等少數菌外,大多數細菌中并沒有非同源重組修復機制,因此,CRISPR/Cas9系統(tǒng)在原核生物中運用并不廣泛[7-10]。但隨著研究者不斷地優(yōu)化,該系統(tǒng)在原核生物中也取得一定的進步。目前,已經在大腸桿菌[11],枯草芽孢桿菌[12]、恥垢分枝桿菌[13]、肺炎雙球菌[14]、乳酸菌[15]、巴斯德梭菌[16]及放線菌[17]等細菌中成功的進行了基因編輯,可實現特定位點的突變、剪切、刪除、插入、替換及多個基因同時編輯等一系列編輯方式[18]。
本研究利用CRISPR/Cas9技術構建了耐甲氧西林金黃色葡萄球菌USA300srtA基因缺失株,為srtA的深入研究和抗金黃色葡萄球菌新藥物研發(fā)提供了理論基礎和數據支撐,為CRISPR/Cas9基因編輯技術在原核生物基因敲除和篩選等方面提供技術參考。
1 材料與方法
1.1 材料
1.1.1 實驗動物、菌株與質粒 實驗動物:昆明小鼠(20±2g)購于中國農業(yè)科學院蘭州獸醫(yī)研究所動物實驗中心。
菌株:金黃色葡萄球菌USA300-TCH1516菌株由甘肅農業(yè)大學微生物與免疫學實驗室保存。大腸桿菌感受態(tài)細胞Top10、大腸桿菌感受態(tài)細胞DH5α購自北京全式金生物有限公司。金黃色葡萄球菌RN4220菌株(金黃色葡萄球菌RN4220菌株為NCTC8325菌株經紫外線和化學等方法誘導產生的限制性內切酶缺陷型菌株,其基因型為mec、rsbU、agr陰性。RN4220菌株能夠接受來源于外部的其他物種的DNA質粒,同時,可以將外源質粒DNA進行修飾,修飾后的質粒可以被野生型金黃色葡萄球菌接受而不被降解)由中國科學技術大學孫寶林老師饋贈。
質粒:pCasSA質粒(金黃色葡萄球菌和大腸桿菌溫度敏感性質粒)由上海科技大學季泉江老師饋贈。pLI50質粒(金黃色葡萄球菌單拷貝整合質粒)購自湖南豐暉生物科技有限公司。
1.1.2 主要試劑和培養(yǎng)基 試劑:細菌基因組DNA提取試劑盒、DL2000 Marker、DL15000 Marker、瓊脂糖、DNA純化回收試劑盒、質粒小提試劑盒購自天根生化科技(北京)有限公司。普通TaqDNA聚合酶、DL5000 Marker、T4DNA連接酶、PrimeSTAR HS(PREMIX)、QuickCutTMEcoR I、QuickCutTMBamH I購自大連寶生物(TaKaRa)公司。BsaI、XhoI和XbaI限制性內切酶購自NEB(北京)有限公司。I型核酸染料、卡那霉素、氨芐霉素、氯霉素購自北京索萊寶科技有限公司。溶葡球菌酶購自上海生工生物工程有限公司。
培養(yǎng)基:LB固體和LB液體培養(yǎng)基用于培養(yǎng)大腸桿菌,TSB液體培養(yǎng)基和TSA固體培養(yǎng)基用于培養(yǎng)金黃色葡萄球菌。
1.2 方法
1.2.1 引物設計 利用NCBI上公布的USA300-TCH1516基因組序列,使用在線軟件CCTop-CRISPR/Cas9 target online predictor在srtA基因的CDS區(qū)設計3對sgRNA分別為:sgRNA1,sgRNA2,sgRNA3。使用軟件primer5.0和DNASTAR分別設計srtA基因左右同源臂擴增引物srtA-L-F和srtA-L-R,srtA-R-F和srtA-R-R;缺失回補基因擴增引物HBsrtA-F和HB-srtA-R;sgRNA檢測引物(位于sgRNA兩側)srtA-sgRNA-F和srtA-sgRNA-R;srtA基因缺失鑒定引物WJD-srtA-F和WJD-srtA-R,NJD-srtA-F和NJD-srtA-R。引物均由蘇州金唯智生物科技有限公司合成(表1)。
1.2.2 金黃色葡萄球菌RN4220和USA300菌株感受態(tài)細菌的制備 參照Zhao等[19]金黃色葡萄球菌感受態(tài)細胞制作方法。分別挑取金黃色葡萄球菌RN4220和USA300菌株單個菌落于5 mL的LB液體培養(yǎng)基中過夜培養(yǎng),然后按照1∶1 000的比例接種到100 mL的LB培養(yǎng)基中,220 r/min搖菌培養(yǎng)至OD600值為0.6為止。無菌條件下將培養(yǎng)的細菌移至冰冷的50 mL滅菌離心管中,冰浴10 min后,4℃,5 000 r/min離心10 min。棄上清,加入50 mL的冰冷的0.5 mol/L的蔗糖溶液冰浴15 min后,4℃,5 000 r/min離心10 min。重復上述步驟,依次用1/2,1/4體積的蔗糖溶液重懸,最后棄去上清,加入5 mL冰冷的0.5 mol/L的蔗糖溶液重懸,分裝于1.5 mL冰冷的無菌離心管中,每管100 μL,-80℃冷凍保存,備用。
1.2.3 pCasSA-sgRNA質粒的構建 使用在線軟件設計3對sgRNA。即選取srtA基因的CDS區(qū)中某一NGG(N為任意堿基)序列前面20個堿基的DNA片段,定義為sgRNA上游序列(sgRNA-F),將這段序列反向互補,定義為sgRNA下游序列(sgRNA-R),并分別在sgRNA上下游序列5'端添加“AAAC”和“GAAA”即為限制性內切酶BsaI酶切位點。對sgRNA上下游序列通過堿基配對原則退火形成雙鏈sgRNA序列,退火體系為:sgRNA上下游序列(100 μmol/L)各2 μL,ddH2O 21 μL。反應程序為:98℃到25℃每30 s降低1℃,4℃放置8 h。
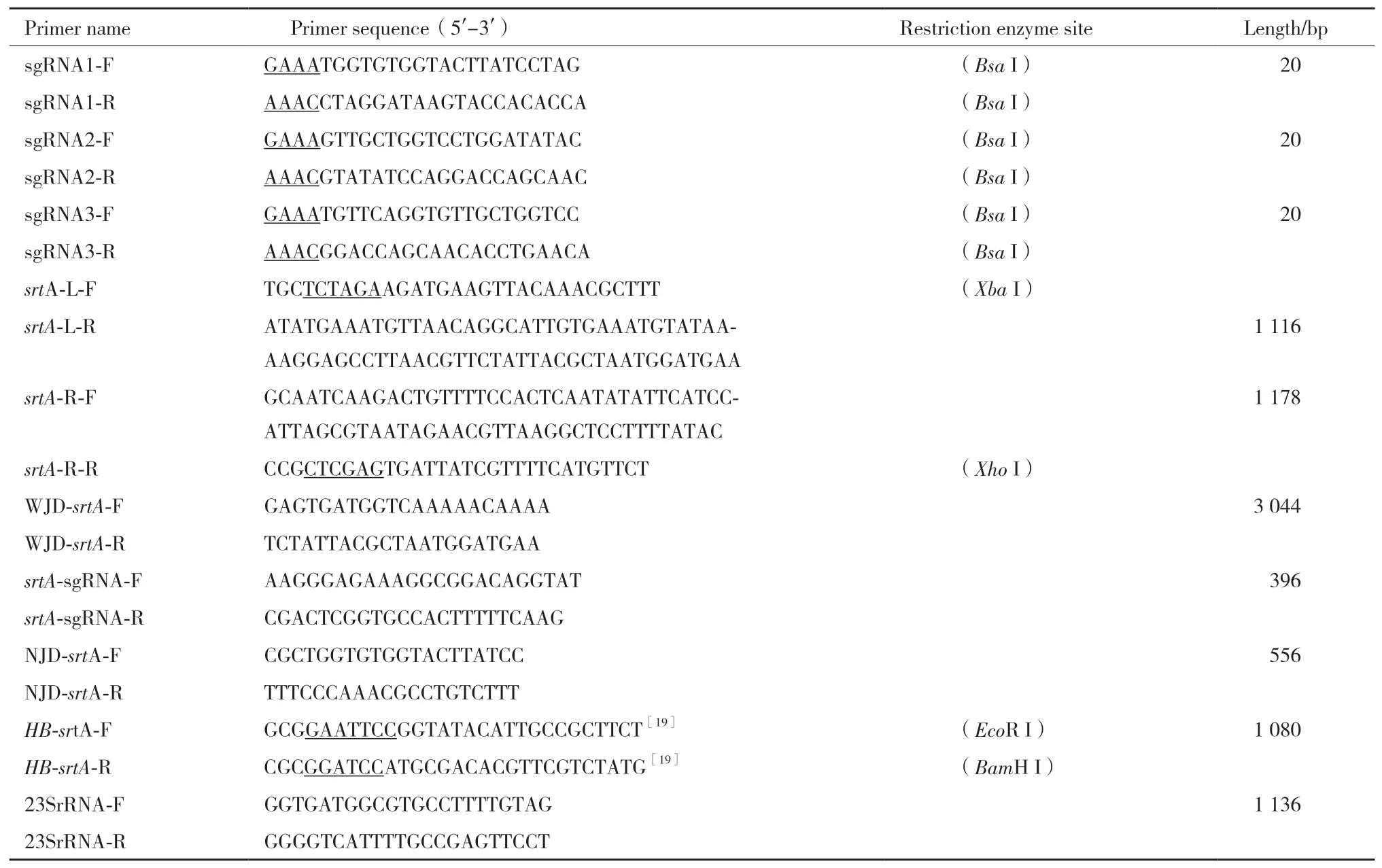
表1 引物序列
質粒pCasSA為金黃色葡萄球菌和大腸桿菌溫度敏感性質粒,用于金黃色葡萄球菌的基因編輯(圖譜見圖1)。該質粒可以利用BsaI位點插入sgRNA片段,靶向目標基因,利用XhoI和XbaI位點插入目標基因左右同源臂序列,進行同源修復,進而達到金黃色葡萄球菌基因敲除的目的。

圖1 pCasSA圖譜[20]
構建pCasSA-sgRNA質粒。使用限制性內切酶BsaI對pCasSA質粒上的BsaI位點進行特異性酶切,酶切體系為:pCasSA 30 μL、BsaI 2 μL、10×NEBuffer 5 μL、ddH2O 13 μL。使用天根生化科技(北京)有限公司DNA純化回收試劑盒進行酶切質粒的純化回收。酶切回收的pCasSA質粒與退火后的雙鏈sgRNA序列經T4DNA連接酶16℃連接3 h。連接體系為:T4DNA Ligase 1 μL、10×T4DNA Ligase buffer 2 μL、退火后的雙鏈sgRNA序列12 μL,酶切回收后的pCasSA質粒1 μL、ddH2O 4 μL。連接產物經熱激轉化至大腸桿菌感受態(tài)細胞Top10中。用50 mg/μL的卡那霉素篩選陽性克隆,30℃增菌后用,用sgRNA上游序列(sgRNA1-F,sgRNA2-F,sgRNA3-F)和sgRNA檢測下游引物srtA-sgRNA-R進行PCR擴增。將獲得的PCR產物用1%的瓊脂糖凝膠電泳檢測,陽性pCasSA-sgRNA質粒(pCasSAsgRNA1,pCasSA-sgRNA2,pCasSA-sgRNA3)送公司測序。測序結果使用MegAlign軟件進行分析比對。
1.2.4 pCasSA-sgRNA質粒切割效率檢測 將pCasSA-sgRNA質粒(pCasSA-sgRNA1,pCasSAsgRNA2,pCasSA-sgRNA3)電擊轉入缺陷型金黃色葡萄球菌RN4220菌株中修飾(電擊條件:21 kV/cm,100 Ω,25 μF),提取質粒(提前使用溶葡球菌酶進行破壁處理)并轉入金黃色葡萄球菌USA300菌株中(電擊條件:21 kV/cm,100 Ω,25 μF),在TSA固體培養(yǎng)基上30℃倒置培養(yǎng)2 d后,觀察平板上菌落的形態(tài)及數量。
1.2.5 pCasSA-sgRNA-srtA缺失質粒的構建 以金黃色葡萄球菌USA300菌株基因組為模板,用引物srtA-L-F和srtA-L-R,srtA-R-F和srtA-R-R分 別 擴 增srtA基因左右同源臂srtA-L和srtA-R序列,反應體系為:PrimeSTAR HS 25 μL,上下游引物各2 μL,DNA模板1 μL,ddH2O 20 μL。反應程序為:98℃ 10 s,55℃ 5 s,72℃ 1 min,35個循環(huán)。使用融合PCR,將純化回收后的srtA-L和srtA-R兩段序列融合,融合體系為:PrimeSTAR HS 25 μL,srtA-L、srtA-R序列各2 μL,ddH2O 21 μL。反應程序為:98℃ 10 s,55℃ 5 s,72℃ 1 min,35個循環(huán),獲得srtA-L+R序列。融合后的srtA-L+R序列濃度較低,需要將srtAL+R序列進行再擴增。擴增體系為:PrimeSTAR HS 12.5 μL,srtA-L-F、srtA-R-R引物各1 μL,融合后的srtA-L+R序列25 μL,ddH2O 10.5 μL。反應程序為:98℃ 10 s,55℃ 15 s,72℃ 2.2 min,35個循環(huán)。使用限制性內切酶XhoI和XbaI將純化后srtA-L+R序列和有切割效率的pCasSA-sgRNA質粒進行雙酶切。純化回收,T4DNA連接酶過夜連接,連接體系為:T4DNA Ligase 1 μL、10×T4 DNA Ligase buffer 2 μL、srtA-L+R 9 μL,酶切后的pCasSA-sgRNA質粒1 μL、ddH2O 7 μL。連接產物通過熱激轉化至大腸桿菌Top10中,用50 mg/μL卡那霉素篩選陽性克隆,30℃增菌后,用引物srtA-L-F和srtA-R-R進行PCR檢測并測序,正確的質粒命名為pCasSA-sgRNA-srtA。
1.2.6 金黃色葡萄球菌USA300srtA基因缺失株的構建及其鑒定 將pCasSA-sgRNA-srtA質粒電擊轉入金黃色葡萄球菌RN4220菌株經修飾后,轉入金黃色葡萄球菌USA300菌株中,用15 mg/μL氯霉素TSA固體培養(yǎng)基篩選陽性克隆。隨機挑取10個陽性菌落,編號為:1-10號。30℃增菌后,提取基因組,用 引 物WJD-srtA-F,WJD-srtA-R,進 行PCR初 步篩選,擴增體系為:PrimeSTAR HS 12.5 μL,WJDsrtA-F、WJD-srtA-R引物各1 μL,模板1 μL,ddH2O 9.5 μL。反應程序為:98℃ 10 s,55℃ 15 s,72℃ 3 min,30個循環(huán)。對于疑似敲除的菌株,經測序檢測結果。同時,使用引物NJD-srtA-F,NJD-srtA-R檢測srtA基因是否存在。擴增體系為:PrimeSTAR HS 12.5 μL,NJD-srtA-F,NJD-srtA-R引物各1 μL,模板1 μL,ddH2O 9.5 μL。反應程序為:98℃ 10 s,55℃5 s,72℃ 30 s,30個循環(huán)。
1.2.7 重組質粒消除 為消除重組質粒對金黃色葡萄球菌USA300的影響,需要消除質粒pCasSAsgRNA-srtA。具體方法參照Chen等[20]質粒消除方法。選擇一個金黃色葡萄球菌srtA基因缺失(ΔsrtAUSA300)菌落。30℃過夜培養(yǎng),然后按照1∶1 000的比例接種到5 mL的不含有抗生素TSB液體培養(yǎng)基中,42℃,220 r/min培養(yǎng),直到培養(yǎng)菌液出現混濁。取適量菌液劃線于TSB固體平板上,在37℃過夜培養(yǎng)。從平板上隨機挑取幾個菌落,接種于新鮮液體培養(yǎng)基中,直到培養(yǎng)菌液出現混濁,取適量分別涂布于含有5 mg/μL氯霉素或不含氯霉素的TSA固體培養(yǎng)基平板上。如果菌落在不含抗生素的培養(yǎng)基平板上生長,而在含有抗生素的培養(yǎng)基平板上不生長,證實重組質粒消除。
1.2.8 金黃色葡萄球菌USA300srtA基因缺失對細菌生長的影響 將菌株接種于TSB液體培養(yǎng)基中,37℃搖床220 r/min培養(yǎng)24 h后,按1∶1 000的比例轉接到新鮮的TSB液體培養(yǎng)基中,37℃搖床220 r/min培養(yǎng),每隔0.5 h測一次OD600,測定10次,最后根據OD600值繪制出細菌的生長曲線。
1.2.9 金黃色葡萄球菌USA300srtA基因缺失對小鼠生存率的影響 挑取金黃色葡萄球菌單個菌落于新鮮的TSB液體培養(yǎng)基中,37℃,200 r/min過夜培養(yǎng)。然后按照1∶1 000的比例轉接到100 mL的TSB培養(yǎng)基中,37℃,220 r/min培養(yǎng)至OD600值為2.0。使用PBS溶液稀釋洗滌3次,調整各菌株菌量至同一水平,并稀釋至2×108CFU/mL的細菌濃度。將小鼠隨機分為3組,分別為正常對照組(生理鹽水)、野生型菌株組(WT USA300)和基因缺失菌株組(ΔsrtAUSA300),每組15只小鼠。除正常對照組小鼠尾靜脈注射生理鹽水,其余組別小鼠分別注射相應的2×108CFU/mL濃度的菌液,接種劑量為:每20 g小鼠接種0.2 mL。分別于0-14 d每天觀察小鼠死亡情況,并繪制小鼠生存率曲線。
1.2.10 金黃色葡萄球菌USA300srtA基因缺失對器官組織內細菌數量的影響 使用1×108CFU/mL濃度的菌液尾靜脈注射小鼠,接種劑量為:每20 g小鼠接種0.1 mL。選用感染1 d、3 d、5 d后的小鼠眼球采血,頸椎脫臼處死小鼠,取心臟、腎臟、肝臟和脾臟,進行臟器菌落計數。具體方法如下:無菌條件下,取出小鼠心臟、腎臟、肝臟和脾臟稱其重量;向組織樣本中加入1 mL PBS溶液后,置于高通量組織研磨儀中充分研磨成勻漿液;將勻漿液10倍梯度稀釋后,取200 μL樣品稀釋液涂布于TSB培養(yǎng)平板上,37℃倒置培養(yǎng)24 h。菌落數在30-300之間視為計數有效。計算器官組織內的載菌量(logCFU/g),公式為:CFU/g=[3個平板的CFU的平均數×5×勻漿液體積(mL)×稀釋倍數]/組織重量(g)。
為了鑒定感染小鼠器官組織中的細菌為金黃色葡萄球菌,需要對平板菌落進行鑒定。具體方法如下:挑取單個菌落,增菌后,進行革蘭氏染色,同時提取基因組,使用引物23S rRNA-F/R進行PCR鑒定。PCR產物寄送公司測序,測序結果提交GenBank數據庫,進行BLAST比對分析。
1.2.11 金黃色葡萄球菌USA300srtA基因缺失對小鼠腎臟組織病理變化的影響 選用步驟1.13中感染1 d后的小鼠,眼球采血,頸椎脫臼處死小鼠,取腎臟用10%的中性甲醛溶液固定7 d,參考陳福廣[5]方法進行石蠟切片制作與HE染色,光學顯微鏡觀察小鼠腎臟病理變化。
1.2.12 金黃色葡萄球菌USA300菌株srtA基因缺失回補株的構建 以金黃色葡萄球菌USA300菌株基因組為模板,HB-srtA-F,HB-srtA-R為引物擴增srtA基因及其啟動子片段(HB-srtA基因),反應體系為:PrimeSTAR HS 25 μL,HB-srtA-F、HB-srtA-R各2 μL,DNA模板2 μL,ddH2O 19 μL。反應程序為:98℃ 10 s,55℃ 5 s,72℃ 1 min,35個循環(huán)。待純化回收后,用限制性內切酶EcoRI 和BamH I將pLI50質粒和HB-srtA進行雙酶切,酶切體系為:QuickCutTMEcoR I 2 μL,QuickCutTMBamH I 2 μL,QuickCut Green Buffer 5 μL,PLI50/回補基因srtA1 μg ddH2O補充至50 μL。30 min后純化回收,用T4連接酶過夜連接,熱激轉化至DH5α菌株,37℃增菌后提取質粒,用雙酶切和測序分別檢測回補質粒PLI50-srtA是否構建成功,將構建成功的回補質粒經修飾后轉入ΔsrtAUSA300中,構 建ΔsrtAUSA300回 補 株(Δ∷srtAUSA300)。回補株構建成功后,需進一步進行功能驗證,檢測srtA基因缺失后其功能是否恢復。即觀察srtA基因回補后,菌株生長狀況,感染后小鼠生存率、器官組織載菌量及腎臟病理組織學變化。
1.2.13 統(tǒng)計學分析 應用GrphPad Prism7.0數據處理軟件對數據進行統(tǒng)計學分析,結果以Mean±SD表示。應用SPSS17.0分析數據統(tǒng)計學差異。P<0.05視為差異性顯著,P<0.01視為差異性極顯著。
2 結果
2.1 pCasSA-sgRNA質粒的構建及鑒定
將退火后的雙鏈sgRNA序列與酶切后的pCasSA質粒連接后,用sgRNA上游序列(sgRNA1-F,sgRNA2-F,sgRNA3-F)和sgRNA檢 測 引 物srtAsgRNA-R進行PCR鑒定,檢測結果如圖2-A所示。將驗證的pCasSA-sgRNA質粒送公司測序,如圖2-B所示,測序結果正確。證明pCasSA-sgRNA質粒構建成功。
2.2 pCasSA-sgRNA質粒切割效率檢測
將修飾后的pCasSA-sgRNA質粒電擊轉入金黃色葡萄球菌USA300菌株中,30℃培養(yǎng)2 d后觀察。與對照組pCasSA質粒菌落(圖3-A)相比,存在pCasSA-sgRNA2質粒的菌落在TSA固體平板上僅有幾個生長(圖3-D),存在pCasSA-sgRNA1,pCasSAsgRNA3質粒的菌落幾乎長滿整個平板(圖3-B,3-C)。這說明pCasSA-sgRNA2具有較高的切割效率。選用pCasSA-sgRNA2質粒進行下一步實驗。
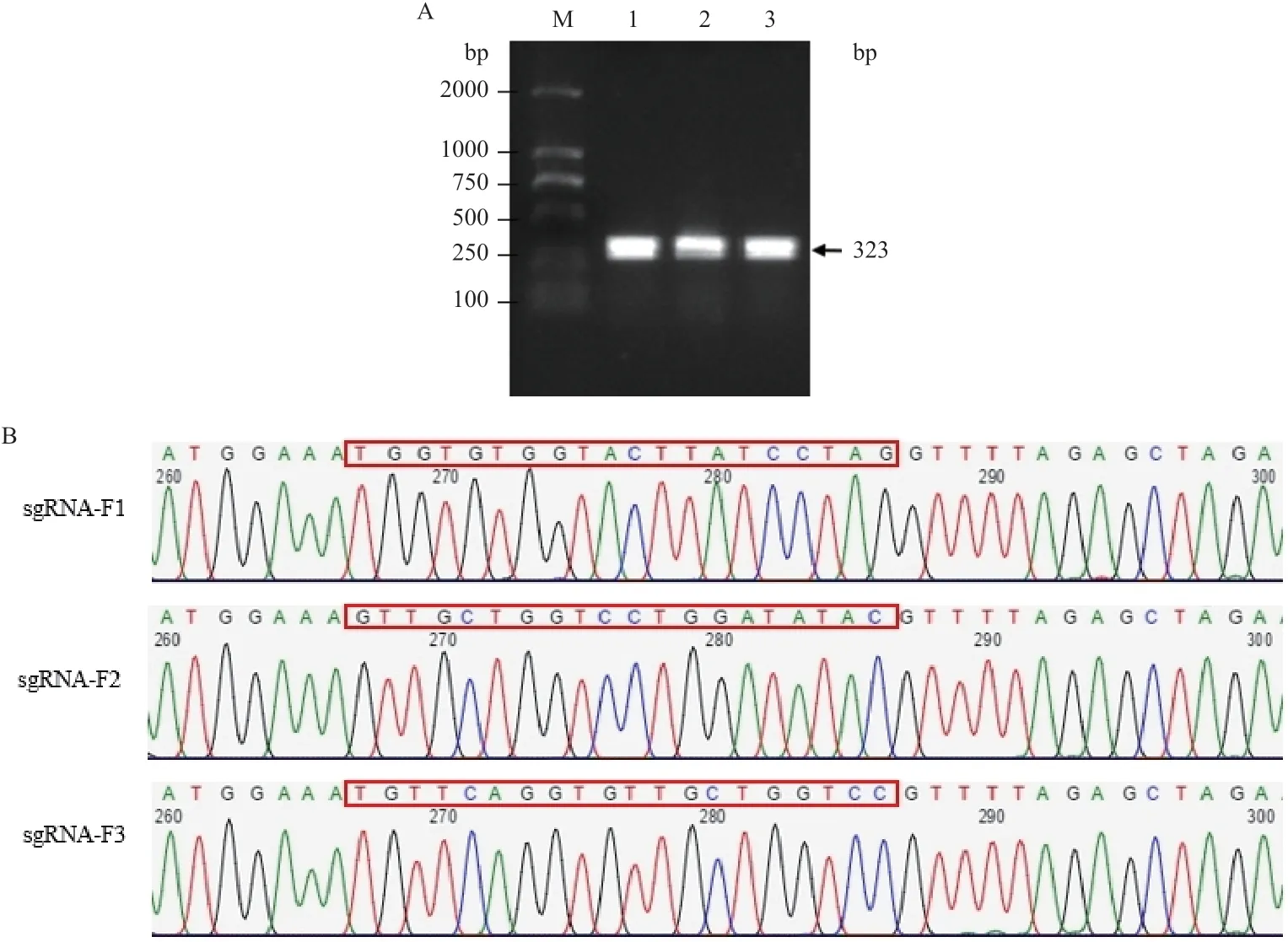
圖2 pCasSA-sgRNA質粒的構建及鑒定
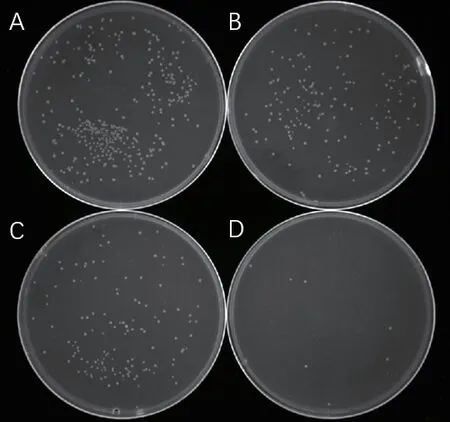
圖3 pCasSA-sgRNA質粒切割效率檢測
2.3 pCasSA-srtA-sgRNA質粒的構建及鑒定
以金黃色葡萄球菌USA300菌株基因組為模板,分別擴增獲得大小為1 116 bp和1 178 bp的srtA基因左右同源臂srtA-L和srtA-R序列,用融合PCR將srtA-L和srtA-R序列融合后獲得2 294 bp的srtA-L+R序列,瓊脂糖凝膠電泳結果顯示與預期結果一致。(圖4-A)。將srtA-L+R序列構建到pCasSA-sgRNA2質粒中,經限制性內切酶XhoI和XbaI雙酶切驗證,如圖4-B所 示,獲 得10 260 bp和2 294 bp的2條 特異性條帶,均與預期大小一致。對重組好的質粒送測序鑒定,結果與原序列一致。證明pCasSA-srtAsgRNA2質粒構建成功。
2.4 金黃色葡萄球USA300 srtA缺失株的構建及鑒定
將修飾后的pCasSA-srtA-sgRNA2質粒轉入USA300菌株中,30℃培養(yǎng)2 d,TSA平板長出菌落后,隨機挑取10個單個菌落,30℃增菌后,提取基因組,用引物WJD-srtA-F,WJD-srtA-R進行PCR擴增,鑒定srtA基因敲除情況,如圖5-A所示,srtA基因沒有被敲除修復的菌,PCR顯示為3 044 bp,反之出現2 424 bp大小的條帶。為了進一步檢測srtA基因是否被敲除,用引物NJD-srtA-F,NJD-srtA-R進行PCR擴增,如圖5-B所示,srtA基因沒有被敲除的菌,PCR將會擴增出556 bp大小的條帶,反之不能擴增出條帶。如圖5-C所示,測序結果與PCR驗證結果一致。證明ΔsrtAUSA300構建成功。
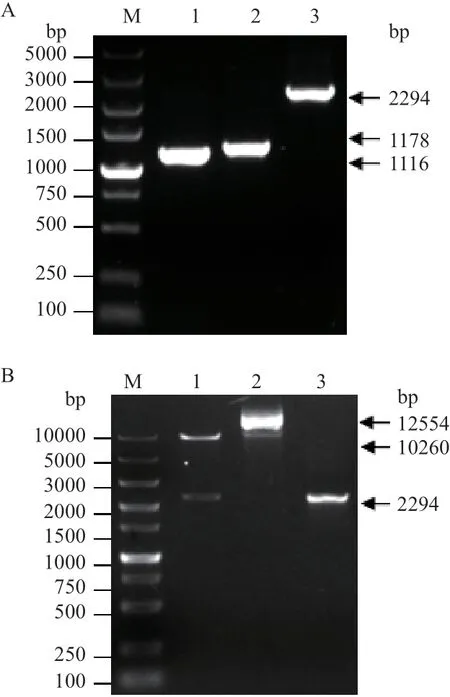
圖4 pCasSA-srtA-sgRNA質粒構建及鑒定
2.5 重組質粒消除
pCasSA-srtA-sgRNA2質粒經30℃,42℃,37℃培養(yǎng)后。由于pCasSA質粒中含有溫度敏感的repF復制子,使得該質粒在42℃下無法復制,從而在細菌中消除。如圖6所示,在含有氯霉素的TSA平板上無菌落生長(圖6-A),在不含有氯霉素的TSA平板長出菌落(圖6-B),證明重組質粒pCasSA-srtAsgRNA2被消除,可進行下一步實驗。
2.6 金黃色葡萄球菌USA300菌株srtA基因缺失回補株的構建
回補基因HB-srtA經PCR擴增后獲得大小為1 080 bp的條帶(圖7-A),與質粒pLI50(5 505 bp)連接后獲得pLI50-srtA質粒,經限制性內切酶EcoRI和BamH I雙酶切驗證獲得5 505 bp和1 080 bp大小的2條特異性條帶(圖7-B)。pLI50-srtA質粒經測序結果正確,證明pLI50-srtA質粒構建成功。將修飾后的pLI50-srtA回補質粒導入ΔsrtAUSA300中,成功構建了Δ∷srtAUSA300。
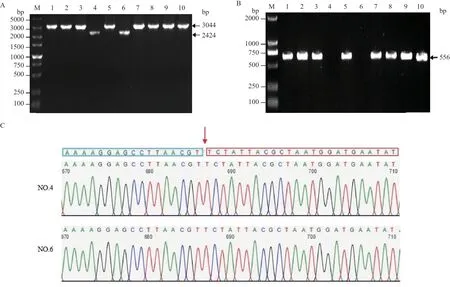
圖5 ΔsrtA USA300菌株的篩選及鑒定

圖6 質粒消除鑒定
2.7 金黃色葡萄球菌USA300 srtA基因缺失對細菌生長的影響
如圖8所示,srtA基因缺失后,前2 h細菌生長緩慢,2 h后進入生長對數期初期。與WT USA300相比,ΔsrtAUSA300生長狀態(tài)相似。srtA基因回補后,Δ∷srtAUSA300生長與WT USA300生長狀態(tài)基本一致,證明srtA基因缺失并不會影響金黃色葡萄球菌的生長。說明該突變是一種非致死性突變。
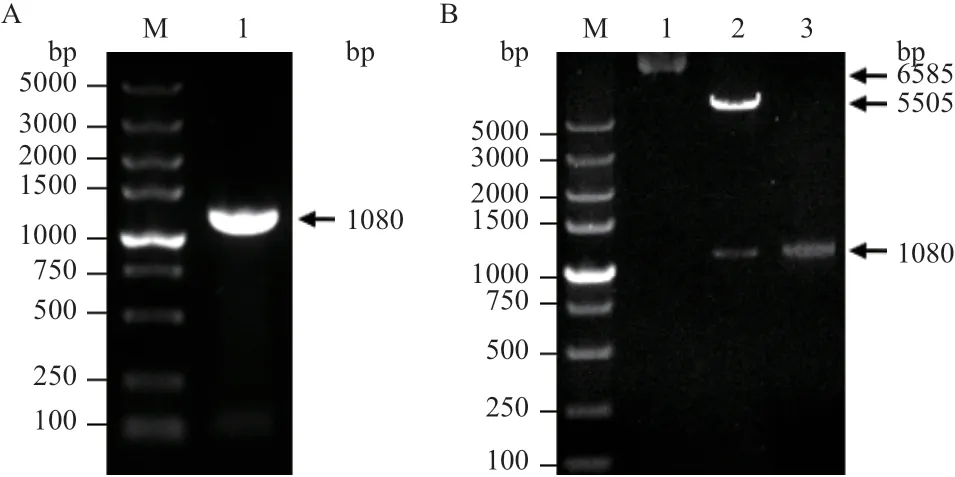
圖7 HB-srtA基因PCR擴增及pLI50-srtA質粒鑒定
2.8 金黃色葡萄球菌USA300 srtA基因缺失對小鼠生存率的影響
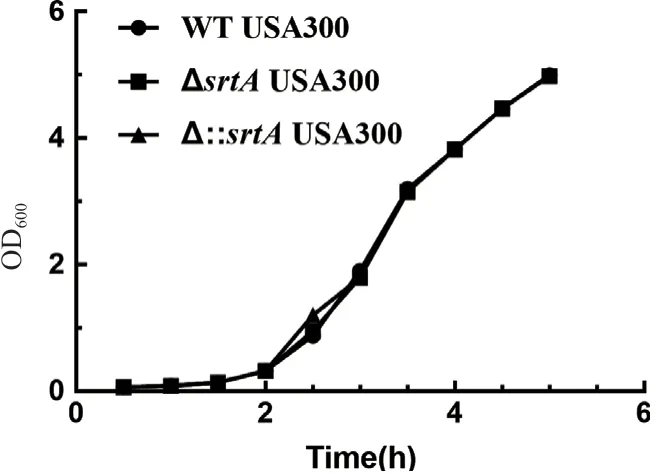
圖8 WT USA300,ΔsrtA USA300和Δ∷srtA USA300生長曲線
小鼠經尾靜脈接種2×108CFU/mL的金黃色葡萄球菌后,對小鼠的生存率進行分析,結果如圖9所示。WT USA300顯著的引起了小鼠的死亡。srtA缺失后小鼠無死亡。srtA基因回補后,感染小鼠與WT USA300組的小鼠死亡情況基本一致,證明srtA基因回補后其功能基本恢復。
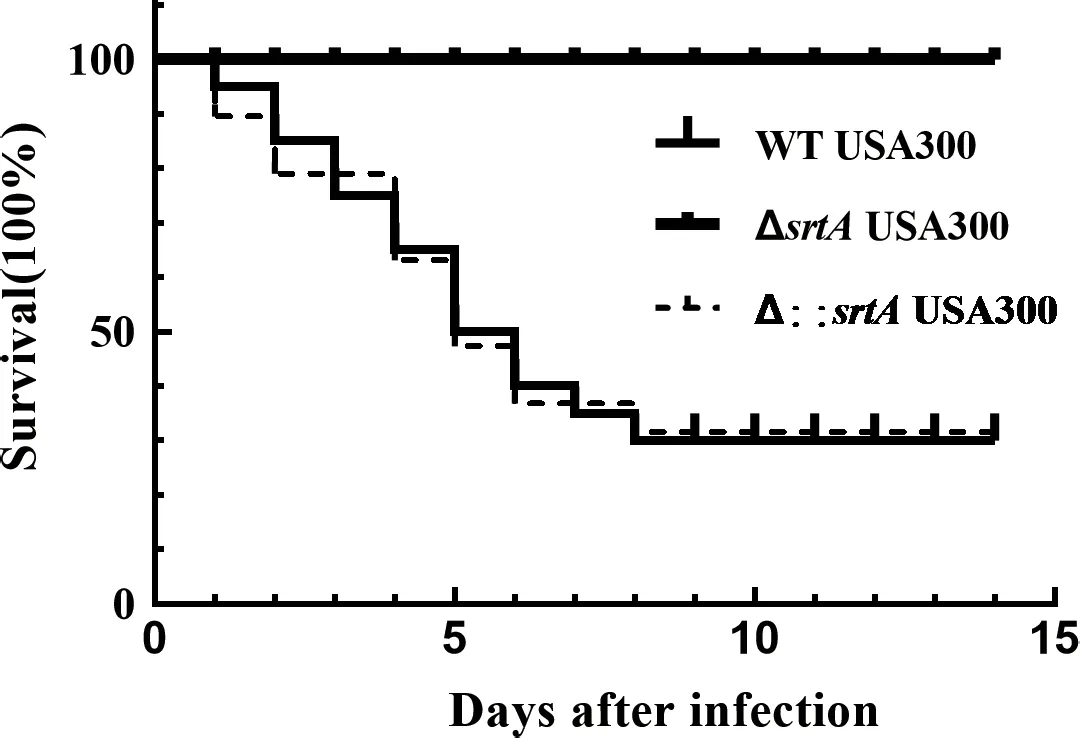
圖9 srtA基因缺失對小鼠生存率的影響
2.9 金黃色葡萄球菌USA300 srtA基因缺失對器官組織內細菌數量的影響
分別對感染1 d、3 d、5 d后的小鼠器官組織進行平板計數,統(tǒng)計心臟、腎臟、肝臟和脾臟中的細菌數量。如圖10所示,與WT USA300組相比,ΔsrtAUSA300組在小鼠心臟中的細菌數量(圖10-A)顯著減少(P<0.05),在小鼠腎臟中的細菌數量(圖10-B)極 顯 著 減 少(P<0.01),但WT USA300組與ΔsrtAUSA300組小鼠在肝臟和脾臟內細菌數量(圖10-C,10-D)無顯著性差異。srtA基因回補后,Δ∷srtAUSA300組小鼠載菌量基本恢復至野生型水平。如圖11所示,平板菌落經革蘭氏染色,油鏡下觀察呈單個、短鏈、葡萄狀的藍紫色菌落(圖11-A)。經過PCR擴增,核酸瓊脂糖凝膠電泳獲得大小為1 136 bp的條帶(圖11-B),公司測序,最終鑒定感染小鼠組織中的細菌為金黃色葡萄球菌。
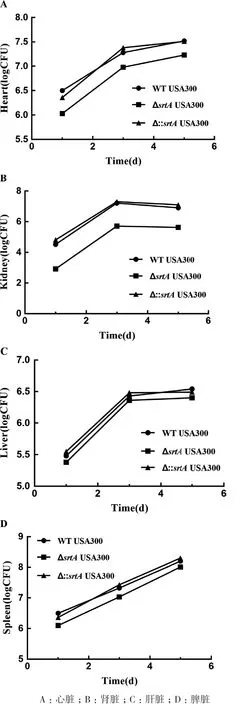
圖10 srtA基因缺失對小鼠器官內細菌數量的影響
2.10 金黃色葡萄球菌USA300 srtA基因缺失對小鼠腎臟病理變化的影響
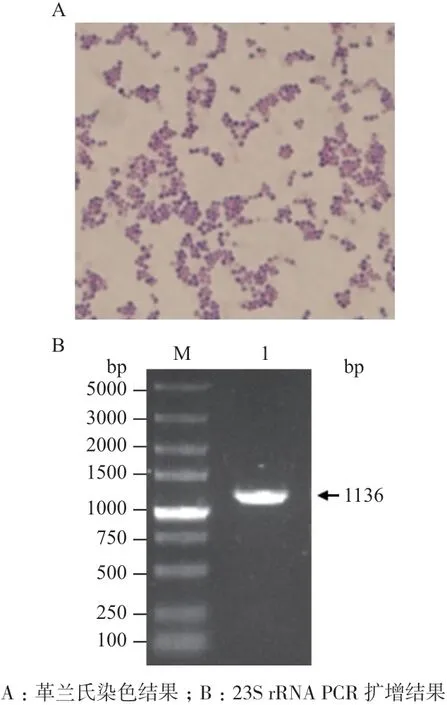
圖11 細菌的分離與鑒定
光學顯微鏡下觀察腎臟病理變化,結果如圖12所示,正常對照組(圖12-A),細胞排列規(guī)則,腎小管和腎小球結構完整。WT USA300組(圖12-C)腎小球變性、嚴重壞死,腎小管上皮細胞腫脹,管腔變小或消失。腎間質充血、水腫,并可見較大面積的彌漫性出血。ΔsrtAUSA300組(圖12-B)腎小球體積增大,腎小球毛細血管內皮細胞增生、腫大,腎小球囊腔狹窄,并可見局灶性出血,整體病變明顯減輕。srtA基因回補后,菌株對小鼠腎臟損傷程度基本恢復至與WT USA300組同等水平(圖12-D)。
3 討論
隨著耐甲氧西林、耐萬古霉素等金黃色葡萄球菌的出現和抗生素不良反應的增加,使得防治金黃色葡萄球菌感染的難度加大。因此尋求新型藥物靶標和開發(fā)治療金黃色葡萄球菌感染的新藥物,已成為眾人近年來關注的焦點問題之一。新型藥物靶標的發(fā)現離不開基因組層面功能基因的篩選以及后續(xù)基因功能的驗證。金黃色葡萄球菌中用于功能基因篩選的技術主要為轉座子插入突變的方法。這種方法篩選過程十分繁瑣,費時費力,并且轉座子插入位置的隨機性,使得該技術不能應用于特定的基因群[21]。后續(xù)基因功能的驗證也離不開該基因缺失株的構建。以往金黃色葡萄球菌用于構建基因缺失株的方法主要為基于同源重組的方法。以pBT2、pMAD、pKOR1和pIMAY質粒最為常見。但大多操作繁瑣,需要正向或者反向的篩選,效率較低。張曉靜[22]使用pBT2穿梭質粒構建OatA基因敲除株,挑取1 440個單克隆,僅獲得3個陽性克隆,效率不足1%。限制了高效基因功能的研究。CRISPR/Cas9系統(tǒng)作為一種新型基因編輯技術,可以精確、高效的對基因組進行敲除或者修飾,可在短時間內獲得基因敲除突變體,從而更好地完成基因功能的研究[23]。
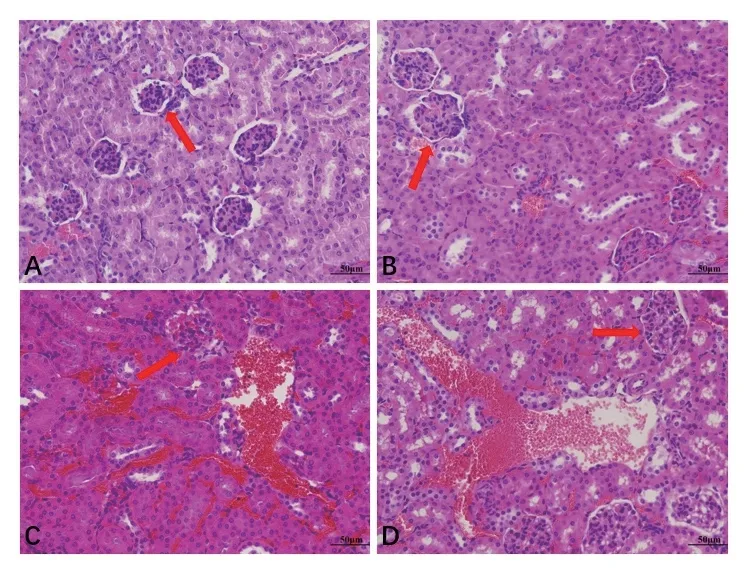
圖12 srtA基因缺失對小鼠腎臟病理學變化的影響
基于CRISPR/Cas9系統(tǒng),本研究以pCasSA為載體,人工引入srtA基因左右同源臂,構建了耐甲氧西林金黃色葡萄球菌USA300srtA基因缺失株。具有效率高,操作簡單的特點。挑取的10個菌株中,獲得2個基因缺失株。CRISPR/Cas9系統(tǒng)中,sgRNA可以靶向目標基因,Cas9蛋白可以對基因組進行特異性切割,獲得DSBs,由于非同源重組末端修復的缺乏,導致細菌死亡。但金黃色葡萄球菌存在逃逸機制,僅有極少數菌不被切割存活了下來[24]。因此本研究根據平板上菌落的多少,篩選獲得可能有切割效率的sgRNA。在篩選srtA基因缺失株時,往往敲除質粒中同源臂的存在可能會影響檢測結果,因此本研究設計srtA基因外部和內部鑒定引物,外部鑒定引物WJD-srtA-F,WJD-srtA-R位于同源臂兩端,能消除質粒對檢測結果的影響。內部鑒定引物NJDsrtA-F,NJD-srtA-R位于srtA基因內部,保證了檢測的準確性。這樣可以直觀的通過觀察瓊脂糖凝膠電泳條帶大小達到初步篩選的效果。為避免pCasSAsrtA-sgRNA質粒存在對金黃色葡萄球菌的影響,本研究利用pCasSA質粒在42℃不能復制的原理,進行質粒的消除。最終獲得不含有質粒的srtA基因缺失株。經生長曲線測定顯示srtA基因缺失不會影響金黃色葡萄球菌USA300菌株的生長。因此,抑制srtA的活性不會對病原菌帶來生存壓力,可以有效的減少細菌耐藥性的發(fā)生,有利于金黃色葡萄球菌藥物抑制劑篩選,以彌補目前針對耐藥性菌株感染的抗生素治療不足[25]。
金黃色葡球菌USA300菌株屬于MRSA,具有很強的毒力和致病性。據報道,MRSA菌血癥的死亡率可高達80%[26]。MRSA主要以皮膚軟組織和呼吸道感染為主,屬于多位點序列ST8型,通常包含SCCmecIVa型元件、arcA基因、編碼殺白細胞素(PVL)基因的噬菌體ФSA2USA,精氨酸分解代謝移動遺傳元件(Arginine catabolic mobile Bsaed element,ACME)和SpeG基因[27]。這些基因被認為是USA300菌株得以生存和發(fā)揮毒力作用的重要因素。srtA作為金黃色葡萄球菌最重要的轉肽酶,負責將20多種表面毒力因子蛋白錨定到細菌的細胞壁上,抑制后細菌感染小鼠的毒力顯著降低。USA300菌株強的致病性與毒力是否與srtA基因相關,有待進一步研究。因此,本研究構建了耐甲氧西林金黃色葡萄球菌USA300srtA基因缺失株,尾靜脈接種金黃色葡萄球菌,建立了小鼠菌血癥模型,探究USA300菌株srtA基因缺失對小鼠致病能力的影響。結果顯示,與WT USA300相比,ΔsrtAUSA300顯著降低了小鼠的死亡率。在小鼠接種1×108CFU/mL濃度的金黃色葡萄球菌1 d、3 d、5 d后,與WT USA300組小鼠相比,感染ΔsrtAUSA300小鼠心臟中的細菌數量顯著性減少,腎臟中的細菌數量極顯著性減少,而肝臟和脾臟中的細菌量未見明顯降低,這與張奇文等[28]構建單增李斯特菌srtA基因缺失株后肝臟和脾臟中載菌量顯著降低有所不同,這可能與不同種屬細菌與機體的相互作用機制不同有關。光學顯微鏡下觀察感染1 d后的小鼠腎臟組織病理變化,發(fā)現與WT USA300組小鼠相比,ΔsrtAUSA300組小鼠腎臟組織病變明顯減輕,表明srtA基因的缺失降低了細菌對腎臟的損傷,這可能與srtA基因的缺失后減少了某些炎性因子的含量或參與調節(jié)炎癥的某種信號通路有關。此外,MRSA對多種抗生素產生耐藥,有研究表明生物膜形成與耐藥性產生有關[29],而srtA錨定的多種表面蛋白參與細菌生物膜的黏附機制,是否srtA基因的缺失與細菌的耐藥性有直接或者間接的關系,需要進一步探究。
本研究結果表明,srtA基因缺失并沒有使USA300菌株完全喪失對小鼠的致病性,可見srtA分選的表面蛋白只部分參與了細菌的致病力。盡管srtA參與了眾多C端含有分選信號的表面毒力蛋白錨定到細胞表面的過程,可能致病菌本身還存在其他作用機制或其他毒力因子作用,或存在類似蛋白分擔srtA的作用,srtA基因缺失后激活了相似蛋白發(fā)揮補償作用。這方面的研究需要進一步去探索。
4 結論
本研究成功構建了耐甲氧西林金黃色葡萄球菌USA300菌株srtA基因缺失株和回補株,為深入研究耐甲氧西林金黃色葡萄球菌srtA基因提供實驗菌株,為進一步闡明金黃色葡萄球菌毒力因子的致病機制提供理論依據。

