香菇草酰乙酸水解酶基因LeOAH1克隆及表達分析
段應(yīng)策 胡姿儀 楊帆 李金濤 鄔向麗 張瑞穎
(中國農(nóng)業(yè)科學(xué)院農(nóng)業(yè)資源與農(nóng)業(yè)區(qū)劃研究所 北京100081)
草酰乙酸水解酶是產(chǎn)生草酸的關(guān)鍵性酶[1]。在草酸合成的最后一步中,該酶能夠?qū)⒉蒗R宜崴猓苯有纬刹菟幔?],是真菌中特有的酶。在真菌的草酸代謝研究中,草酰乙酸水解酶也是研究的必要性酶。在核盤菌中,將草酰乙酸水解酶的基因敲除,草酸不再分泌,可以降低核盤菌對植物的侵害能力[3]。在黑曲霉中將該酶的基因敲除,可以避免草酸的產(chǎn)生,從而提高了生產(chǎn)中檸檬酸的純度[4]。而相反,在黑曲霉中將草酰乙酸水解酶的基因過量表達,可以形成產(chǎn)草酸的獨特菌株[5]。
真菌中草酸的形成主要是在細胞質(zhì)中,利用細胞中的載體蛋白將草酸轉(zhuǎn)運至胞外,繼而在細胞外發(fā)揮作用[6]。而細胞質(zhì)中草酰乙酸的來源可分為3類,一類是來自于細胞質(zhì)中丙酮酸形成的草酰乙酸[7];一類是蘋果酸在蘋果酸脫氫酶形成的草酰乙酸[8];還有一類是線粒體中形成的檸檬酸經(jīng)過穿梭,在檸檬酸裂解酶的作用下,形成的草酰乙酸[9]。而在真菌中,對于草酸的形成途徑也有所不同,大致可分為兩類:一類以黑曲霉中草酰乙酸水解酶單獨作用形成的草酸[10];還有一類是以褐腐菌中草酰乙酸水解酶和乙醛酸脫氫酶或者是乙醛酸氧化酶一起作用形成的草酸[8,11]。總的來說,草酰乙酸水解酶在真菌的草酸合成中起關(guān)鍵性作用。
香菇屬于大型真菌,在中國食用菌中產(chǎn)量長期位居第一。屬于偏酸性食用菌,木腐菌中屬于白腐菌[6],在生長過程中,會產(chǎn)生一定量的草酸對環(huán)境pH進行調(diào)節(jié)[12]。而草酸在真菌生長過程中有很多作用,因此研究草酰乙酸水解酶對于了解香菇生長及育種有很大的幫助。在病原菌中對草酰乙酸水解酶的報道很多,而在食用菌中的報道中卻沒有。
本研究中克隆了香菇LeOAH1基因,分析其結(jié)構(gòu)、序列特征、系統(tǒng)進化關(guān)系等基本生物學(xué)信息,并利用Real-time PCR方法檢測LeOAH1基因在不同pH條件下的表達情況,并在體外進行了原核表達,初步探討了該酶LeOAH1在香菇菌絲生長中的作用,旨在為進一步研究該基因的生物學(xué)功能奠定基礎(chǔ)。
1 材料與方法
1.1 材料
1.1.1 供試菌種 香菇(L. edodes)菌株為L808,25℃活化培養(yǎng)。大腸桿菌為Trans1-T1和BL21(DE3);質(zhì)粒為pET-28a。
1.1.2 主要試劑與設(shè)備 DifcoTM標準PDA培養(yǎng)基(美國Becton公司)、LB Broth Powder(生工生物工程(上海)股份有限公司)、DNA提取試劑盒(DP305)(天根生物科技(北京)有限公司)、E.Z.N.A. Plant RNA Kit(美國Omega 公司)、HiScript II 1st Strand cDNA Synthesis Kit和ChamQ Universal SYBR qPCR Master Mix(南京諾唯贊公司)、PremixTaqTM(日本TaKaRa公 司)、96孔 反 應(yīng) 板 和QuantStudioTM6 Flex Real-Time PCR(美國ABI公司)、核酸檢測儀(Biodropsis BD-1000)(北京五洲東方科技發(fā)展有限公司)、高效液相色譜儀(Agilent 1100)。
1.2 方法
1.2.1 總DNA、RNA提取及cDNA合成 使用DNA提取試劑盒提取菌絲的總DNA,使用E.Z.N.A. Plant RNA Kit提取菌絲的總RNA,依說明書進行操作。使用1%非變性瓊脂糖凝膠電泳和核酸檢測儀分別檢測DNA、RNA的完整性和濃度。使用HiScript II 1st Strand cDNA Synthesis Kit進 行RNA的 反 轉(zhuǎn) 錄,依說明書進行操作。提取后的DNA和反轉(zhuǎn)錄后的cDNA分別放于-20℃,保存待用。
1.2.2LeOAH1的基因克隆 通過同源序列比對,在轉(zhuǎn)錄組中找到了香菇中草酰乙酸水解酶的序列LE01Gene02176,命 名 為LeOAH1,并 在NCBI中blastprimer進行引物設(shè)計(表1)。根據(jù)所設(shè)計的引物,以cDNA和gDNA為模板進行擴增,克隆獲得oah1基因。PCR擴增條件:95℃預(yù)變性3 min;94℃變性30 s,60℃退火40 s,72℃延伸100 s,34個循環(huán);72℃延伸10 min。PCR擴增后,經(jīng)1%的瓊脂糖凝膠電泳分離,分別回收PCR產(chǎn)物,將回收產(chǎn)物連入pEASY-T1克隆載體,導(dǎo)入Trans1-T1克隆感受態(tài)細胞,挑選陽性菌落,由上海生工生物工程有限公司進行測序。
1.2.3 香菇草酰乙酸水解酶LeOAH1基因的生物信息學(xué)分析 利用ExPAsy-ProtParam(https://web.expasy.org/protparam/)進行等電點和蛋白分子量預(yù)測;利用GSDS 2.0(http://gsds.cbi.pku.edu.cn/)進行基因結(jié)構(gòu)分析;利用Bioedit軟件進行氨基酸序列比對;利用Mega7軟件中鄰接法(Neighbor-Joining method)建立系統(tǒng)發(fā)育樹;利用Wolfpsort(https://wolfpsort.hgc.jp/)和Cello(http://cello.life.nctu.edu.tw)兩個網(wǎng)站進行亞細胞定位預(yù)測;利用SWISSMODEL(https://swissmodel.expasy.org/)進行蛋白結(jié)構(gòu)的預(yù)測[13]。
1.2.4 不同pH條件下,草酸含量測定和LeOAH1基因表達分析 利用25 mmol/L磷酸鹽緩沖液,使PDA培養(yǎng)基形成pH 2-8梯度。通過香菇菌絲在pH梯度培養(yǎng)基上的生長情況,還有對pH梯度和磷酸鹽的雙重考慮,選擇了pH3、CK、pH6作為測定對象,分別測定3種pH梯度條件下香菇菌絲分泌胞外的草酸含量和oah1基因表達量。
草酸提取方法:取生長8 d的培養(yǎng)基,去掉玻璃紙,將菌絲與培養(yǎng)基分開,在培養(yǎng)基中心取直徑為1 cm左右的瓊脂塊,將瓊脂塊搗碎,加入8 mL 0.2%稀硫酸,搖床25℃140 r/min,提取2 h,然后用濾紙進行過濾,離心管收集[14]。
草酸含量測定:采用高效液相的方法測定,有機酸分析柱:SB-Aq,4.6×150 mm,5 um;流動相:2 mmol/L硫酸(pH1.96)和純甲醇(色譜級);配比:9:1;柱溫:30℃,流速:0.3 mL/min,檢測波長:210 nm。利用標準品配置梯度濃度,繪制標準曲線,測定草酸含量。
oah1基因表達量的測定:收集pH3、CK、pH6三個處理的菌絲,提取RNA,反轉(zhuǎn)錄后形成cDNA,放于-20℃,保存待用。RT-PCR操作按照 ChamQ Universal SYBR qPCR Master Mix說明書進行,以β-actin作為內(nèi)參基因,引物見表1,反應(yīng)體系:cDNA模板2 μL,上下游引物各0.4 μL(10 μmol/L),SYBR qPCR Master Mix 10 μL,ddH2O 7.2 μL。qPCR反應(yīng)程序:95℃預(yù)變性3 min;95℃變性3 s,60℃退火32 s,40個循環(huán);72℃延伸30 s,每個基因3次重復(fù)。RT-PCR結(jié)果參考2-ΔΔCt法進行分析[15]。
1.2.5 蛋白的原核表達及SDS-PAGE分析 選擇EcoRⅠ和NotⅠ作為質(zhì)粒構(gòu)建中的酶切位點,對表達載體pET-28a進行雙酶切,純化回收pET-28a載體片段和oah1基因片段,進行同源重組連接,獲得重組原核表達載體 pET-28a-oah1,轉(zhuǎn)化BL21(DE3)感受態(tài)細胞。涂布至卡那霉素(100 μg/mL)抗性平板;將抗性平板上長出的單菌落挑取至含有卡那霉素(100 μg/mL)的LB液體培養(yǎng)基中,37℃、180 r/min震蕩培養(yǎng)過夜;按照1.5%接種量將過夜培養(yǎng)物轉(zhuǎn)接至含有卡那霉素的LB液體培養(yǎng)基中,37℃、180 r/min震蕩3 h,至OD600值達到0.6-0.7左右;加入1 mmol/L IPTG,180 r/min過夜誘導(dǎo),選擇了16℃、20℃進行誘導(dǎo),篩選合適的誘導(dǎo)溫度,離心收集菌體。利用PBS緩沖液重懸菌體后,通過超聲破碎法(超聲1 s,停3 s,共10 min)破碎菌體,然后12 000 r/min 離心分離上清和沉淀。通過SDS-PAGE檢測LeOAH1蛋白表達情況。
1.2.6 數(shù)據(jù)分析 實驗數(shù)據(jù)重復(fù)均在3次以上,利用Graphpad Prism 6軟件進行數(shù)據(jù)分析

表 1 本文所用引物
2 結(jié)果
2.1 香菇LeOAH1基因克隆及基因結(jié)構(gòu)分析
收集菌絲提取總RNA,采用核酸檢測儀對其質(zhì)量、純度與濃度進行檢測,1%的瓊脂糖凝膠電泳檢測其完整性。測序結(jié)果顯示LeOAH1的gDNA長度為1 906 bp;cDNA長度為1 356 bp(圖1-A);含有8個內(nèi)含子,9個外顯子(圖1-B)。
2.2 香菇LeOAH1基因的同源性分析
通過SMART氨基酸序列分析,在圖2中213-361aa之間含有超家族所共有的保守結(jié)構(gòu)域。在NCBI中檢索BLAST,獲得與香菇LeOAH1同源的11種真菌OAH的氨基酸序列,通過氨基酸序列比對分析,與NCBI中日本香菇菌株NBRC 111202相似度最高(82%),其次為灰光柄菇,相似度為64%,且發(fā)現(xiàn)OAH結(jié)構(gòu)上在真菌中還是較為保守的(圖3)。
利用Mega7軟件構(gòu)建OAH的系統(tǒng)發(fā)育進化樹(圖4),確認了該序列為草酰乙酸水解酶基因。由于香菇屬于白腐菌,與褐腐菌同屬于擔(dān)子菌,通過系統(tǒng)發(fā)育樹分析,與白腐菌中的灰光柄菇、牛排菌和褐腐菌中癩擬層孔菌的親緣關(guān)系較近;而與子囊菌中黑曲霉、核盤菌和灰霉菌的親緣關(guān)系較遠。
2.3 LeOAH1蛋白結(jié)構(gòu)預(yù)測及分析
LeOAH1的ORF區(qū)為1 356 bp,編碼氨基酸為451aa,預(yù)測了LeOAH1等電點是6.80;預(yù)測蛋白分子量是48.903 46 kD。OAH屬于異檸檬酸裂解酶/磷酸烯醇丙酮酸變位酶超家族成員,OAH蛋白為同源四聚體結(jié)構(gòu),氨基酸序列具Mg2+/Mn2+的結(jié)合位點(圖5)。通過Wolfpsort和Cello進行預(yù)測,該蛋白的亞細胞定位在細胞質(zhì)中。分子式為C2156H3449N605O635S28,其中丙氨酸含量最高11.3%。蛋白二級結(jié)構(gòu)主要由4種構(gòu)象組成,分別是α-螺旋(Hh)、無規(guī)則卷曲(Cc)、延伸鏈(Ee)、β-折疊(Tt),其中,α-螺旋占比例最高為40.08%,含有184個氨基酸,無規(guī)則卷曲占比例34.59%,含有156個氨基酸,延伸鏈占比例17.52%,含有79個氨基酸,β-折疊占比例最低為7.10%,含有32個氨基酸
2.4 不同pH條件下草酸含量與LeOAH1基因表達分析
對不同pH條件下香菇菌絲的生長進行觀察,發(fā)現(xiàn)當培養(yǎng)基pH為4時,香菇菌絲生長速度最快;其次是CK、pH5和pH3,而pH6的菌絲生長速度最慢,pH較低(pH2)與較高(pH7和pH8)時均不能生長。
綜合考慮,對能夠生長的5個處理進行草酸含量分析發(fā)現(xiàn),草酸含量隨著pH的上升而不斷增加;從中選擇了pH3、pH6作為處理組,CK作為對照組,其pH在5左右;LeOAH1的基因表達量也隨著pH的上升而增多(圖6)。
2.5 香菇LeOAH1原核表達分析
轉(zhuǎn)入重組質(zhì)粒pET28a-oah1的菌體,用IPTG(最終濃度1mmol/L)誘導(dǎo)重組蛋白表達,經(jīng)SDS-PAGE電泳分析,誘導(dǎo)12-16 h后,在20和16℃均出現(xiàn)1條與預(yù)期大小48.9 kD相符的蛋白(圖7)。說明基因可體外誘導(dǎo)表達,比較發(fā)現(xiàn)20℃更適合蛋白誘導(dǎo)。后期研究其酶活和理化性質(zhì)需要進一步純化。
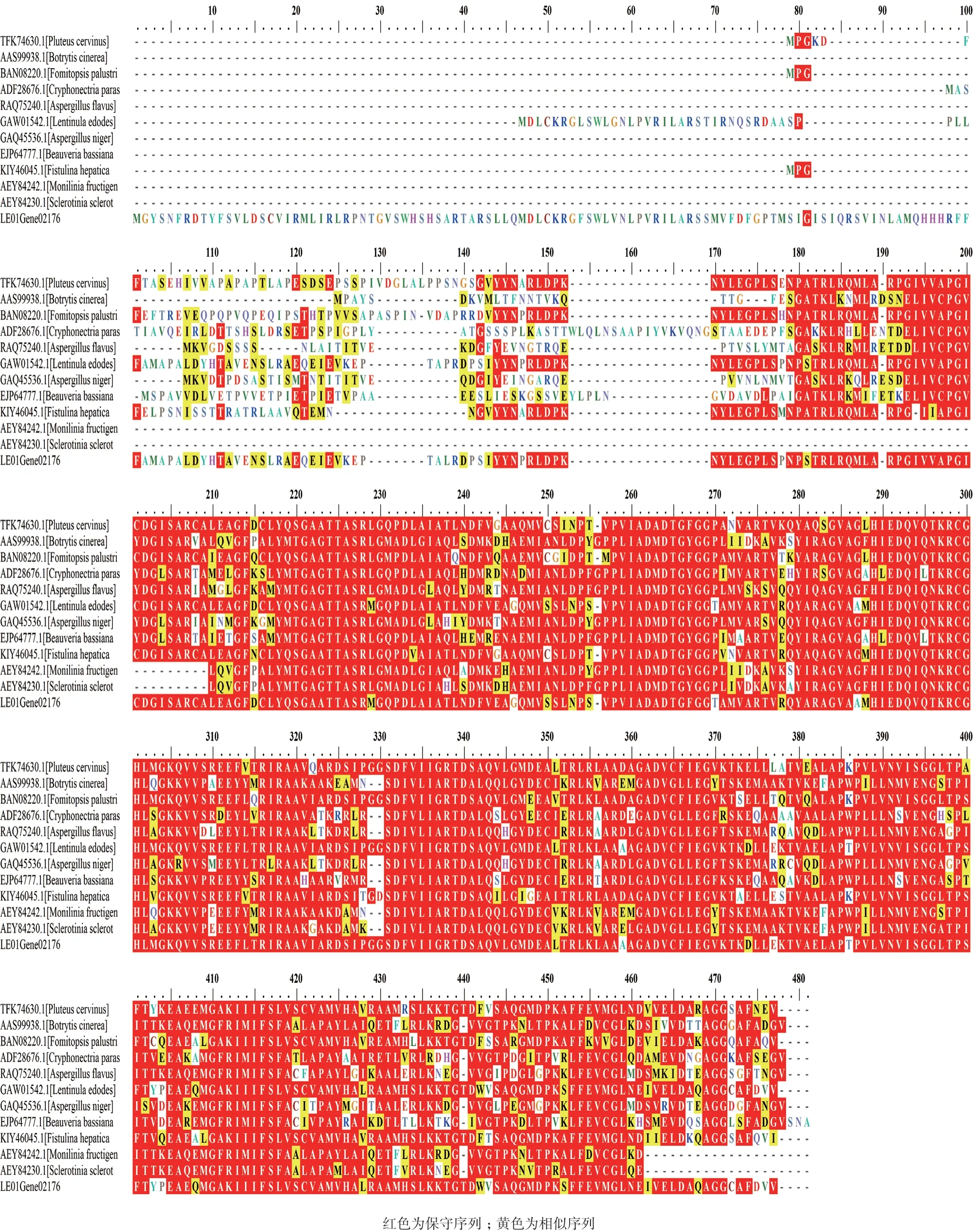
圖3 12種真菌OAH氨基酸序列比對

圖4 LeOAH1蛋白的同源性分析
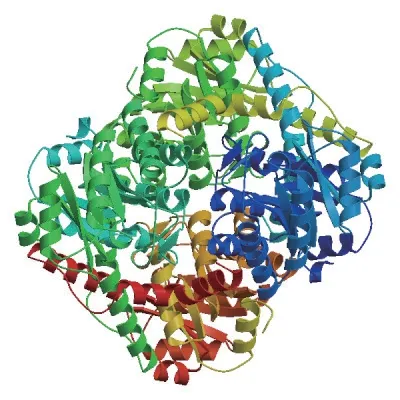
圖5 LeOAH1蛋白的三維結(jié)構(gòu)預(yù)測
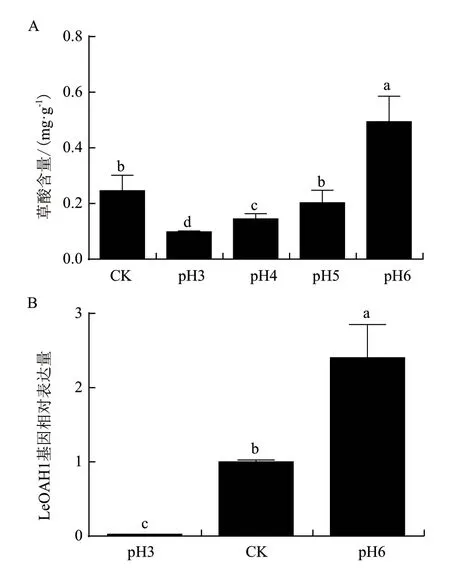
圖6 不同pH條件下香菇菌絲的草酸含量(A)和LeOAH1的基因表達量(B)
3 討論

圖7 LeOAH1基因誘導(dǎo)表達產(chǎn)物SDS-PAGE分析
在真菌中草酸合成的來源,分別是草酰乙酸[16]和乙醛酸[17],而形成草酸的主要是草酰乙酸[18]。在對灰霉菌中草酸代謝途徑的研究中,對草酰乙酸水解酶的進行基因敲除,草酸不再分泌,明確了草酸在灰霉菌中是由草酰乙酸產(chǎn)生的唯一代謝途徑[19]。而在產(chǎn)黃青霉中報道,將oah基因敲除則草酸合成受到抑制,菌株不再產(chǎn)生草酸,而如果將該基因進行回補,則草酸又能順利產(chǎn)生,明確了草酸在產(chǎn)黃青霉中合成及來源的基本路徑[20]。因此,為了研究草酸在香菇中的代謝途徑,后期可能需要對該基因進行敲除或者干擾,確定其基本的代謝途徑。由于在褐腐菌中報道了草酸的來源主要是草酰乙酸和乙醛酸,而乙醛酸是在乙醛酸脫氫酶的作用下形成草酸[21]。文獻中已報道乙醛酸脫氫酶與細胞色素結(jié)合,才可對乙醛酸發(fā)生催化反應(yīng)[22],在香菇基因組中未發(fā)現(xiàn)乙醛酸脫氫酶,但是有類似的細胞色素,推測該細胞色素可能會催化該反應(yīng)。因此干擾該基因?qū)τ谘芯肯愎街胁菟岽x途徑會有很大的幫助。
本實驗采用了基因克隆的手段,獲得了香菇LeOAH1基因,明確了該基因的基本結(jié)構(gòu)和氨基酸序列。通過生物信息學(xué)的分析,發(fā)現(xiàn)該蛋白屬于異檸檬酸裂解酶/磷酸烯醇丙酮酸變位酶超家族成員[23]。該家族主要催化P-C或C-C鍵的形成/裂解;主要成員有磷酸烯醇丙酮酸突變酶(Phosphoenolpyruvate mutase,PEPM),磷 酸 壬 酸 丙 酮 酸 水 解 酶(Phosphonopyruvate hydrolase,PPH),羧 基PEP突變酶(CarboxyPEP mutase,CPEP mutase),草酰乙酸水解酶(Oxaloacetate hydrolase,OAH),異檸檬酸裂合酶(Isocitrate lyase,ICL)和2-甲基異檸檬酸裂合酶(2-methylisocitrate lyase ,MICL)[24]。而該LeOAH1蛋白具有Mg2+/Mn2+的結(jié)合位點,屬于不穩(wěn)定性蛋白,結(jié)構(gòu)為同源四聚體。同源序列比對發(fā)現(xiàn),除與日本香菇品種NBRC111202的蛋白序列相似度高達(82%)外,還與灰光柄菇的蛋白序列相似度較高(64%)。而與病原菌中核盤菌和灰霉菌的相似度不高,這可能是由于香菇與灰光柄菇同屬于擔(dān)子菌的關(guān)系,與子囊菌的親緣關(guān)系較遠,因此子囊菌與擔(dān)子菌之間的OAH蛋白差異較為明顯。通過高效液相和熒光定量PCR分析,不同pH條件下香菇菌絲草酸分泌量和oah的基因表達量成正相關(guān),也確定了香菇菌絲草酸分泌隨pH變化的關(guān)系。在實驗中發(fā)現(xiàn)當pH為3時,基因的相對表達量接近于零,而此時草酸的含量也非常低,與黑曲霉中報道當pH大于等于4時LeOAH1才能進行基因表達相一致[25]。這也間接說明oah的調(diào)控可能受到環(huán)境pH的影響,這與灰霉菌中報道oah基因的調(diào)控可能跟響應(yīng)pH的轉(zhuǎn)錄因子pacc有很大關(guān)系相一致[26]。
草酸在真菌中的作用各不相同,可以調(diào)節(jié)環(huán)境pH[27],溶解金屬氧化物且具有解毒的作用[28],促進木質(zhì)纖維素的降解,特別是促進錳過氧化物酶的活力[29],病原菌還能利用草酸侵染及破壞植物組織[30]。研究香菇草酰乙酸水解酶,對于研究其草酸代謝及調(diào)控的是必不可少的。LeOAH1基因表達量與草酸含量是成正比關(guān)系,香菇中分泌草酸調(diào)節(jié)環(huán)境pH,當oah基因過量表達時,草酸分泌量就會過量增多。本實驗對該酶的基因進行克隆,并且分析了解草酰乙酸水解酶與草酸之間的關(guān)系,為研究香菇菌絲生長及生理功能研究奠定基礎(chǔ)。
4 結(jié)論
克隆了香菇中LeOAH1基因,確定了該基因的gDNA、cDNA長度和氨基酸數(shù)量,生物信息學(xué)分析了該基因在不同pH條件下的表達量及與草酸分泌量的密切關(guān)系,并對該基因進行原核表達,確認其能夠進行體外誘導(dǎo),最適誘導(dǎo)溫度為20℃。

