小麥苗期氮素響應(yīng)的生理及分子差異研究
徐晴 許甫超 秦丹丹 劉小強(qiáng) 袁旭 葛雙桃 董靜
摘要:為探明小麥幼苗對(duì)不同氮素濃度的響應(yīng)差異,設(shè)置高、低2種氮素濃度對(duì)12個(gè)不同基因型小麥進(jìn)行營養(yǎng)液沙培,研究不同處理間小麥幼苗植株鮮重、葉片葉綠素含量、根系形態(tài)等的差異,并對(duì)植株谷氨酰胺合成酶(GS)活性以及氮素吸收利用相關(guān)基因表達(dá)差異進(jìn)行分析;同時(shí),根據(jù)不同基因型小麥材料的植株鮮重對(duì)其氮素利用效率進(jìn)行評(píng)價(jià)。結(jié)果表明,氮素充分供應(yīng)可顯著提高植株鮮重;低氮條件下植株根冠比顯著大于高氮水平下數(shù)值;氮素缺乏可以促進(jìn)主根伸長、總根長和總根表面積的擴(kuò)大,且不同基因型間主根長度差異顯著。幼苗的葉綠素含量隨著氮素濃度升高而增加。不同氮素濃度處理下小麥幼苗葉片的谷氨酰胺合成酶活性在小麥各基因型間表現(xiàn)不同。小麥TaNRT1.1和TaNRT2.1基因在低氮處理下表達(dá)量較高,且高氮效材料鄭麥9023和“410187”中2個(gè)基因的轉(zhuǎn)錄量高于低氮效材料南農(nóng)08Y611中的轉(zhuǎn)錄量。氮素濃度正向調(diào)控氮素同化基因TaGS2的表達(dá),而TaGS1表達(dá)量則在基因型間和氮素處理間差異不大。
關(guān)鍵詞:小麥;苗期;氮素響應(yīng)
中圖分類號(hào):S512
文獻(xiàn)標(biāo)識(shí)碼:A
文章編號(hào):0439-8114( 2020) 20-0039-07;
DOI:10.1408 8/j .cnki.issn0439-8114.2020.20.009
氮素是小麥產(chǎn)量形成的關(guān)鍵因子,它參與植物體內(nèi)核酸、蛋白質(zhì)和氨基酸合成,調(diào)控植株生長發(fā)育的多個(gè)進(jìn)程,對(duì)植物生長發(fā)育起重要的作用[1]。然而,目前土壤當(dāng)季氮肥利用率僅有30%-50%,其余均以淋溶、揮發(fā)的形式流失,對(duì)農(nóng)業(yè)經(jīng)濟(jì)和環(huán)境造成了很大損失和破壞[2]。小麥作為中國第二大糧食作物,氮肥需求量大,因此,采取栽培和遺傳措施提高小麥新品種的氮素利用效率至關(guān)重要。
苗期是小麥生長發(fā)育的重要時(shí)期,它形成小麥植株最初的生物量,以對(duì)抗苗期脅迫和奠定后期生長基礎(chǔ)。苗期氮素吸收主要由根系完成,且根系吸收氮素受周圍氮素濃度調(diào)控[3]。低氮條件下,根系體積擴(kuò)大以增加對(duì)氮素的吸收量滿足植物體的營養(yǎng)需求,高氮條件下則反之[4]。氮素水平還影響植株葉綠素的合成和光合作用,從而影響植株生物量的形成[5]。王平[6]采用水培的方式對(duì)128份小麥材料苗期氮素利用效率進(jìn)行研究,發(fā)現(xiàn)隨著氮素濃度的升高,小麥植株干重、鮮重等隨之增加,且不同供氮水平對(duì)根系形態(tài)有顯著影響。汪曉麗等[7]對(duì)小麥苗期根系的研究認(rèn)為,植株地上部和根系生物量隨著氮素濃度提高而增加,高氮濃度可抑制總根長和根表面積。此外,氮素代謝途徑中的關(guān)鍵酶,特別是硝酸還原酶(NR.nitrate reductase)和谷氨酰胺合成酶(GS,Clutamine synthase)活性也存在不同氮素供應(yīng)間的差異。王琳琳等[8]對(duì)小麥苗期氮代謝相關(guān)指標(biāo)研究表明,NR和GS活性均隨著氮素濃度升高而升高。不同氮素濃度下,植株氮素吸收調(diào)控分子機(jī)制也有不同[9]。NRT1(Nitrate transporter 1)和NRT2(Nitrate transporter 2)基因家族分別負(fù)責(zé)高濃度和低濃度下氮離子的轉(zhuǎn)運(yùn)[10]。擬南芥AtNRT2.1基因在氮素脅迫條件下上調(diào)表達(dá)[11]。GS1(glutamine syn-thase 1)和GS2 (glutamine synthase 2)基因作為銨根離子同化過程中的關(guān)鍵基因,已經(jīng)被證明對(duì)作物氮素利用效率的提高和產(chǎn)量形成具有重要作用[12]。小麥苗期氮素脅迫可造成約4 000多基因表達(dá)的變化,且根系基因變化數(shù)目大于葉部[13]。
鑒于低氮脅迫處理下小麥幼苗根系形態(tài)不同研究結(jié)果存在差異[ 13.14],且相關(guān)研究多采用水培和土壤盆栽[6-8],盆栽種植受種質(zhì)研究份數(shù)限制;而水培若條件控制不好(黑暗環(huán)境和持續(xù)的氧氣供應(yīng)),易造成苗期根系脅迫,影響試驗(yàn)數(shù)據(jù)準(zhǔn)確性。因此,本研究采用沙培的方式,模擬根系正常生長環(huán)境,設(shè)置不同氮素水平,以12份湖北省不同時(shí)期審定的主要小麥品種和外引骨干親本為材料,比較小麥植株苗期不同氮素濃度響應(yīng)的生理形態(tài)和分子變化;同時(shí),鑒定與小麥氮素利用效率密切相關(guān)的苗期性狀,篩選苗期氮素高效小麥材料,為進(jìn)一步明確小麥苗期氮素響應(yīng)機(jī)制和培育氮素高效的小麥品種提供依據(jù)。
1 材料與方法
1.1 試驗(yàn)材料
供試材料為12個(gè)湖北省不同時(shí)期審定小麥品種和骨干親本材料:鄭麥9023、鄂麥006、鄂麥398、鄂麥251、“410187”、襄麥35、荊麥66、華1223、“1168”、百農(nóng)矮抗58、南農(nóng)08Y611、“366”。
1.2試驗(yàn)方法
1.2.1 種子處理小麥材料于2018年12月在湖北省農(nóng)業(yè)科學(xué)院洪山區(qū)南湖試驗(yàn)基地溫室種植。種植前,每株系挑選30顆飽滿、大小均勻一致的種子,用10%雙氧水處理5 min,然后用去離子水沖洗干凈置于墊有3層濕潤的吸水濾紙的培養(yǎng)皿中,22 qC培養(yǎng)箱中保持3d,促進(jìn)發(fā)芽。發(fā)芽后每株系每處理挑選10棵生長一致的幼苗轉(zhuǎn)入提前用營養(yǎng)液浸濕裝有黃沙的96孔穴盤中,每穴一株。
1.2.2 營養(yǎng)液沙培處理前,選取黃沙,用流水淘洗干凈直到水清澈為止(沙里不含任何土和腐殖質(zhì))。用不同氮素濃度的營養(yǎng)液澆灌,對(duì)小麥幼苗進(jìn)行培養(yǎng)。營養(yǎng)液配方參考He等[15],略有修改,具體如下:Ca(NO3)2(0.2 mmol/L或2mmol/L), 0.2 mmol/LKH2PO4, 1.0 mmol/L MgSO4, 1.5 mmol/L KCI, 1.5 mmol/LCaC12,1×10-3mmol/L H3803,5×10-5mmol/L (NH4)6MO7O24,5×10-4mmoI/LC uSO4,1×10-3mmioI/L ZnSO4,1×10-3mmol/LMnSO4, 0.1 mmol/L Fe(lll) -EDTAn
1.2.3 氮素處理上述營養(yǎng)液中以Ca(NO3)2為氮源,設(shè)置低氮(0.2 mmol/L)和高氮(2.0 mmol/L)2個(gè)濃度,每個(gè)培養(yǎng)箱的營養(yǎng)液為2L,每3d更換一次營養(yǎng)液。培養(yǎng)21d后,測(cè)定不同品種(系)植株總鮮重、地上部和根系鮮重、葉綠素含量(SPAD值)、主根長、總根長、總根表面積和植株地上部GS酶活性,并采用液氮速凍部分材料用作基因表達(dá)分析。
1.3 性狀測(cè)定指標(biāo)及方法
苗期地上部、根系鮮重:從根基部起分成地上部和根系,分別測(cè)定重量。
根系性狀測(cè)定:采用RhizoScan掃描儀對(duì)主根長、總根長和總根表面積進(jìn)行測(cè)定。
葉綠素含量測(cè)定:采用SPAD-502 Plus葉綠素測(cè)定儀對(duì)生長3周的小麥植株最上部完全展開葉的葉片中部葉綠素含量進(jìn)行測(cè)定,測(cè)定3次,取平均值進(jìn)行計(jì)算。
CS酶活性測(cè)定:對(duì)植株地上部分混合取樣(新鮮材料)0.1 g,采用谷氨酰胺合成酶(GS)活性檢測(cè)試劑盒(北京索萊寶科技有限公司)進(jìn)行檢測(cè)。
1.4 基因表達(dá)分析
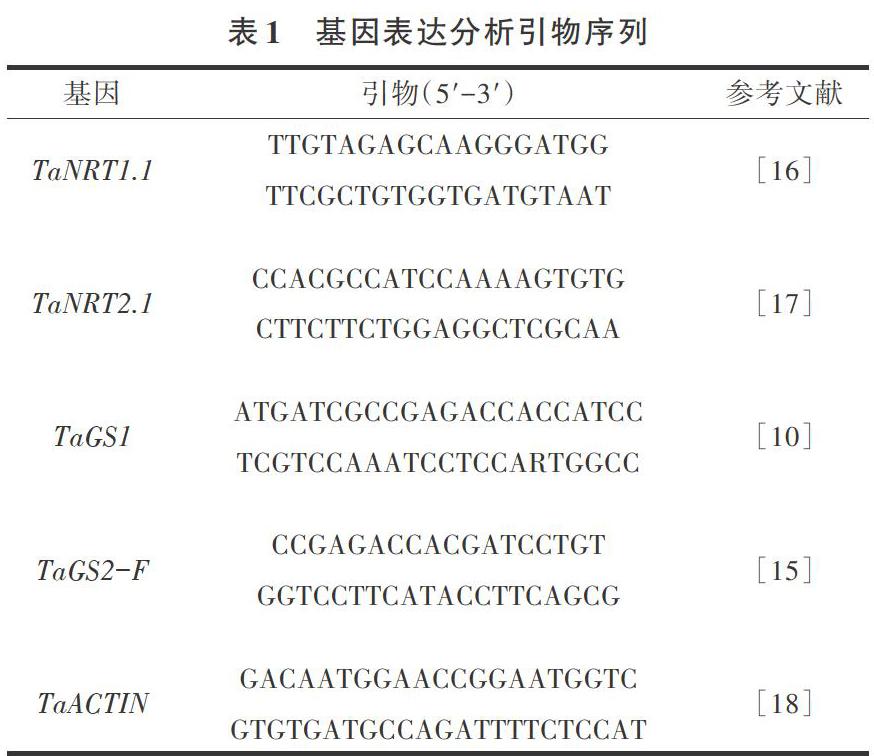
采集不同處理下生長3周的小麥植株,液氮速凍,-80℃保存?zhèn)溆谩NA提取采用OMEGA植物提取試劑盒進(jìn)行,操作按照試劑說明書進(jìn)行。cDNA合成按照Primerscript RT reagent kit進(jìn)行操作。氮素吸收利用相關(guān)基因引物序列根據(jù)前人研究合成[10,15-18],并在網(wǎng)站( http://202. 194. 139.3 2/blast/viro-blast.php和Enzemble plants)上進(jìn)行序列確認(rèn),引物具體序列見表1。qRT-PCR采用QuantStudi0 6 Flex實(shí)時(shí)熒光定量PCR系統(tǒng)(美國ABI公司),以TaAc-tin基因?yàn)閮?nèi)參基因,檢測(cè)基因的表達(dá)量變化。反應(yīng)體系為:cDNA 1 μL,Mix 5 μL,primer各0.25 μL,H2O3.5 μL。每反應(yīng)設(shè)置3次機(jī)械性重復(fù)和生物學(xué)重復(fù),根據(jù)Ct值,利用公式2-△△Ct,計(jì)算基因的相對(duì)表達(dá)量。
1.5 數(shù)據(jù)分析
采用Excel軟件進(jìn)行平均值、變異系數(shù)的計(jì)算;采用SPSS軟件進(jìn)行性狀相關(guān)性分析和方差分析。
2 結(jié)果與分析
2.1 不同氮素水平下小麥植株生物積累量的差異
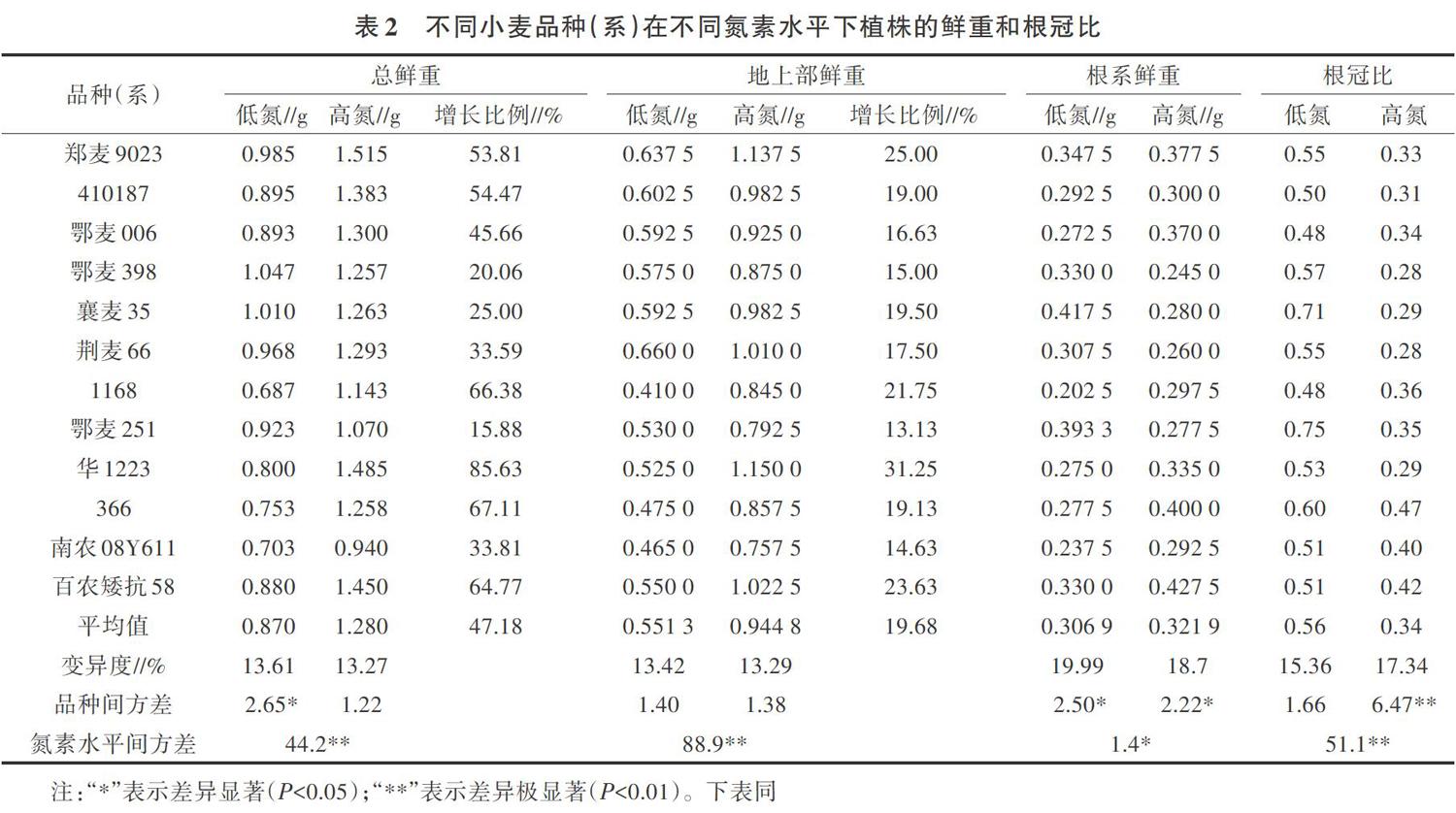
由表2所示,在0.2 mmol/L( LN)和2.0 mmol/L(HN)氮素水平下,12個(gè)不同基因型小麥材料植株總鮮重、地上部鮮重均表現(xiàn)出隨著氮素濃度提高而升高的趨勢(shì)。低氮條件下,植株平均總鮮重為0.870 g,而高氮條件下植株總鮮重可達(dá)1.280 g。同時(shí),不同基因型小麥對(duì)氮素濃度提高的敏感程度也存在較大差異,華1223、“1168”、百農(nóng)矮抗58、“366”、鄭麥9023和“410187”6個(gè)小麥材料的植株總鮮重均增加50%以上;鄂麥251、襄麥35、荊麥66等品種則對(duì)氮素濃度提高反應(yīng)敏感度較低。此外,地上部鮮重的增幅(全部品種平均增幅為19.68%)低于植株總鮮重增幅(全部品種平均增幅為47.18%)。根系鮮重對(duì)氮素濃度的反應(yīng)則不同品種(系)間表現(xiàn)不一致。不同供氮水平下植株根冠比分析結(jié)果顯示,低氮條件下植株根冠比大于高氮濃度下數(shù)值。
方差分析結(jié)果表明(表2),不同參試小麥品種的總鮮重、根系鮮重在低氮條件下存在顯著差異。高氮條件下,根系鮮重和植株根冠比在不同品種(系)間存在顯著和極顯著差異。植株總鮮重、地上部鮮重和根冠比3個(gè)性狀在不同氮素水平間存在顯著或極顯著差異。
2.2不同氮素水平下小麥植株根系特征的差異
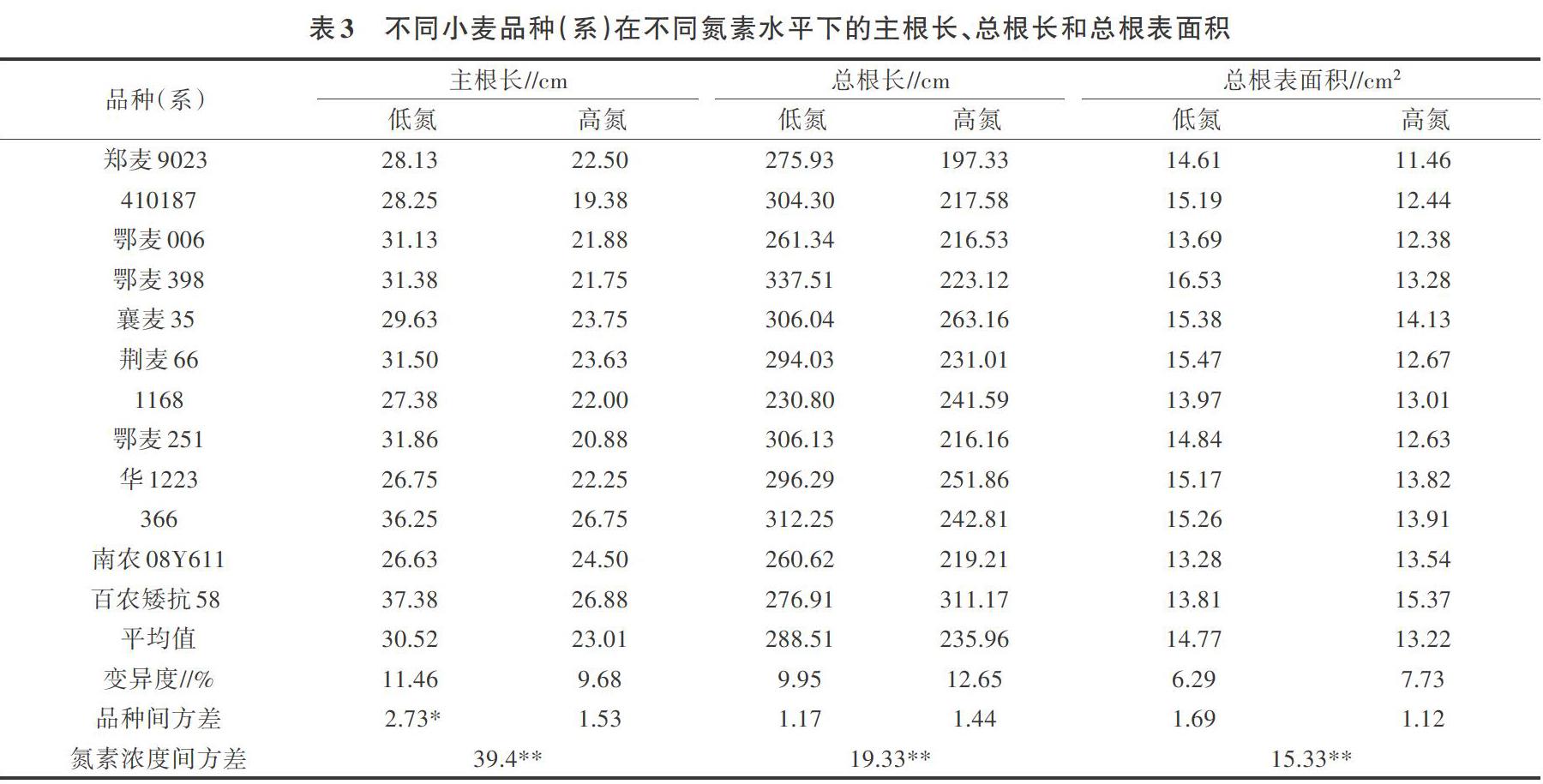
對(duì)不同氮素濃度下小麥幼苗根系特征分析可見(表3),低氮條件下主根長、總根長和總根表面積大部分大于高氮條件下數(shù)值,且各指標(biāo)平均值在不同氮素濃度處理間差異極顯著。不同氮素濃度處理基因型間變異系數(shù)相差不大。主根長、總根長和總根表面積3個(gè)性狀品種間方差分析顯示,僅低氮條件下主根長在不同基因型間差異顯著。
2.3 不同氮素濃度處理下小麥植株葉綠素含量的差異
不同氮素濃度處理下小麥幼苗葉片葉綠素含量分析表明(圖1),氮素濃度升高促進(jìn)小麥葉綠素含量的提高,且不同氮素濃度間小麥葉片葉綠素含量差異均達(dá)極顯著水平。參試小麥材料在同一氮素濃度下,葉綠素含量總體相差不大,僅荊麥66、鄂麥251和“1168”3個(gè)小麥材料的葉綠素含量低于其他品種(系),可能與品種特性有關(guān)。
2.4 不同氮素處理下植株體內(nèi)谷氨酰胺還原酶(GS)活性的差異
對(duì)12個(gè)小麥材料2種氮素處理的地上部GS活性測(cè)定結(jié)果顯示(圖2),不同氮素濃度下不同品種(系)間CS活性差異較大。不同氮素水平下,8個(gè)小麥品種(系)CS活性存在顯著差異,分別為鄂麥006、襄麥35、荊麥66、南農(nóng)08Y611、鄂麥251、華1223.“366”和“1168”,而鄭麥9023、百農(nóng)矮抗58、鄂麥398和“410187”4個(gè)品種CS活性差異不顯著。其中,鄂麥006、襄麥35、荊麥66、華1223和“1168”表現(xiàn)為低氮濃度下植株CS活性大于高氮濃度下數(shù)值;鄂麥251、南農(nóng)08Y611和“366”則表現(xiàn)相反。
2.5 氮素吸收同化及信號(hào)轉(zhuǎn)導(dǎo)相關(guān)基因表達(dá)分析
為了研究氮素吸收同化相關(guān)基因TaNRT1.1、TaNRT2.1、TaGS1和TaGS2在不同氮素濃度下和品種中的表達(dá)差異,以生物積累量顯著差異的鄭麥9023、“410187”(高積累量)和南農(nóng)08Y611(低積累量)為材料進(jìn)行表達(dá)分析。結(jié)果表明(圖3),高氮條件下,TaNRT1.1和TaNR T2.1表達(dá)量均隨著氮素濃度提高而降低,且2個(gè)基因表達(dá)量在高生物積累量小麥材料(鄭麥9023和“410187”)中明顯高于低生物積累量材料南農(nóng)08Y611。氮素同化基因TaCS2表達(dá)量與氮素濃度呈正相關(guān),高氮濃度下的表達(dá)量大于低氮濃度下表達(dá)量,而TaGS1的表達(dá)量在不同氮素濃度和基因型間變化不大。
[2] FRINK CR,WAGGONER PE,AUSUBEL JH Nitrogen fertilizer:ReLrospect and prospect[J]. Proc Natl Acad Sci U S A,1999. 96:1175-80.
[3] MILLER A J,F(xiàn)AN X,SHEN Q,et al Amino acids and nitrate as signals for che regulaLion of nitrogen acquisition [J].J Exp BoL,2008. 59: 111-119
[4]任書杰,張雷明,張歲岐,等氮素營養(yǎng)對(duì)小麥根冠協(xié)調(diào)生長的調(diào)控[J].西北植物學(xué)報(bào),2003,23(3):395-400.
[5] BASCUNAN-CODOY L, SANHUEZA C,PINTO K, et al. Nitrogenphysiology of contrasting genotypes of Chenopodium quinoa Willd (Amaranthaceae) [Jl. Sci Rep, 2018,8: 17524.
[6]王平,不同氮效率類型小麥氮代謝差異及其機(jī)理分析[D]山東秦安:山東農(nóng)業(yè)大學(xué),2011.
[7]汪曉麗,陶玥玥,盛海君,等.硝態(tài)氮供應(yīng)對(duì)小麥根系形態(tài)發(fā)育和氮吸收動(dòng)力學(xué)的影響[J].麥類作物學(xué)報(bào),2010,30(1):129- 134.
[8]王琳琳,王平,王振林,等.小麥親本及其雜交后代苗期氮代謝相關(guān)指標(biāo)的遺傳與表達(dá)差異[J]中國農(nóng)業(yè)科學(xué),2014.47( 12):2300-2312.
[9] KANT S,BIY M. ROTHSTEIN S J.Understanding planL responseto nitrogen limitation for the improvement of crop nitrogen use effi-ciency[J].J Exp Bot, 2011, 62: 1499-1509.
[10] BUCHER P,HAWKESFORD M J Complex phylogeny and geneexpression patterns of memhers of the NITRATE TRANSPORTER1/PEPTIDE TRANSPORTER familY (NPF) in wheat [Jl. Journalof experimental botanY .2014. 65: 5697-5710.
[11] OKAMOTO M. VIDMAR J J,GLASS A D.Regulation of NRTIand NRT2 gene families of Arabidopsis thaliana: Responses to ni-trate provision [J] Plant Cell Physiol.2003, 44: 304-317.
[12] HU M,ZHAO X, LIU Q,et al. Transgenic expression of plastidic glu-tamine synthetase inc:reases nitrogen uptake and yield in wheat [J]Plant Biotechnol J, 2018, 16: 1858-1867.
[13] WANC J,SONC K,SUN L,eI al.Morphological and transcrip- tome analvsis of wheat seedlings response to low nitrogen stress LJlPlants (Basel) .2018.8: 1-8.
[14]張定一,張永清,楊武德,等不同基因型小麥對(duì)低氮脅迫的生物學(xué)響應(yīng)[J].小麥研究,2006.27(1):1-9.
[15] HE X. QU B,LI W,et al.The nitrate-inducible NAC transcrip-tion factor TaNAC2-5A controls nitrate response and increaseswheat yield[J]. Plant physiology, 2015, 169: 1991-2005.
[16] DUAN J,TIAN H. DRIJBER R A,el al.SVstemic and local regu- lacion of phosphate and nitrogen transporter genes by arbuscular my-corrhizal fungi in roots of winter wheat( Triticum aestivum L.)[J]Planl PhVsiol Biochem, 2015, 96: 199-208.
[17] YANC J,WANG M, LI W. et al Reducing expression of a ni-trate-responsive bZIP transcription factor increases grain yieldand N use in wheat [Jl. Planl Biotechnol J, 2019. 17(9):1823- 1833.
[18] MELINO V M. FIENE G, ENJV A.et al. Genetic diversitv for rootplasticity and nitrogen uptake in wheat seedlings [J]. Functionalplant biology, 2015, 42: 942-956.
[19]李雙雙,李晶,陳龍濤,等施氮量對(duì)春小麥根系生長及產(chǎn)量的影響[J].麥類作物學(xué)報(bào),2013.33(1):141-145
[20]盛海君,董召娣,張明偉,等春性和半冬性小麥苗期氮肥吸收效率的差異及其與根系性狀的關(guān)系[J]麥類作物學(xué)報(bào),2016,36(8):1-6.
[21]徐晴,許甫超,董靜,等.小麥氮素利用效率的基因型差異及相關(guān)特性分析[J].中國農(nóng)業(yè)科學(xué),2017.50( 14):2647-2657.
[22] NAWAZ M A. CHEN C, SHIREEN F, et al. Cenome-wide expres-sion profiling of leaves and roots of watermelon in response to lownitrogen[Jl. BMC Genomics. 2018( 19):456
[23] ZHANG C,HOU Y. HAO Q. et al.Cenome-wide survev of thesoybean CATA transcription factor gene family and expressionanalysis under low nitrogen stress [J]. PLoS One, 2015, 10 (4):e0125174
[24] HABASH D Z,MASSIAHA J,RONGH L,et al The role of cy一tosolic glutamine synthetase in wheat [Jl. Ann Appl Biol. 2001,138:83-89.
[25] KICHEY T,HEUMEZ E,POCHOLLE D. et al Combined agro-nomic and physiological aspects of nitrogen management in wheathighlight a central role for glutamine synthetase[J]. New Phytol,2006. 169:265-78.
[26] WANC P, WANC Z L,CAI R G,et al. Physiological and molecu-lar response of wheat roots to nitrate supply in seedling stage LJ]Agricultural sciences in China, 2011, 10(5):695-704.
[27]軒紅梅,王永華,魏利婷,等.小麥幼苗葉片中硝酸鹽轉(zhuǎn)運(yùn)蛋白NRTI和NRT2家族基因?qū)Φ囸I脅迫響應(yīng)的表達(dá)分析[J].麥類作物學(xué)報(bào),2014.34(8):1019-1028.
作者簡介:徐晴(1983-),女,河南平頂山人,助理研究員,博士,主要從事麥類遺傳改良與抗逆遺傳機(jī)制研究,(電話)18571550899(電子信箱)395045924@qq.com;通信作者,董靜,副研究員,主要從事麥類遺傳改良與抗逆遺傳機(jī)制研究,(電子信箱)dongjingsir061@163.c:om。

