QuEChERS方法在HPLC測定豇豆中滅蠅胺殘留量的應用研究
趙馨

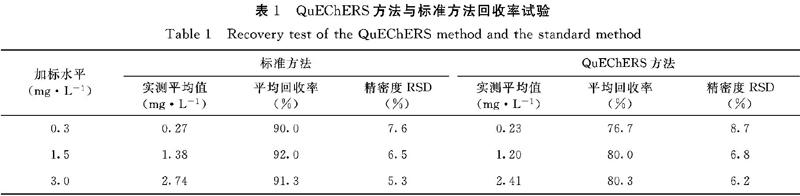
摘?要:為優化豇豆中滅蠅胺殘留量檢測的前處理方法。以豇豆作為基質,對QuEChERS方法與(NY/T 1725-2009 《蔬菜中滅蠅胺殘留量的測定 高效液相色譜法》)的檢驗方法進行回收率試驗比較;并根據單一變量原則,優化QuEChERS方法中的PSA、GCB兩種凈化劑使用量。結果表明:采用QuEChERS方法前處理的豇豆樣品加標回收率為76.7%~80.3%,標準偏差為6.2%~8.7%,其回收率和精密度都能達到分析檢測要求。QuEChERS方法最優的凈化劑組合為無水硫酸鎂900 mg+PSA 100 mg,采用此凈化劑組合前處理的豇豆樣品回收率為83.3%~86.7%,標準偏差為8.2%~11.5%。綜上分析表明,QuEChERS前處理方法簡單快速、準確可靠,既可滿足豇豆中滅蠅胺殘留量檢測的技術要求,又可用于大量樣品的快速檢測。
關鍵詞:豇豆;滅蠅胺;高效液相色譜法;QuEChERS方法
中圖分類號:S436.43?文獻標志碼:A?文章編號:0253-2301(2020)08-0007-06
was carried out between the QuEChERS method and the test method in NY/T 1725-2009 ″Determination of cyromazine residues in vegetables by high performance liquid chromatography″. According to the principle of single variable, the usage of the two cleaning agents PSA and GCB in the QuEChERS method was optimized. The results showed that the standard recovery rate of cowpea samples pretreated with the QuEChERS method was 76.7%-80.3%, and the standard deviation was 6.2%-8.7%. The recovery and precision could both meet the requirements of analysis and detection. The optimal combination of cleaning agents in the QuEChERS method was that the anhydrous magnesium sulfate 900 mg+PSA 100 mg, and the recovery rate of cowpea samples pretreated with the combination of cleaning agents in the QuEChERS method was 83.3%- 86.7%, and the standard deviation was 8.2%-11.5%. In conclusion, the pretreatment method of QuEChERS was simple, rapid, accurate and reliable, which could not only meet the technical requirements for the detection of cyromazine residues in cowpeas, but also be used for the rapid detection of a large number of samples.
Key words: Cowpea; Cyromazine; High performance liquid chromatography; QuEChERS method
滅蠅胺是一種三嗪類化合物,具有內吸作用,屬新型高效、低毒、含氮雜環類殺蟲劑,目前廣泛登記用于豇豆、菜豆、黃瓜、茄子等農作物,用于防治雙翅目昆蟲病蟲害[1-6]。在相關食品抽查結果報告以及筆者日常檢驗工作中,豇豆中滅蠅胺殘留量超限量值的情況時有發生[7]。因此,檢測滅蠅胺殘留情況保證食品安全具有重要作用。依據(GB 2763-2019《食品安全國家標準 食品中農藥最大殘留限量》)[8]的規定,滅蠅胺殘留量指定的檢驗方法為(NY/T 1725-2009《蔬菜中滅蠅胺殘留量的測定?高效液相色譜法》)[9](以下簡稱標準方法),但該方法的前處理較為復雜,溶劑的使用量較大,不適用于大批量檢測工作。
目前在蔬菜水果農藥殘留檢測中,QuEChERS方法具有快速、高效、回收率高的優點,與色譜質譜聯用技術配合,可以大大提高檢驗效率,被廣泛應用于農藥殘留的檢測工作中[10]。QuEChERS方法中,由N丙基硅烷(PSA)、C18、石墨炭黑(GCB)3種凈化劑發揮著支持、吸附、凈化的作用,待測農藥在填料、樣品基質和洗脫劑之間進行吸附與分配,最終達到提取與凈化雙重效果[11]。本研究以豇豆作為基質,對QuEChERS方法與標準方法進行回收率試驗比較,并對QuEChERS方法的可行性進行評價;再根據單一變量原則,對不同組分的分散凈化劑進行加標回收率對比試驗,從回收率、凈化效果兩個方面綜合分析,選擇最佳的凈化劑組分,從而達到優化滅蠅胺殘留量檢驗方法的目的。
1?材料與方法
1.1?供試材料
材料為豇豆樣品(經檢驗后的陰性留樣)。試劑主要有氯化鈉(分析純);石墨炭黑(GCB,分析純);乙酸銨(分析純);氨水(分析純);鹽酸(分析純);乙腈(色譜純);甲醇(色譜純);硫酸鎂(色譜純);乙二胺N丙基硅烷(PSA,色譜純)。
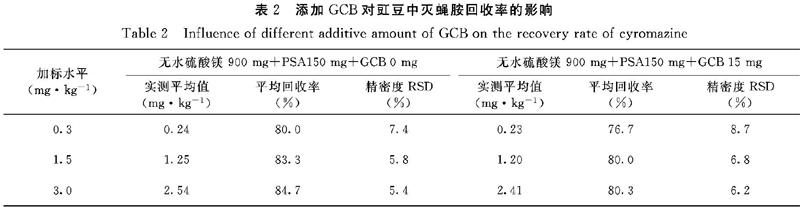
2.3.1?GCB添加量對豇豆中滅蠅胺回收率的影響?由試驗結果(表2)可知,QuEChERS前處理方法采用無水硫酸鎂 900 mg+PSA 150 mg+GCB 0 mg凈化劑組合的試樣加標回收率為80.0%~84.7%,標準偏差為5.4%~7.4%;而采用無水硫酸鎂 900 mg+PSA 150 mg+GCB 15 mg凈化劑組合的試樣加標回收率為76.7%~80.3%,標準偏差為6.2%~8.7%,回收率和精密度都能達到分析檢測的要求。
凈化效果方面,未加入GCB的試樣溶液為淡綠色,加入GCB 15 mg試樣溶液為淡黃色,說明試樣加入GCB后能夠吸附更多色素。但從加標試樣溶液色譜圖(圖2a、2b)可以看出,添加GCB與未加GCB的色譜圖中基線、峰寬、保留時間等沒有明顯差異,表明添加GCB含量對基質中雜質的凈化能力沒有明顯差異,且吸附的色素對檢驗干擾有限。
綜合以上分析,加入GCB可以去除豇豆基質中的部分色素,但未改善凈化效果,而且對滅蠅胺也造成吸附損失,導致回收率降低。因此,在之后的試驗處理過程中選擇不添加GCB。
2.3.2?PSA不同用量對豇豆中滅蠅胺回收率的影響?由試驗結果(表3)可知,采用凈化劑組合無水硫酸鎂900 mg+PSA 150 mg前處理的試樣加標回收率為80.4%~84.7%,標準偏差為5.4%~7.4%;采用凈化劑組合無水硫酸鎂900 mg+PSA 100 mg前處理的試樣加標回收率為83.3%~86.7%,標準偏差為5.9%~8.6%;采用凈化劑無水硫酸鎂900 mg+PSA 50 mg前處理的試樣加標回收率為65.0%~66.7%,標準偏差為8.2%~11.5%。其中,采用凈化劑組合無水硫酸鎂900 mg+PSA 150 mg與無水硫酸鎂900 mg+PSA 100 mg前處理方法的回收率和精密度均能達到分析檢測的要求,而采用凈化劑組合無水硫酸鎂900 mg+PSA 50 mg前處理方法的回收率低于80%,且最低濃度0.3 mg·kg-1的測試值標準偏差大于10%。
凈化效果方面,3種凈化劑組合的試樣溶液均為淡綠色,顏色差異不大。從加標試樣溶液色譜圖(圖2a、圖3a、圖3b)可知,PSA可以去除部分色素,隨著PSA使用量的增加,色素凈化效果沒有明顯變化。但凈化劑組合為無水硫酸鎂 900 mg+PSA50 mg的保留時間偏移較大,即PSA使用量為50 mg時,雜質未能有效去除,對滅蠅胺保留時間產生影響。
綜合以上分析表明,QuEChERS前處理方法采用PSA為凈化劑可以去除豇豆基質部分的雜質和色素,當PSA使用量從50 mg增加到100 mg的加標回收率與凈化效果明顯改善;而當PSA使用量從100 mg增加到150 mg時的加標回收率與凈化效果無明顯變化。故采用無水硫酸鎂900 mg+PSA100 mg的凈化劑組合可以在滿足凈化要求的前提下,同時減少PSA使用量,節約成本。
3?結論
本研究以優化豇豆中滅蠅胺殘留檢測的前處理方法為目的,對QuEChERS以及(NY/T 1725-2009 《蔬菜中滅蠅胺殘留量的測定 高效液相色譜法》)前處理方法進行比較分析,試驗結果表明采用QuEChERS方法前處理的豇豆樣品加標回收率為76.7%~80.3%,標準偏差為6.2%~8.7%,其回收率和精密度都能達到分析檢測要求。以加標回收率和凈化效果為評價標準,進一步對QuEChERS前處理方法中的PSA、GCA凈化劑使用量進行優化,得出QuEChERS方法最優的凈化劑組合為無水硫酸鎂900 mg+PSA 100 mg,采用此凈化劑組合前處理的豇豆樣品回收率為83.3%~86.7%,標準偏差為8.2%~11.5%。本研究通過改進優化QuEChERS前處理方法,建立了豇豆滅蠅胺殘留量的改進QuEChERS方法,該方法簡單快速、準確可靠,既可滿足豇豆中滅蠅胺殘留的技術要求,又可用于大量樣品的快速檢測。
參考文獻:
[1]徐軍,張盈,董豐收,等.超高效液相色譜串聯質譜法快速檢測菜豆及土壤中的滅蠅胺殘留[J].農藥學學報,2012,14(6):654-658.
[2]陳靜波,張玉順,劉宇,等.滅蠅胺的合成與應用研究[J].云南大學學報 (自然科學版), 2008,30(4):392-395.
[3]于丹,水清.滅蠅胺能治大蒜潛葉蠅[J].農藥市場信息,2009(22):39.
[4]?劉瑛,余晟,于峰,等.滅蠅胺的毒性研究[J].農藥,2000,39(9):25-33.
[5]張鋒鋒,趙銀寶,姜瑞,等.滅蠅胺在菜豆中的消解動態與殘留測定[J].寧夏農林科技,2014,55(11):43-59.
[6]郭筠,莫漢宏,安鳳春,等.HPLC法檢測滅蠅胺在黃瓜和土壤中的殘留[J].環境化學,2004,11(6):700-703.
[7]?劉少偉,阮贊林.滅蠅胺超標豇豆[J].質量與標準化,2018(8):37.
[8]?中華人民共和國國家衛生健康委員會,中華人民共和國農業農村部,國家市場監督管理總局.GB 2763-2019食品安全國家標準 食品中農藥最大殘留限量[S].北京:中國農業出版社,2019.
[9]?中華人民共和國農業部.NY/T 1725-2009蔬菜中滅蠅胺殘留量的測定高效液相色譜法[S].北京:中國農業出版社,2009.
[10]?呂曉玲.QuEChERS方法在農藥多殘留檢測中的應用研究[D].北京:中國農業科學院,2010.
[11]中華人民共和國國家衛生健康委員會,中華人民共和國農業農業村部,國家市場監督管理總局.GB 23200.113-2018食品安全國家標準 植物源性食品中208種農藥及其代謝物殘留量的測定 氣相色譜-質譜聯用法[S].北京:中國農業出版社,2018.
[12]?王婧.QuEChERS 前處理方法在農藥殘留檢測中的應用[J].山西農業科學,2017,45(12):2051-2055.
[13]羅銥泳,姚詹武,陳東康,等.豇豆的營養成分分析及保健功能[J].中國果蔬,2000(2):40.
[14]?石焱芳,王征,吳麗榮,等.QuEChERS超高效液相色譜串聯質譜法同時測定蔬菜中30種農藥殘留[J].食品安全質量檢驗學報,2020,11(3):891-901.
[15]王丹.基于色譜-串聯質譜技術測定果蔬中的農藥多殘留[D].泰安:山東農業大學,2019.
(責任編輯:林玲娜)

