miR-155/SOCS1/NF-κB通路在快速眼動(dòng)睡眠剝奪大鼠免疫失衡中的作用機(jī)制①
秦 冰 常淑瑩 劉芳翡 李 莉 胡亞瓊
(河南醫(yī)學(xué)高等專(zhuān)科學(xué)校,鄭州 451191)
睡眠被認(rèn)為是維持和修復(fù)免疫功能必不可少的生理過(guò)程,睡眠干擾可影響機(jī)體健康從而造成各項(xiàng)生理功能紊亂[1]。影響睡眠的信號(hào)通路對(duì)于睡眠剝奪的機(jī)制尚未明確。miRNA在轉(zhuǎn)錄后水平上調(diào)控靶基因的表達(dá),miR-155在免疫反應(yīng)中是巨噬細(xì)胞、樹(shù)突狀細(xì)胞甚至上皮細(xì)胞中先天免疫應(yīng)答的關(guān)鍵調(diào)節(jié)劑,在結(jié)腸炎T淋巴細(xì)胞和B淋巴細(xì)胞中發(fā)揮作用[2]。下游通路細(xì)胞因子信號(hào)傳送阻抑物(suppressor of cytokine signaling,SOCS1)/核因子κB(nuclear factor kappa beta,NF-κB)在免疫過(guò)程中可調(diào)節(jié)結(jié)腸炎的T細(xì)胞極化和擴(kuò)增來(lái)調(diào)節(jié)黏膜免疫系統(tǒng)影響免疫功能,推測(cè),miR-155/SOCS1/NF-κB通路可能影響睡眠[3]。基于此,本研究建立快速眼動(dòng)(rapid eye movement,REM)睡眠剝奪大鼠模型,檢測(cè)miR-155/SOCS1/NF-κB對(duì)REM睡眠剝奪免疫方面的影響。
1 材料與方法
1.1材料
1.1.1實(shí)驗(yàn)動(dòng)物 清潔級(jí)健康SD大鼠由北京維通利華實(shí)驗(yàn)動(dòng)物技術(shù)有限公司提供,動(dòng)物生產(chǎn)許可證號(hào): SCXK(京)2018-0013,動(dòng)物使用許可證號(hào):SYXK(京)2018-0037,動(dòng)物質(zhì)量合格證號(hào):20190301507,體質(zhì)量(200±20)g,所有大鼠均在溫度(25±0.5)℃、濕度(55±5)%、12 h光照/12 h黑暗實(shí)驗(yàn)動(dòng)物中心常規(guī)飼養(yǎng)。本動(dòng)物實(shí)驗(yàn)經(jīng)河南醫(yī)學(xué)高等專(zhuān)科學(xué)校動(dòng)物倫理委員會(huì)批準(zhǔn),倫理審批號(hào):IACUC-20190108007。
1.1.2主要試劑 改良平臺(tái)(直徑6 cm,高8 cm);日光燈(40 W,深圳市長(zhǎng)憶光電科技有限公司);HE染色試劑盒(北京索萊寶科技有限公司,貨號(hào):G1120);大鼠ELISA腫瘤壞死因子(tumor necrosis factor-alpha,TNF-α)、IL-1、IL-6試劑盒、一抗SOCS1(抗兔)、NF-κB(抗兔)、內(nèi)參甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(抗兔)、二抗羊抗兔(美國(guó)abcam公司,貨號(hào)分別為:ab208348、ab79277、ab100712、ab3691、ab220803、ab181602、ab6721);BCA試劑盒、PVDF膜(碧云天生物科技有限公司,貨號(hào)分別為:P0012S、FFP32);miRVana miRNA提取試劑盒(美國(guó)Ambion公司,貨號(hào):AM1552);2×Hi SYBR Green QPCR Mix(日本TaKaRa公司,貨號(hào):ARR041A);二氨基聯(lián)苯胺(Diaminobenzidine,DAB)顯色試劑(索來(lái)寶科技有限公司,貨號(hào):DA1010)。引物由上海生工生物公司合成。
1.1.3主要儀器 XK-SW002普通光學(xué)顯微鏡(美國(guó)Olympus公司);7500實(shí)時(shí)熒光定量PCR(Quantitative Real-time Polymerase Chain Reaction,qRT-PCR)儀(美國(guó)ABI公司);5200蛋白凝膠成像儀(上海Tanon公司)。
1.2方法
1.2.1REM睡眠剝奪模型建立 30只大鼠分成3組,對(duì)照組、1 d REM睡眠剝奪組、7 d REM睡眠剝奪組,每組10只。按參考文獻(xiàn)[4]方法制備REM睡眠剝奪模型,利用改良多平臺(tái)睡眠法,1 d REM睡眠剝奪組日光燈照射持續(xù)1 d REM睡眠剝奪,7 d REM睡眠剝奪組日光燈照射持續(xù)7 d REM睡眠剝奪,對(duì)照組保持12 h光照/12 h黑暗。其余條件與正常飼養(yǎng)條件相同,且各組之間無(wú)影響。
1.2.2大鼠認(rèn)知能力測(cè)試 采用迷宮法測(cè)試大鼠認(rèn)知能力,模型建立前對(duì)所有動(dòng)物進(jìn)行Y型迷宮箱訓(xùn)練,選擇活躍、對(duì)電擊敏感、逃避反應(yīng)迅速大鼠進(jìn)行實(shí)驗(yàn)。對(duì)大鼠進(jìn)行空間訓(xùn)練和學(xué)習(xí)測(cè)試,迷宮中先適應(yīng)3~5 min,然后無(wú)規(guī)則次序變換安全區(qū)。電擊后大鼠逃入安全區(qū),然后以此為起點(diǎn)進(jìn)行下一次測(cè)試,每次訓(xùn)練20次,共3 d。測(cè)試大鼠足底通電后10 s內(nèi)一次性逃入安全區(qū)為正確反應(yīng),否則為錯(cuò)誤反應(yīng)。記錄大鼠每日出現(xiàn)錯(cuò)誤反應(yīng)次數(shù)。
1.2.3ELISA檢測(cè)血清中TNF-α、IL-1、IL-6水平 將上述靜脈血混合均勻,3 000 r/min離心10 min,收集血清后分裝待用。實(shí)驗(yàn)時(shí)嚴(yán)格按照大鼠ELISA TNF-α、IL-1、IL-6試劑盒說(shuō)明書(shū)步驟進(jìn)行。
1.2.4HE檢測(cè)大鼠海馬組織、前額葉皮質(zhì)區(qū)形態(tài) 模型處理結(jié)束后,1%戊巴比妥鈉麻醉大鼠,肝素鈉抗凝管抽取靜脈血,迅速斷頭取腦,冰上分離海馬組織、前額葉皮質(zhì)區(qū)組織,部分置于-80℃冰箱保存待用,部分置于4%多聚甲醛中固定。將4%多聚甲醛中固定的組織取出,酒精中脫水,二甲苯透明,石蠟包埋、凝固后切片,切片厚度為5 μm。切片后HE染色,蘇木精染色、乙醇伊紅復(fù)染,酒精中脫水,二甲苯透明,中性樹(shù)膠封片,光學(xué)顯微鏡拍照。
1.2.5qRT-PCR檢測(cè)大鼠海馬組織、前額葉皮質(zhì)區(qū)組織中miR-155表達(dá)水平 采用qRT-PCR檢測(cè)大鼠海馬組織、前額葉皮質(zhì)區(qū)中miR-155表達(dá)水平。組織碾碎,RNA提取試劑盒提取組織中總RNA,反轉(zhuǎn)錄得cDNA。qRT-PCR儀對(duì)miR-155、內(nèi)參進(jìn)行擴(kuò)增。引物序列見(jiàn)表1。cDNA上樣量1 μl(50 ng/μl),10 μmol/L 上下游引物各0.5 μl,miScript SYBR?Green Mix 10 μl,ddH2O 8.0 μl。反應(yīng)條件:95℃、60 s;95℃、30 s,60℃、35 s,45個(gè)循環(huán)。采用2-ΔΔCt法對(duì)組織中miR-155表達(dá)水平進(jìn)行定量分析。
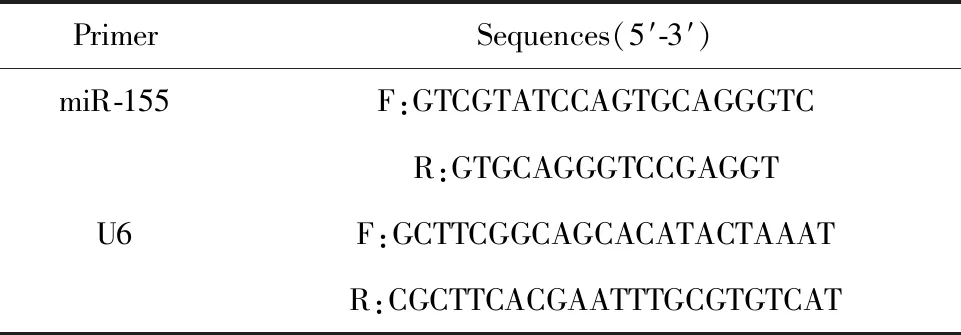
表1 miR-155及內(nèi)參引物Tab.1 miR-155 and internal reference primers
1.2.6Western blot檢測(cè)海馬組織、前額葉皮質(zhì)區(qū)組織中SOCS1、NF-κB蛋白表達(dá) -80℃冰箱待用組織碾碎,TRizol法提取總蛋白,BCA試劑盒測(cè)定蛋白總濃度,每孔上樣30 ng,PAGE膠分離蛋白質(zhì),PVDF膜轉(zhuǎn)膜;5%脫脂奶粉室溫封閉2 h;對(duì)應(yīng)加入一抗SOCS1、NF-κB、GADPH(1∶5 000),4℃孵育過(guò)夜;對(duì)應(yīng)加入二抗(1∶5 000),室溫孵育1 h。DAB顯色試劑顯色,蛋白凝膠成像儀拍照和定量分析。
2 結(jié)果
2.1睡眠剝奪對(duì)大鼠認(rèn)知能力影響 與對(duì)照組相比,1 d、7 d REM睡眠剝奪組錯(cuò)誤反應(yīng)次數(shù)增加(P<0.05);與1 d REM睡眠剝奪組相比,7 d REM睡眠剝奪組錯(cuò)誤反應(yīng)次數(shù)增加(P<0.05)。見(jiàn)表2。
表2 3組大鼠認(rèn)知能力比較Tab.2 Comparison of cognitive ability of three groups of
2.2睡眠剝奪對(duì)大鼠血清中TNF-α、IL-1、IL-6水平影響 與對(duì)照組相比,1 d、7 d REM睡眠剝奪組血清中TNF-α、IL-1、IL-6升高(P<0.05);與1 d REM睡眠剝奪組相比,7 d REM睡眠剝奪組血清中TNF-α、IL-1、IL-6升高(P<0.05)。見(jiàn)表3。
表3 3組大鼠血清中TNF-α、IL-1、IL-6水平比較Tab.3 Comparison of serum TNF-α,IL-1 and IL-6 levels in three groups of
2.3睡眠剝奪對(duì)大鼠海馬組織、前額葉皮質(zhì)區(qū)形態(tài)影響 對(duì)照組大鼠海馬組織、前額葉皮質(zhì)區(qū)細(xì)胞排列正常、分布均勻。1 d REM睡眠剝奪組海馬組織、前額葉皮質(zhì)區(qū)細(xì)胞均出現(xiàn)神經(jīng)元丟失、腫脹、變性和死亡,以及炎癥細(xì)胞浸潤(rùn)和神經(jīng)膠質(zhì)細(xì)胞增殖現(xiàn)象。7 d REM睡眠剝奪組海馬組織、前額葉皮質(zhì)區(qū)細(xì)胞均出現(xiàn)大量神經(jīng)元丟失,腫脹,變性和死亡,以及炎癥細(xì)胞浸潤(rùn)和神經(jīng)膠質(zhì)細(xì)胞增殖現(xiàn)象。見(jiàn)圖1。
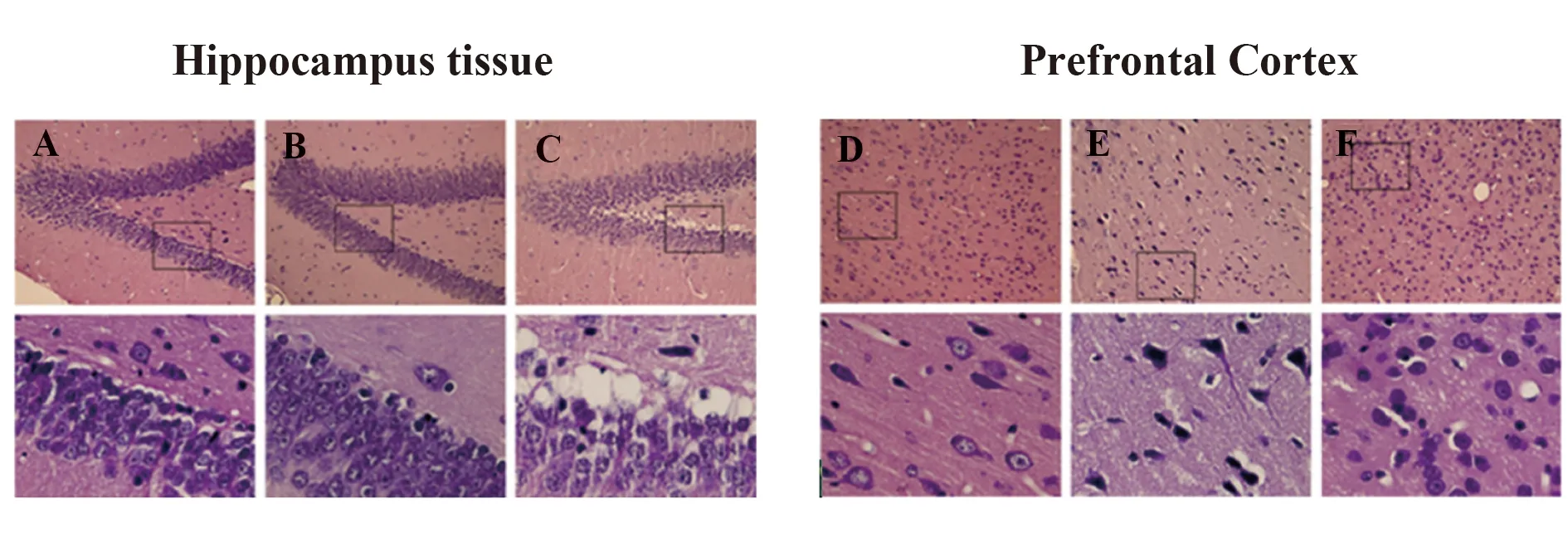
圖1 HE檢測(cè)大鼠海馬組織、前額葉皮質(zhì)區(qū)形態(tài)Fig.1 Morphology of hippocampus and prefrontal cortex of rats detected by HENote:A,D.Control group;B,E.1 d REM sleep deprivation group;C,F(xiàn).7 d REM sleep deprivation group.The base drawing is enlarged drawing of the upper box respectively (magnification,×400).
2.4睡眠剝奪對(duì)大鼠海馬組織、前額葉皮質(zhì)區(qū)組織中miR-155表達(dá)水平影響 前額葉皮質(zhì)區(qū)組織中miR-155差異無(wú)統(tǒng)計(jì)學(xué)意義(P<0.05)。與對(duì)照組相比,1 d、7 d REM睡眠剝奪組海馬組織中miR-155升高(P<0.05);與1 d REM睡眠剝奪組相比,7 d REM睡眠剝奪組海馬組織中miR-155升高(P<0.05)。見(jiàn)表4。
表4 3組大鼠海馬組織、前額葉皮質(zhì)區(qū)組織中miR-155表達(dá)水平比較Tab.4 Comparison of miR-155 expression levels in hippocampus and prefrontal cortex of three groups of
2.5睡眠剝奪對(duì)大鼠海馬組織、前額葉皮質(zhì)區(qū)組織中SOCS1、NF-κB蛋白表達(dá)影響 與對(duì)照組相比,1 d、7 d REM睡眠剝奪組海馬組織、前額葉皮質(zhì)區(qū)組織中SOCS1水平降低(P<0.05);7 d REM睡眠剝奪組海馬組織、前額葉皮質(zhì)區(qū)組織中,1 d REM睡眠剝奪組前額葉皮質(zhì)區(qū)組織中NF-κB水平升高(P<0.05)。與1 d REM睡眠剝奪組相比,7 d REM睡眠剝奪組海馬組織、前額葉皮質(zhì)區(qū)組織中SOCS1水平降低(P<0.05);NF-κB水平升高(P<0.05)。見(jiàn)圖2、表5。
表5 3組大鼠海馬組織、前額葉皮質(zhì)區(qū)組織中SOCS1、NF-κB蛋白表達(dá)比較Tab.5 Expressions of SOCS1 and NF-κB in hippocampus and prefrontal cortex of three groups of

圖2 Western blot檢測(cè)大鼠海馬組織、前額葉皮質(zhì)區(qū)SOCS1、NF-κB蛋白表達(dá)Fig.2 Western blot detection of SOCS1 and NF-κB protein expression in hippocampus and prefrontal cortex of ratsNote:1.Control group;2.1 d REM sleep deprivation group;3.7 d REM sleep deprivation group.
3 討論
睡眠剝奪是本身由于外在或內(nèi)在因素導(dǎo)致睡眠無(wú)法滿(mǎn)足,短暫時(shí)間的睡眠剝奪被認(rèn)為與疾病、創(chuàng)傷等因素相關(guān),是一種應(yīng)激反應(yīng),可造成機(jī)體正常生理功能的紊亂,降低機(jī)體免疫功能[5]。睡眠剝奪是造成焦慮的原因之一,特別在女性中更為嚴(yán)重[6];會(huì)降低人的注意力,且隨著任務(wù)時(shí)間的延長(zhǎng),關(guān)注度會(huì)持續(xù)變差[7]。 本研究發(fā)現(xiàn)與對(duì)照組相比,1 d、7 d REM睡眠剝奪組錯(cuò)誤反應(yīng)次數(shù)增加;與1 d REM睡眠剝奪組相比,7 d REM睡眠剝奪組錯(cuò)誤反應(yīng)次數(shù)增加。REM睡眠剝奪增加錯(cuò)誤反應(yīng)次數(shù),使出錯(cuò)概率增加,從而加重疾病進(jìn)程。
免疫因子TNF-α、IL-1、IL-6在研究中應(yīng)用廣泛。其中TNF-α作為一種細(xì)胞因子,由單核細(xì)胞或活化的吞噬細(xì)胞產(chǎn)生,具有免疫功能;在重度潰瘍性結(jié)腸炎大鼠模型中,抗TNF-α后可調(diào)節(jié)腸道菌群和免疫系統(tǒng)從而緩解疾病[8]。IL-1來(lái)源廣泛,是急性期免疫反應(yīng)的主要調(diào)節(jié)因子,主要發(fā)生部位在神經(jīng)系統(tǒng)和脊髓中;當(dāng)IL-1濃度較低時(shí),主要發(fā)揮免疫功能,可促進(jìn)T細(xì)胞、B細(xì)胞的生長(zhǎng)及產(chǎn)生免疫球蛋白[9]。IL-6作為一種調(diào)控因子,可促進(jìn)B細(xì)胞分化和分泌抗體,同時(shí)對(duì)機(jī)體感染和損傷刺激起調(diào)節(jié)作用;IL-6可影響肝癌患者病毒感染后免疫功能從而影響疾病[10]。本研究發(fā)現(xiàn)1 d REM睡眠剝奪組海馬組織、前額葉皮質(zhì)區(qū)細(xì)胞均出現(xiàn)神經(jīng)元丟失、腫脹、變性和死亡,以及炎癥細(xì)胞浸潤(rùn)和神經(jīng)膠質(zhì)細(xì)胞增殖現(xiàn)象。7 d REM睡眠剝奪組海馬組織、前額葉皮質(zhì)區(qū)細(xì)胞均出現(xiàn)大量神經(jīng)元丟失,腫脹,變性和死亡,以及炎癥細(xì)胞浸潤(rùn)和神經(jīng)膠質(zhì)細(xì)胞增殖現(xiàn)象。睡眠剝奪會(huì)引發(fā)腦部海馬、前額葉皮質(zhì)區(qū)組織細(xì)胞出現(xiàn)炎癥現(xiàn)象,會(huì)使各細(xì)胞變形、腫脹,嚴(yán)重使致死;且隨著睡眠剝奪時(shí)間的延長(zhǎng),各種不良癥狀加重。與對(duì)照組相比,1 d、7 d REM睡眠剝奪組血清中TNF-α、IL-1、IL-6升高;與1 d REM睡眠剝奪組相比,7 d REM睡眠剝奪組血清中TNF-α、IL-1、IL-6升高。睡眠剝奪不僅影響腦部神經(jīng)細(xì)胞,還導(dǎo)致全身免疫因子失衡,導(dǎo)致機(jī)體指標(biāo)紊亂影響健康,且隨著時(shí)間的增加各項(xiàng)指標(biāo)變化嚴(yán)重,但具體機(jī)制尚不明確。
miRNA參與固有免疫炎癥反應(yīng)的研究是一個(gè)熱點(diǎn)問(wèn)題,miR-155可調(diào)節(jié)CD4+Treg細(xì)胞的表達(dá)從而影響冠狀動(dòng)脈斑塊穩(wěn)定性[11];miR-155納米顆粒在鼠內(nèi)巨噬細(xì)胞的細(xì)胞攝取方面表現(xiàn)出優(yōu)異的能力,miR-155逃逸進(jìn)入細(xì)胞質(zhì)和免疫抑制性腫瘤微環(huán)境中,可顯著抑制髓樣抑制細(xì)胞的形成并刺激T淋巴細(xì)胞在體外分泌更多的干擾素-γ細(xì)胞因子,提高CD4+和CD8+T細(xì)胞的浸潤(rùn)和活化,從而調(diào)節(jié)腫瘤微環(huán)境[12]。在類(lèi)風(fēng)濕性關(guān)節(jié)炎等慢性炎癥疾病中,miR-155抑制劑可降低TNF-α誘導(dǎo)的成纖維樣滑膜細(xì)胞增殖,并減弱TNF-α誘導(dǎo)的IL-6和IL-1β產(chǎn)生從而抑制疾病的進(jìn)展[13]。miR-155調(diào)節(jié)免疫因子影響從而免疫功能,但具體通路有待驗(yàn)證。本研究發(fā)現(xiàn)前額葉皮質(zhì)區(qū)組織中miR-155差異無(wú)統(tǒng)計(jì)學(xué)意義。與對(duì)照組相比,1 d、7 d REM睡眠剝奪組海馬組織中miR-155升高;與1 d REM睡眠剝奪組相比,7 d REM睡眠剝奪組海馬組織中miR-155升高。受部位影響,miR-155在睡眠剝奪中可能在海馬組織中發(fā)揮作用;miR-155表達(dá)升高使機(jī)體免疫功能降低,隨著免疫剝奪時(shí)間的延長(zhǎng),miR-155作用越強(qiáng)免疫功能低下越嚴(yán)重加重機(jī)體損傷。
SOCS1蛋白具有調(diào)節(jié)細(xì)胞因子、阻斷增強(qiáng)細(xì)胞因子作用,與自身免疫、超敏反應(yīng)相關(guān);是負(fù)調(diào)控因子,可抑制多種信號(hào)的傳導(dǎo),可抑制NF-κB[14,15]。NF-κB可促進(jìn)TNF-α、IL-1β及IFN-γ等的生成,這些因子又可反過(guò)來(lái)激活NF-κB信號(hào)通路,反復(fù)促進(jìn)炎癥反應(yīng),進(jìn)一步加重肝細(xì)胞損傷,使免疫性肝損傷加重[16,17]。SOCS1/NF-κB通路中激活SOCS1的表達(dá)可抑制NF-κB磷酸化從而抑制巨噬細(xì)胞M1極化葡聚糖硫酸鈉誘導(dǎo)的結(jié)腸炎[18]。miR-155表達(dá)升高可抑制SOCS1的表達(dá)從而激活NF-κB[19]。金雀異黃素通過(guò)miR-155/SOCS1介導(dǎo)的抑制臍靜脈內(nèi)皮細(xì)胞中NF-κB信號(hào)通路的作用來(lái)保護(hù)ox-LDL誘導(dǎo)的炎癥[20]。miR-155、SOCS1、NF-κB各因子均在免疫功能上發(fā)揮作用,通路可直接調(diào)控免疫相關(guān)因子。與對(duì)照組相比,1、7 d REM睡眠剝奪組海馬組織、前額葉皮質(zhì)區(qū)組織中SOCS1水平降低;7 d REM睡眠剝奪組海馬組織、前額葉皮質(zhì)區(qū)組織中,1 d REM睡眠剝奪組前額葉皮質(zhì)區(qū)組織中NF-κB水平升高。與1 d REM睡眠剝奪組相比,7 d REM睡眠剝奪組海馬組織、前額葉皮質(zhì)區(qū)組織中SOCS1水平降低;NF-κB水平升高。miR-155表達(dá)升高可抑制SOCS1的表達(dá),激活NF-κB水平使免疫因子水平升高,降低免疫功能;且隨著時(shí)間的延長(zhǎng),該影響作用越明顯,從而加重睡眠剝奪。
綜上所述,miR-155表達(dá)升高可抑制SOCS1表達(dá),從而激活NF-κB,使免疫因子水平升高,降低睡眠剝奪后免疫功能,使機(jī)體免疫失衡。但免疫受多條通路的影響,其中miR-155/SOCS1/NF-κB只是其中的一條通路,其他通路也可能對(duì)該通路造成影響,分析通路間的相互作用對(duì)免疫的影響可能使文章說(shuō)服力更強(qiáng)。因此,下一步就miR-155/SOCS1/NF-κB通路的緊密通路做進(jìn)一步研究。
- 中國(guó)免疫學(xué)雜志的其它文章
- PRDXs家族在結(jié)直腸癌中作用機(jī)制的研究進(jìn)展①
- 新冠疫情下動(dòng)物免疫學(xué)直播課的探索與實(shí)踐①
- miR-618靶向SOCS1對(duì)肝癌患者中樹(shù)突狀細(xì)胞表型及功能的調(diào)控機(jī)制
- MALAT1基因rs3200401、rs664589位點(diǎn)多態(tài)性在廣西人群的分布①
- 丙泊酚抑制wnt/β-catenin通路對(duì)宮頸癌HELA細(xì)胞生長(zhǎng)和運(yùn)動(dòng)能力的調(diào)節(jié)作用①
- 蛇床子素對(duì)宮頸癌Hela-S3細(xì)胞活性、凋亡及相關(guān)信號(hào)通路的影響①