核受體輔活化蛋白7與自噬體蛋白LC3的相互作用
汪林翠,林瓊
(江蘇大學醫學院,江蘇 鎮江 212013)
自噬通過自噬體包裹自噬底物并轉運至溶酶體進行降解,從而維持細胞穩態[1-2]。在應激條件下,如饑餓[3]、缺氧[4]、氧化[5]或抗癌藥物治療[6]等,細胞內自噬被激活,以消除應激反應產生的損害[7]。自噬失調與多種疾病的發病機制有關,如神經退行性疾病、代謝紊亂以及癌癥等[8]。
微管相關蛋白輕鏈3(microtubule-associated protein light chain 3,LC3)是自噬體的重要構成蛋白,與其結合是鑒別細胞內自噬調節蛋白的一個重要標準[9]。核受體輔活化蛋白7(nuclear receptor co-activator 7,NCOA7)能輔助激活核受體,可能是一個自噬調節蛋白[10],但它與LC3的相互作用及結合位點仍不清楚。本研究以NCOA7蛋白為研究對象,探討其與自噬蛋白LC3的相互作用及作用位點。
1 材料和方法
1.1 細胞和細胞培養
人腎上皮HEK293細胞,人胃癌AGS細胞,pCDNA3-Myc-NCOA7質粒、表達LC3與谷胱苷肽巰基轉移酶(glutathione-S-transferase,GST)融合蛋白(GST-LC3)的菌液與pGEX-4T-LC3(GST-LC3)質粒均為本實驗室長期保存。HEK293細胞用含10%胎牛血清的DMEM高糖培養液,AGS細胞用含10%胎牛血清的F12K培養液,在37℃、5% CO2培養箱中培養。
1.2 抗體和試劑
鼠抗人Myc標簽抗體與異丙基硫代半乳糖苷(IPTG)均為鎮江新津生物有限公司產品;HRP標記的羊抗鼠二抗(上海生工生物有限公司);限制性核酸內切酶BamHⅠ,EcoRⅠ,SpeⅠ與NotⅠ(日本TaKaRa公司);T4DNA連接酶與DH5α大腸埃希菌感受態均為鎮江ABM生物公司產品;PVDF膜(美國Millipore公司);ECL曝光液(上海碧云天生物技術有限公司);質粒DNA小量抽提試劑盒、膠回收試劑盒與PCR產物純化試劑盒均為上海生工生物有限公司產品;谷胱甘肽(glutathione,GSH)瓊脂凝珠(美國Sigma公司);胎牛血清、DMEM高糖培養液與F12K完全培養液均為美國HyClone公司產品。
1.3 質譜分析胃癌AGS細胞中的LC3結合蛋白
將GST-LC3融合蛋白親和固化在GSH標記的瓊脂凝珠上,獲得GST-LC3瓊脂凝珠,同時用GST瓊脂凝珠作為對照。實驗分為4組:GSH瓊脂凝珠與AGS全細胞裂解液孵育作為空載對照組(GSH+WCL);GST-LC3瓊脂凝珠與哺乳動物細胞裂解液孵育作為緩沖液對照組(GST-LC3+buffer);GST瓊脂凝珠與AGS全細胞裂解液孵育為融合蛋白對照組(GST+WCL);GST-LC3瓊脂凝珠與AGS全細胞裂解液孵育作為實驗組(GST-LC3+WCL);分別孵育3~5 h。用哺乳動物細胞裂解液清洗3遍,100 ℃煮沸10 min,離心取上清液。上清蛋白經SDS-PAGE分離,考馬斯亮藍染色后獲得特異性目的條帶,質譜分析由北京博奧晶典有限公司提供技術支持。
1.4 GST-LC3沉淀實驗檢測NCOA7與LC3間相互作用
在HEK293細胞中轉染pCDNA3-Myc-NCOA7質粒,48 h后提取細胞蛋白;與此同時,純化GST(對照)和GST-LC3細菌融合蛋白。將表達GST與GST-LC3融合蛋白的菌液分別擴增12~16 h,用0.25 mmol/L IPTG誘導其表達3 h。超聲裂解細菌后,12 000 r/min離心15 min,獲得融合蛋白上清液。將GSH標記的瓊脂凝珠分別與GST和GST-LC3融合蛋白上清液共同孵育3~5 h,制備成GST和GST-LC3親和的瓊脂凝珠。將GST和GST-LC3瓊脂凝珠分別與轉染pCDNA3-Myc-NCOA7的細胞蛋白共同孵育3~5 h。用細胞裂解液清洗瓊脂凝珠,去除未結合的細胞蛋白。瓊脂凝珠100 ℃煮沸10 min使蛋白變性,制成樣本,經SDS-PAGE分離。GST與GST-LC3融合蛋白經考馬斯亮藍染色。半干電轉印法將其余蛋白轉移至PVDF膜,1%牛血清白蛋白溶液37 ℃封閉1 h。加1 ∶3 000稀釋的鼠抗人Myc標簽一抗,4 ℃孵育過夜;TBST洗膜3次,10 min/次;加HRP羊抗鼠二抗(1 ∶10 000),37 ℃孵育1 h;TBST洗膜3次,10 min/次;ECL熒光顯色,凝膠成像系統記錄結果。
1.5 分子克隆法構建NCOA7截短體及點突變體
從NCBI網站上查詢NCOA7蛋白結構域的氨基酸序列,利用Chromas軟件分析NCOA7蛋白的二級結構,根據研究目的確定氨基酸截短位點及點突變位點(通常截短位點位于蛋白質二級結構的β-轉角)。用DNA Star軟件中的SeqBuilder程序尋找截短位點或點突變位點對應的堿基位置,以此堿基為起點或終點,根據互補配對原則,設計18~24 bp的引物序列,同時需添加保護堿基和酶切位點。
NCOA7全長包含942個氨基酸,含有3個結構域:細胞溶解酶結構域(lysin motif,LysM)、雌激素受體結合結構域(estrogen receptor binding domain,ERbd)和TBC結構域催化結構域(TBC domain catalytic domain,TLDc)。WXX(L、I、V,W:色氨酸,L:亮氨酸,I:異亮氨酸,V:纈氨酸,X:任意氨基酸)是已知的LC3結合基序(LC3 interactive region,LIR)。NCOA7蛋白中含有3個潛在的LIR,分別為310~313位WEDL、692~695位WFAV和747~750位WEII。構建NCOA7截短體及點突變體克隆,截短體包括ΔN105(106~942 aa)、N106- 460(106~460 aa)、N460(1~460 aa)、C721-942(721~942 aa)、ΔN462(463~942 aa)、ΔN650(650~942 aa)和ΔN650-I749/750A(650~942 aa);點突變體包括L313A(313位亮氨酸突變為丙氨酸)和I749/750A(749和750位異亮氨酸突變為丙氨酸)。NCOA7截短體和點突變體的設計模式圖見圖1。PCR引物由上海捷瑞生物有限公司合成。以pCDNA3-Myc-NCOA7質粒為模板,每個突變體克隆分別用相應上下游引物進行PCR。PCR產物經試劑盒純化后,用相應限制性核酸內切酶雙酶切,同時酶切pCDNA3-Myc載體,膠回收。用T4DNA連接酶將酶切PCR片段與酶切載體相連,構成完整質粒。用DH5α大腸埃希菌感受態進行轉化,將轉化產物涂布于含有氨芐抗性的LB細菌培養板,37 ℃過夜培養。挑取單克隆菌落用氨芐抗性的LB液體培養基擴增,菌液行PCR驗證。驗證正確的菌液提取質粒DNA,由上海生工生物有限公司測序,所用引物序列見表1。
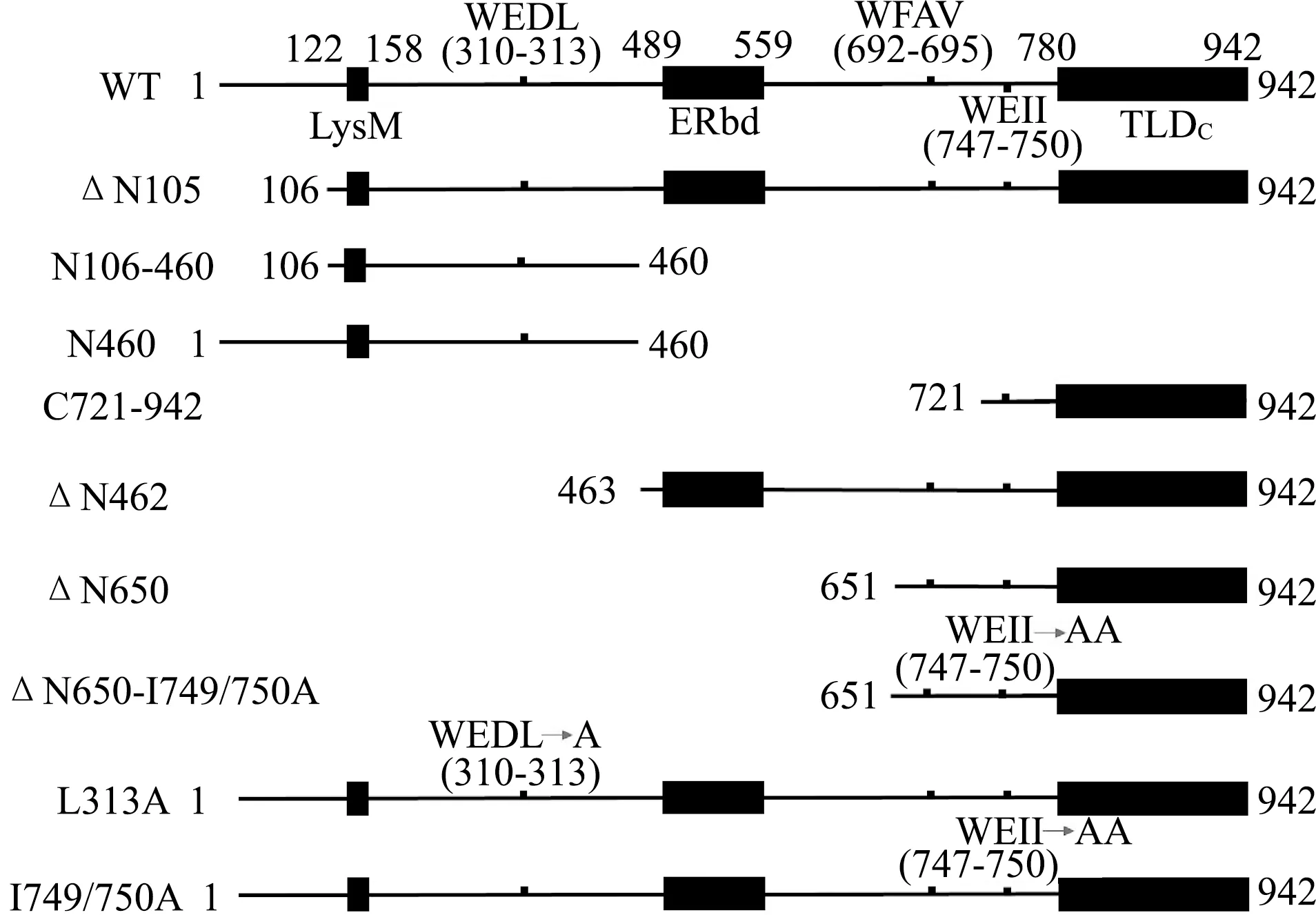
圖1 NCOA7不同截短體及點突變體模式圖

表1 引物序列
1.6 GST-LC3沉淀實驗檢測NCOA7截短體、點突變體及其N端截短體及突變體與LC3間相互作用
1.6.1 GST-LC3沉淀實驗檢測NCOA7截短體及點突變體與LC3間相互作用 利用“1.5”構建的ΔN105,N106-460,N460及C721-942截短體及L313A,I749/750A點突變體質粒轉染HEK293細胞,同時轉染pCDNA3-Myc-NCOA7野生型質粒(WT)作為陽性對照,48 h后收取細胞蛋白。純化GST和GST-LC3細菌融合蛋白(方法同“1.4”)。GST瓊脂凝珠與WT共同孵育(GST+WT)作為陰性對照組,GST-LC3瓊脂凝珠與WT共同孵育作為陽性對照組(GST-LC3+WT)。GST-LC3瓊脂凝珠分別與轉染ΔN105,N106-460,N460,C721-942,L313A,I749/750A的HEK293細胞蛋白孵育作為實驗組。孵育3~5 h,用細胞裂解液清洗GST與GST-LC3瓊脂凝珠,去除未結合的細胞蛋白。后續實驗步驟與“1.4”相同。
1.6.2 GST-LC3沉淀實驗檢測NCOA7 N端截短體與LC3間相互作用 利用“1.5”構建的NCOA7 N端截短體ΔN462、ΔN650、C721-942及ΔN650-I749/750A轉染HEK293細胞,同時轉染pCDNA3-Myc-NCOA7質粒(WT)作為陽性對照,48 h后收取細胞蛋白。用GST-LC3瓊脂凝珠分別與此三者細胞蛋白共同孵育。孵育3~5 h,用細胞裂解液清洗GST-LC3瓊脂凝珠,去除未結合的細胞蛋白。后續實驗步驟與“1.4”相同。
1.7 免疫印跡法檢測NCOA7截短體的蛋白表達水平
將HEK293細胞分為4組,陰性對照組轉染pCDNA3質粒,陽性對照組轉染PCDNA3-Myc-NCOA7質粒,溶酶體抑制劑氯喹處理組和蛋白酶體抑制劑萬科處理組分別轉染NCOA7截短體ΔN462,ΔN650,ΔN650-I749/750A質粒。36 h后,氯喹處理組加入氯喹(50 μmol/L)處理12 h,萬科處理組加入萬科(10 μmol/L)處理12 h。每組均加入哺乳動物細胞裂解液,4 ℃搖床裂解30 min;12 000 r/min,4 ℃離心15 min;取上清液煮沸變性;SDS-PAGE分離蛋白,100 V 2.5 h;半干電轉法將蛋白轉移至PVDF膜,400 mA 2 h;1%牛血清白蛋白溶液37 ℃封閉1 h;4 ℃過夜孵育鼠抗人Myc標簽一抗(1 ∶3 000);次日,TBST清洗3遍;HRP羊抗鼠二抗(1 ∶10 000)孵育2 h;TBST清洗3遍;用化學發光儀進行ECL顯影。
2 結果
2.1 質譜鑒定胃癌AGS細胞中LC3相互作用蛋白
GST-LC3沉淀實驗結果顯示,空載對照組(GSH+WCL)中40 000以上未出現蛋白條帶。緩沖液對照組(GST-LC3+buffer)與融合蛋白對照組(GST+WCL)中出現非特異性蛋白。實驗組(GST-LC3+WCL)與3組對照組相比,在170 000、100 000及約60 000處出現特異性蛋白。對特異蛋白行質譜分析,結果中含NCOA7(質譜結果未顯示)。見圖2。
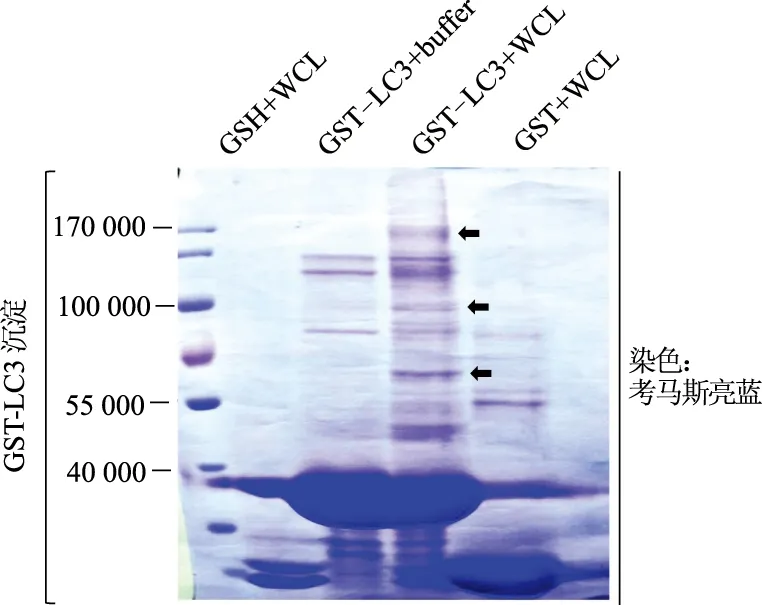
黑色箭頭示特異性蛋白位置圖2 GST-LC3沉淀實驗檢測AGS細胞蛋白
2.2 NCOA7與LC3相互作用
GST-LC3沉淀實驗結果顯示,與GST對照組比較,GST-LC3實驗組從細胞裂解液中沉淀出NCOA7蛋白。考馬斯亮藍染色顯示,GST與GST-LC3融合蛋白表達水平基本一致,見圖3。
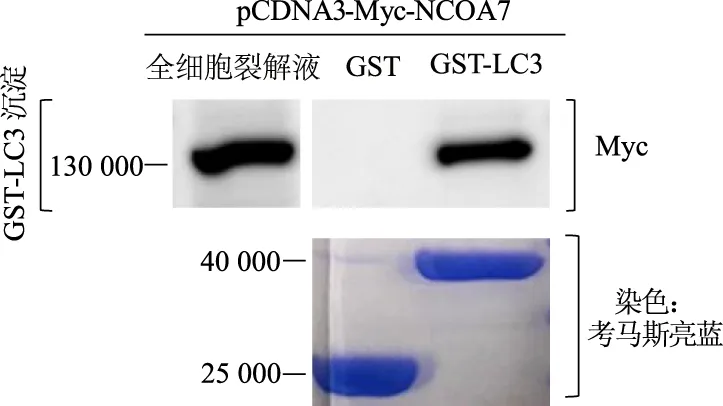
圖3 GST-LC3沉淀實驗檢測NCOA7與LC3相互作用
2.3 NCOA7與LC3相互作用位點位于WEDL基序
GST-LC3沉淀實驗結果顯示,ΔN105、N106-460、N460、C721-942截短體及I749/750A點突變體均能被GST-LC3融合蛋白沉淀,且C721-942蛋白的沉淀程度明顯高于其他突變體。但是,點突變體L313A未被GST-LC3融合蛋白沉淀。在HEK293全細胞裂解液中,截短體及點突變體蛋白表達水平一致。考馬斯亮藍染色結果顯示,樣本中GST與GST-LC3融合蛋白表達水平一致。見圖4。
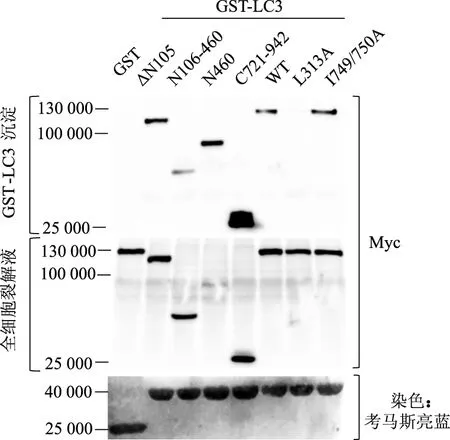
圖4 NCOA7突變體與LC3相互作用
2.4 NCOA7截短體蛋白表達受蛋白酶體抑制
免疫印跡結果顯示,在55 000處對照組與實驗組均出現非特異性背景條帶。氯喹處理組3個截短體質粒ΔN462,ΔN650,ΔN650-I749/750A未有蛋白表達。萬科處理組3個截短體質粒有蛋白表達。見圖5。
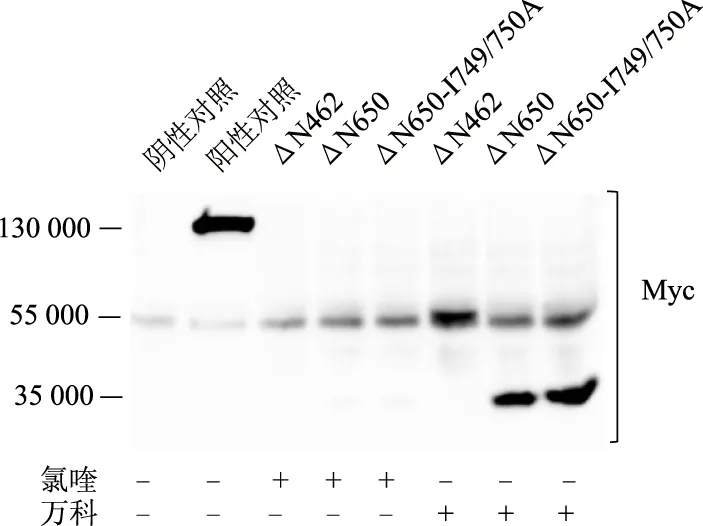
圖5 免疫印跡法檢測截短體的表達水平
2.5 NCOA7蛋白的651~720氨基酸結構抑制其羧基末端LIR
GST-LC3沉淀結果顯示,ΔN462和ΔN650-I749/750A未被GST-LC3沉淀,而ΔN650和C721-942能被GST-LC3沉淀,且C721-942沉淀程度明顯高于ΔN650。考馬斯亮藍染色結果顯示,樣本中GST-LC3融合蛋白表達量基本一致。見圖6。
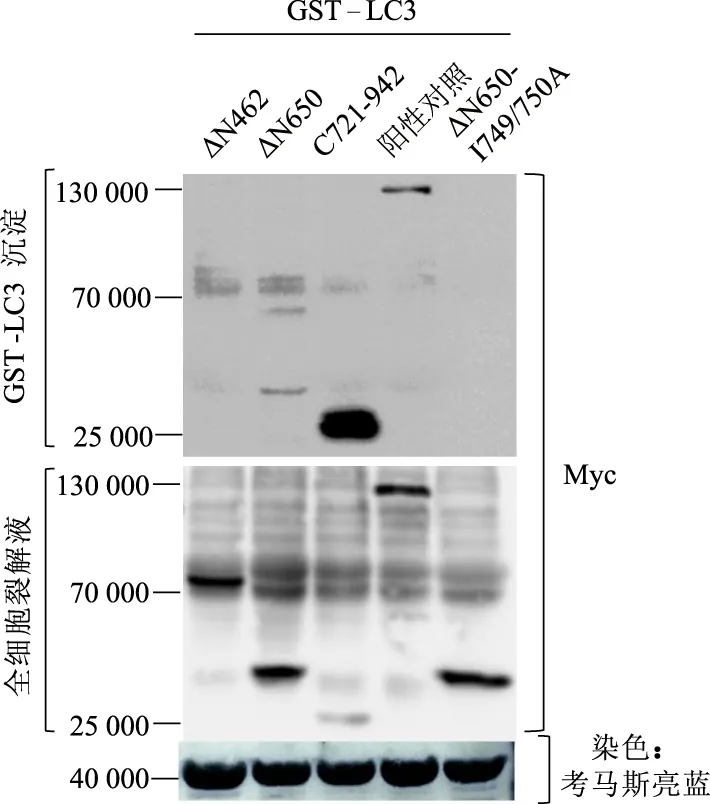
圖6 NCOA7 N端截短體與LC3相互作用情況
3 討論
自噬在腫瘤發生發展中起重要作用,自噬調節蛋白使自噬底物具有特異性[11]。已有研究通過對人類自噬相關蛋白網絡分析,發現NCOA7存在于自噬網絡[10],但并未進行具體分析。以往關于NCOA7蛋白的研究主要集中于其輔助核受體激活的功能[12],而對于其作為自噬相關蛋白的功能并未涉及。本研究主要以HEK293細胞表達為手段,結合GST-LC3沉淀技術檢測NCOA7與自噬體蛋白LC3間的相互作用;結果顯示,NCOA7蛋白被GST-LC3融合蛋白沉淀,表明NCOA7與LC3之間存在相互作用,NCOA7是自噬相關蛋白。
自噬相關蛋白均包含至少一段LIR,通過與LC3相互作用將底物運送至溶酶體中消化降解[13-14]。本研究中NCOA7蛋白包含3段潛在LIR,然而其與LC3結合的基序尚不清楚。NCOA7截短體的GST-LC3沉淀實驗結果顯示,ΔN105,N106-460,N460均被GST-LC3融合蛋白沉淀,此三者均包含310~313位WEDL基序,表明WEDL是NCOA7與LC3結合的位點。C721-942被GST-LC3沉淀,說明其包含的747~750位WEII基序是與LC3結合的位置。此外,為避免截短對蛋白功能的影響,用GST-LC3融合蛋白沉淀點突變體L313A與I749/750A。突變體實驗結果顯示L313A不被沉淀,但I749/750A被沉淀,說明310~313位WEDL基序確實是有功能的LIR,但747~750位WEII基序受分子內結構的調節。
蛋白質的降解途徑主要有兩種,溶酶體途徑和蛋白酶體途徑[15-16]。本研究中,ΔN462,ΔN650與ΔN650-I749/750A截短體質粒構建后,在HEK293細胞中并不表達(結果在文中未給出),故分別用溶酶體抑制劑氯喹或蛋白酶體抑制劑萬科處理。蛋白質免疫印跡法結果顯示,三個截短體蛋白在氯喹處理組中未檢測出,但萬科處理組均檢測出,提示NCOA7截短體可能通過蛋白酶體途徑降解。ΔN462,ΔN650,C721-942與ΔN650-I749/750A截短體的GST-LC3沉淀實驗結果顯示,ΔN462未被沉淀;ΔN650被沉淀但沉淀的蛋白較少,表明其與LC3結合較弱;C721-942被沉淀且沉淀的蛋白較多,表明其與LC3結合較強,說明調節747~750位LIR的結構位于651~720位氨基酸內。ΔN650-I749/750A不能被GST-LC3沉淀,表明692~695位WFAV基序不具有LIR功能。
綜上,本研究結果表明NCOA7的N端WEDL基序和C端WEII基序是LC3的結合位點,但在正常情況下,NCOA7 651~720氨基酸區域內的分子結構抑制其C端WEII基序的功能。由此顯示NCOA7很可能是一個自噬調節蛋白。

