sPD-L1蛋白原核表達、純化及鑒定
魯友銘,吳勝昔,侯力嘉,王桂玲,馬培杰,盧琬薪
(重慶理工大學藥學與生物工程學院,重慶 400054)
程序性死亡因子配體1(programmed death 1 ligand 1,PD-L1),也稱作 CD274、B7-H1,是 B7家族的新成員[1]。它由人9號染色體CD274基因編碼而成的I型跨膜蛋白[2]。PD-L1 mRNA有4種轉錄形式,其主要形式為4.2 kb,編碼290個氨基酸[3]。與其受體PD-1相互作用能夠向T淋巴細胞呈遞負性調控信號,從而導致T淋巴細胞的靜息,促進腫瘤細胞的免疫耐受與免疫逃逸[4]。研究表明PD-L1具有膜型與可溶型兩種存在形式。可溶性程序性死亡因子配體1(sPD-L1)主要是由膜型程序性死亡因子配體1(mPD-L1)解離而成,在人機體內發揮著與mPD-L1一樣的功能與作用[5]。活化的成熟樹突狀細胞是健康人機體產生并釋放sPD-L1的主要來源[6]。除此之外,在惡性腫瘤、系統性紅斑狼瘡、類風濕性關節炎等多種疾病患者血清當中都能檢測到高表達的sPD-L1[7]。有研究表明:晚期胃癌患者血清當中sPD-L1蛋白的高低與其癌癥的分化程度、淋巴結病灶的轉移程度及其預后效果呈正相關[8]。另外,已有學者研究表明:在腎透明細胞癌[9]、乙肝相關性肝癌[10]、非小細胞肺癌[11]等多種實體腫瘤研究中,患者血清當中的sPD-L1數值顯著高于正常人數值。sPD-L1表達量的高低在一定程度上與腫瘤分期、腫瘤體積、淋巴結轉移程度、腫瘤分化等因素相關[12]。所以,血清sPD-L1含量的增加很大程度預示著患者患上述疾病或疾病惡化幾率的增加。目前對于sPD-L1檢測來說,其主要檢測試劑為sPD-L1抗原及其高特異性抗體,然而目前sPD-L1檢測試劑大多數依賴進口,這類產品價格昂貴且質量參差不齊。因此,制備高純度、具有良好生物活性的sPD-L1蛋白并應用于臨床檢測具有重要意義。本論文采用化學合成法合成人PD-L1胞外區基因全長序列,構建重組質粒,并通過基因工程方法表達重組蛋白。為后續開展sPD-L1檢測方法的研究提供有效試劑。
1 材料與方法
1.1 菌株和質粒
大腸桿菌感受態細胞BL21(DE3)由上海唯地生物科技有限公司提供;質粒載體pET30a(+)由重慶理工大學生生物制藥實驗室保存并提供;pET28a(+)-sPD-L1重組質粒、pET28a(+)-sPD-L1/DH5α甘油菌由蘇州金唯智生物科技有限公司合成并提供。
1.2 主要試劑及儀器
卡那霉素(Kanamycin)、IPTG,PMSF購自北京鼎國昌盛生物技術有限公司;質粒提取試劑盒,購自北京博邁德基因技術有限公司;蛋白質分子質量標準購自安諾倫(北京)生物科技有限公司;5×Loading buffer購自上海碧云天生物技術有限公司;HRP-羊抗小鼠IgG購自武漢三鷹生物技術有限公司;Monoclonal anti-HISTag antibody購自美國SIGMA公司;Nco I、Xhol I、10×Q.Cut.G.Buffer購自TAKARA生物技術(北京)有限公司。MULTISKAN GO購自賽默飛世爾科技(中國)有限公司;NGCTMChromatography System、Bio-ScaleTM親和層析Ni柱均購自美國Bio-Rad公司,Amersham Imager 600超靈敏多功能成像儀購自美國GE公司。
1.3 序列分析、合成
根據GenBank發布的人源PD-L1基因序列(GenBank登錄號:AY254342.1),對序列分析后進行大腸桿菌密碼子偏好性優化,使其適合于大腸桿菌表達系統,質粒載體選擇pET28a(+),并交由蘇州金唯智生物科技有限公司合成并構建。
1.4 pET28a(+)-sPD-L1重組質粒載體的酶切鑒定
使用接種環蘸取含有pET28a(+)-sPD-L1重組質粒的DH5α甘油菌,在含有卡那霉素抗性LB平板上劃線接菌,置于37℃恒溫培養箱進行過夜培養。次日于平板上蘸取大而飽滿的單菌落,接種于含有卡那霉素抗性的5 mL LB液體培養基中,置于37℃,180 r/min恒溫搖床中培養12~16 h,至OD600值達到0.6~0.8,利用質粒小量提取試劑盒進行重組質粒的提取。將提取出的質粒利用Nco I、Xhol I限制性核酸內切酶進行雙酶切。雙酶切體系如表1所示。

表1 雙酶切體系
37℃水浴條件下酶切1 h,之后進行瓊脂糖凝膠電泳對酶切產物進行鑒定。
1.5 重組載體的轉化以及轉化子的保菌工作
將重組質粒pET28a(+)-sPD-L1通過熱激法導入大腸桿菌BL21(DE3)感受態細胞中,具體操作步驟參考文獻[13]。將轉化后的 pET28a(+)-sPDL1/BL21(DE3)進行菌種保藏,具體操作如下:挑取過夜培養平板中大而飽滿的單菌落,接種至5 mL卡那霉素抗性LB試管中,37℃,180 r/min恒溫搖床培養,待菌液OD600值達到0.8時,吸取500μL菌液與500μL的40%滅菌甘油于1.5 mL EP管中,置于-80℃超低溫冰箱中進行保藏。
1.6 p ET28a(+)-sPD-L1重組蛋白的表達與鑒定
從-80℃超低溫冰箱中取出pET28a(+)-sPDL1/BL21(DE3)菌液,通過平板劃線使其在具有卡那霉素抗性的LB平板中長出單菌落。挑取單菌落于5 mL卡那抗性LB液體培養基中,當菌液OD600值達到0.8時,加入適量的IPTG,于37℃誘導數小時,然后取誘導之后的菌液進行離心,取上清以及沉淀進行SDS-PAGE電泳的鑒定。空載體對照[pET30a(+)-BL21(DE3)]按照同樣的條件進行處理。
1.7 p ET28a(+)-sPD-L1重組蛋白的誘導表達條件篩選
將pET28a(+)-sPD-L1質粒轉化入大腸桿菌BL21(DE3)感受態細胞中,挑取單菌落接種于5 mL抗性試管中,37℃恒溫搖床培養至菌液OD600值達到0.8。將各培養管按IPTG濃度梯度(0.1、0.5、1 mmol/L)、溫度梯度(16、25、37℃)以及時間梯度(6、9、12 h)進行誘導篩選。利用SDSPAGE電泳對樣品進行鑒定從而分析其最佳誘導條件。
1.8 p ET28a(+)-sPD-L1蛋白的大量表達及純化
將5 mL試管中的菌液吸取2 mL于200 mL含有卡那霉素抗性的LB液體培養基中,按照篩選好的條件,將重組蛋白進行大量誘導表達。
1.8.1 重組蛋白 pET28a(+)-sPD-L1包涵體的收集與溶解
pET28a(+)-sPD-L1/BL21(DE3)菌株經過誘導表達后,對菌液進行低溫離心。棄去上清液(LB液體培養基),對菌體沉淀進行稱重;然后以1×PBS:菌體濕重=35∶1的比例加入1×PBS洗滌液,洗滌菌體細胞,10 000 r/min離心10 min;再用1×PBS重復洗滌一次。離心后留菌體沉淀。
利用緩沖液 A(50 mM Tris-HCl[pH8.5],100 mM NaCl,1%Triton X-100)對菌體沉淀進行重懸,加入0.2 mg/mL的溶菌酶,置于37℃搖床緩慢反應20min,加入1%PMSF超聲破碎。13 000 r/min離心10 min,棄上清,收集包涵體沉淀。
分別用緩沖液 B(50Mm Tris-Hcl[pH8.5],100mM NaCl,1%Triton X-100,2M Urea),緩沖液 C(50Mm Tris-HCl[pH8.5],100mM NaCl,1%Triton X-100),緩沖液 D(50Mm Tris-Hcl[pH8.5],100mM Nacl,1%Triton X-100,2M鹽酸胍)超聲清洗包涵體沉淀。13 000 r/min離心10 min收集沉淀。
用緩沖液 E(50Mm Tris-HCl[pH8.5],100mM NaCl,10mM DTT,2Mm脫氧膽酸鈉,8M Urea)溶解包涵體,緩慢溶解過夜,次日將溶解產物進行離心,13 000 r/min離心10 min。取上清即為包涵體粗提液。
1.8.2 重組蛋白包涵體的純化
用Bio-Rad公司的NGCTMChromatography System對pET28a(+)-sPD-L1重組蛋白包涵體進行親和層析純化。其詳細操作步驟見文獻[14]。
1.9 重組蛋白 pET28a(+)-sPD-L1的 Western blot鑒定
將純化后的目的蛋白pET28a(+)-sPD-L1進行SDS-PAGE電泳,然后將目的條帶利用濕轉法轉移至PVDF膜上,以5%的脫脂奶粉進行封閉;以Monoclonal anti-HISTag antibody為一抗(1∶4 000),4℃孵育過夜,第2天于水平搖床孵育2 h。將PVDF膜放入TBST中清洗3次,每次10 min。以羊抗鼠IgG-HRP為二抗(1∶4 000)37℃水平搖床孵育1 h,再將PVDF膜放入TBST洗3次,每次10 min,加入顯色液(A液 +B液)孵育5 min,最后用Amersham Imager 600超靈敏多功能成像儀進行化學發光成影。
1.10 重組蛋白 pET28a(+)-sPD-L1濃度測定
按照鼎國昌盛BCA蛋白濃度測定試劑盒使用說明測定 sPD-L1重組蛋白濃度,具體操作如下:
步驟1 配制BSA標準品溶液:將BSA標準品分別稀釋至 0.8、0.6、0.4、0.2、0.1、0 mg/mL,每個稀釋度配制20μL;
步驟2 將標準溶液按照濃度從大到小依次加入96孔板中,每孔加入10μL,并加入待測樣本原液,每孔10μL,每組做3個平行孔;
步驟3 按照試劑A∶試劑B=50∶1的比列配制適量工作液,每孔加入200μL工作液,置于37℃培養箱中孵育30 min;
步驟4 用酶標儀測定 OD562,繪制標準曲線以計算純化后的重組蛋白濃度。
1.11 重組蛋白 pET28a(+)-sPD-L1的透析以及間接ELISA鑒定
將純化后的重組蛋白pET28a(+)-sPD-L1裝入34MM透析袋(MW:3500)。將透析袋放入1×PBS中4℃透析24 h,重新將透析袋放入新配置的1×PBS中4℃繼續透析24 h,以除去重組蛋白混合液中的高濃度尿素以及咪唑,為后續小鼠的安全免疫提供保障。將透析后的重組蛋白以2μg/mL包被進行間接 ELISA鑒定,以標準的Monoclonal anti-PD-L1 antibody作為一抗(一抗的稀釋度為1∶1 000~1∶32 768 000),以羊抗鼠 IgGHRP為二抗(1∶4 000),詳細操作步驟見文獻[13]。
2 實驗結果
2.1 酶切結果
將重組質粒 pET28a(+)-sPD-L1進行雙酶切(Nco I與Xhol I限制性內切酶)鑒定。結果顯示于668 bp處有一條特異性的條帶,如圖1所示。鑒定結果與預期結果相符,證明重組質粒pET28a(+)-sPD-L1構建成功。
2.2 重組蛋白 p ET28a(+)-sPD-L1的誘導表達鑒定
將經 sPD-L1-pET-28a(+)和 pET30a(+)轉化的重組菌株在相同誘導溫度、相同IPTG劑量、相同誘導時間進行誘導表達,取誘導表達后的菌液與5×Loading Buffer混勻,煮樣10 min。然后進行SDS-PAGE電泳檢測,結果如圖2所示。結果表明:sPD-L1-pET-28a(+)/BL21(DE3)實驗組在25-35KD處有大量的目的蛋白條帶出現,而空白對照組pET-30a(+)/BL21(DE3)無明顯條帶。
2.3 重組蛋白pET28a(+)-sPD-L1的最佳誘導條件的篩選
設置了誘導溫度、IPTG濃度及時間3個影響因素對重組蛋白pET28a(+)-sPD-L1進行最佳誘導條件的優化。探索出其最佳誘導條件為:37℃,0.5 mmol/L IPTG,9 h。
1)設置IPTG的濃度為1 mmol/L,誘導時間為6 h,分別設置16℃、25℃、37℃3組溫度變量,所得菌液經過SDS-PAGE電泳,結果如圖3所示。3組溫度變量表達量相當,但為了利于重組蛋白形成包涵體,所以選擇37℃為最佳誘導溫度。
2)在37℃條件下,設置了不同的IPTG濃度進行相同時間誘導,所得菌液經過SDS-PAGE電泳分析,結果如圖4所示。結果表明:重組蛋白在37℃,IPTG誘導濃度分別為 0.5 mmol/L與1 mmol/L時,蛋白表達量相當,但是高濃度IPTG對細胞有毒副作用,所以最佳IPTG濃度為0.5 mmol/L。
在37℃條件下,IPTG誘導濃度為0.5 mmol/L,設置了不同的誘導時間,所得菌液經過SDSPAGE電泳分析,結果如圖5所示。結果顯示重組蛋白的最佳誘導時間為9 h。
2.4 重組蛋白 p ET28a(+)-sPD-L1的純化以及SDS-PAGE鑒定
采用鎳柱親和層析的方法對經過8M Urea變性后的目的蛋白進行純化,采用不同濃度的咪唑(50、100、200、400、500 mM)對目的蛋白進行梯度洗脫,收集280 nm紫外吸收峰的洗脫液。結果顯示:200 mmol/L咪唑可以將目的蛋白全部洗脫下來。如圖6所示。
將純化后的目的蛋白經SDS-PAGE電泳鑒定,結果如圖7所示。
2.5 重組蛋白 pET28a(+)-sPD-L1的 Western blot鑒定
Western blot結果顯示:實驗組在28 KD左右有一條明顯的蛋白印跡出現(見圖8)。而空載體對照組則無條帶,結果表明重組蛋白pET28a(+)-sPD-L1純化成功。
2.6 重組蛋白 pET28a(+)-sPD-L1濃度測定
采用BCA法測定sPD-L1重組蛋白濃度,測定結果如表2所示,利用一元線性回歸方程,得出其回歸方程為:y=0.000 3x-3E-05,R2=0.999 5,表明線性關系良好,可用于重組蛋白pET28a(+)-sPD-L1濃度測定。
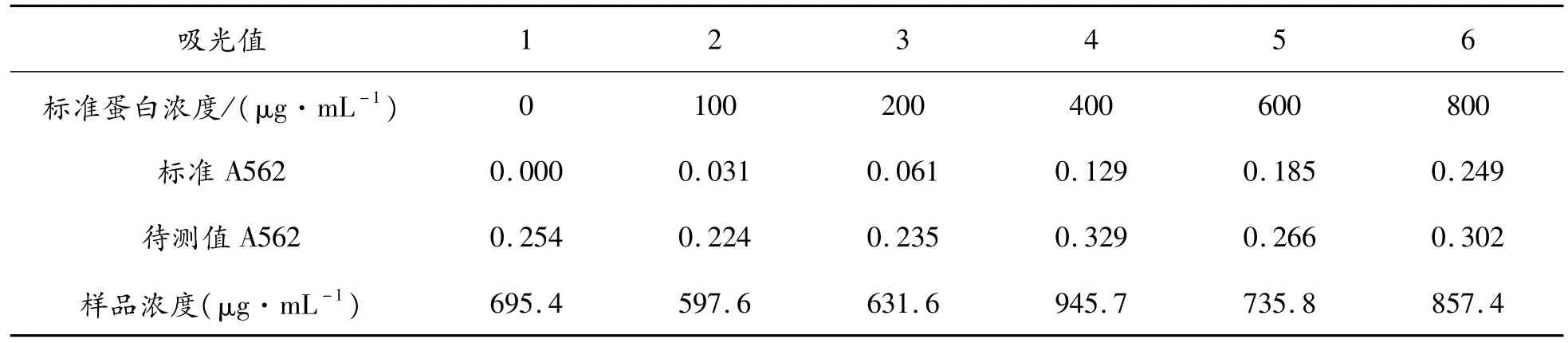
表 2 pET28a(+)-sPD-L1濃度測定結果
由標準蛋白濃度與標準A562制得BCA蛋白標準曲線如圖9所示。
將待測樣品OD562代入方程,即可得出樣品蛋白濃度,見表2。
2.7 重組蛋白 p ET28a(+)-sPD-L1的透析以及ELISA鑒定
將純化后的重組蛋白pET28a(+)-sPD-L1按照上述操作步驟進行透析。將透析之后的重組蛋白以2μg/mL包被進行間接ELISA鑒定,以標準的Monoclonal anti-PD-L1 antibody作為一抗,以羊抗鼠IgG-HRP為二抗。ELISA結果顯示:隨著標準的Monoclonal anti-PD-L1 antibody濃度的增加,其OD450讀數的平均值也隨之上升。當抗體濃度達到62.5 ng/mL時,純化后的重組蛋白與標準抗體反應趨于飽和。實驗結果如圖10所示。
3 結論
1)由于人源sPD-L1蛋白在人體內的含量很低,無法通過體外提取直接獲得,而化學合成法直接合成sPD-L1蛋白的成本太高,且質量無法得到保障,本次實驗通過原核表達系統大量表達以及純化人源sPD-L1,并將其運用于癌癥相關領域的各項檢測中,具有重要的實用價值與研究意義。
2)選擇 pET28a(+)作為表達載體,因其具有高拷貝、胞內表達等一系列優點,同時在sPD-L1全長序列兩端各加了一組His6 Tag。經過實驗證明:兩組His6 Tag在很大程度上提高了蛋白純化效率且對目的蛋白的免疫原性未造成影響。將純化后的目的蛋白包涵體進行透析脫鹽處理,然后進行Western blot以及間接ELISA鑒定。鑒定結果顯示:通過原核表達系統表達的重組蛋白pET28a(+)-sPD-L1能夠與標準的小鼠 Monoclonal anti-PD-L1 antibody發生強烈的反應,說明其具有相同的免疫原性,可用于Balb/c小鼠的免疫,以制備鼠抗人sPD-L1高特異性單克隆抗體。
3)獲取了具有良好生物活性且純度較高的重組sPD-L1蛋白,為后續鼠抗人sPD-L1單克隆抗體的制備以及sPD-L1檢測方法的研究提供了良好的試劑。

