磁共振DKI成像預測直腸癌TN分期、分化和脈管侵犯的應用價值
段書峰, 郁曉路, 馮 峰*
1.南通市腫瘤醫院影像科,南通 226001 2.海軍軍醫大學護理系,上海 200433
2018年全球癌癥統計報告[1]顯示,結直腸癌的發病率及死亡率位于第三位及第二位,男性發病率高于女性,發達國家的發病率高于不發達國家。2015中國癌癥統計數據[2]顯示:中國結直腸癌的發病率及死亡率在所有惡性腫瘤中均為第五位,大部分人發現時已是中晚期。隨著當今社會發展,我國結直腸癌的發病率呈持續上升態勢,年輕群體的發病率也逐年提高[3]。直腸癌的治療方案需要綜合臨床病理及預后等多種因素,其中最重要的指標包括腫瘤的TN分期[4]、周圍脈管侵犯情況[5]、病理分化程度[6]及年齡是否大于70歲等[7]。
近年來,MRI被越來越多地應用于直腸癌患者的檢查,其中功能性MRI成像能間接反映活體組織生物學行為,有助于腫瘤的療效評價及預后。磁共振擴散峰度成像(diffusion kurtosis imaging, DKI)是基于擴散張量成像(diffusion tensor imaging, DTI)技術進一步拓展而來的。近年來DKI技術在腦卒中、腦膠質瘤、帕金森綜合征等腦部疾病及肝臟疾病、子宮內膜癌、鼻咽癌、前列腺癌等診斷方面取得了初步效果[8-12],但在直腸癌方面的應用較少,因此本研究主要探討磁共振DKI成像在直腸癌術前診斷中的應用價值。
1 資料與方法
1.1 一般資料 選取2017年11月至2019年11月南通市腫瘤醫院收治的43例直腸癌患者,收集患者的病理及臨床資料,其中男性34例,女性9例。納入標準:(1)術前均經消化道內鏡活檢病理證實;(2)患者無遠處轉移,可行手術治療;(3)術前常規行盆腔MRI平掃、動態增強掃描及多b值DWI掃描,且圖像可滿足診斷要求;(4)行手術切除并行病理檢查。排除標準:(1)術后證實病理為黏液腺癌及其他非腺癌患者;(2)術前進行過新輔助放化療的患者;(3)術后病理未進行分化程度描述;(4)圖像質量不佳,不能用于診斷。本研究經南通市腫瘤醫院倫理委員會審核批準(通腫倫審2019-026),所有患者均知情并簽署知情同意書。
1.2 MR機器選擇、掃描方法及參數 所有受試者均采用3.0 T磁共振掃描儀(Siemens VERIO;西門子公司,德國),4通道相控陣體線圈。掃描中心位于恥骨聯合上2 cm處,術前禁食6 h,訓練患者呼吸氣,以減少盆腔臟器移動偽影。
常規MRI掃描,定位于矢狀面,TSE T2WI:TR 4 440 ms,TE 107 ms,層厚3 mm,間隔0.6 mm,FOV 180 mm×180 mm,矩陣384×180,激勵次數4;橫軸面TSE T2WI:TR 2 100 ms,TE 64 ms,層厚3 mm,間隔0.6 mm,FOV 180 mm×160 mm,矩陣384×320,激勵次數4;冠狀位TSE T2WI:TR 3 500 ms,TE 103 ms,層厚3 mm,間隔0.6 mm,FOV 180 mm×180 mm,矩陣320×180,激勵次數4。
多b值DWI檢查采用單次激發平面回波(SS EPI)序列軸面成像,掃描參數:TR 5 000 ms,TE 78 ms,層厚5 mm,間隔1 mm,FOV 380 mm×180 mm,矩陣192×120,DKI b值取0、500、1 000、1 500、2 000、2 500 s/mm2,激勵次數1~4次。病灶MR連續增強掃描層面垂直于病灶長軸,增強掃描T1-vibe序列:TR 3.41 ms,TE 1.3 ms,層厚3 mm,間距0.6 mm,FOV 380 mm×210 mm,矩陣320×224,激勵次數1。
1.3 術后病理及臨床數據統計 術后標本由具有10年臨床工作經驗的病理診斷醫師進行取材及分析。病理指標主要包括腫瘤TN分期、腫瘤分化程度、周圍脈管侵犯及淋巴結轉移情況。
依據2017版結直腸癌診療規范[2],腫瘤T分期分為4期,腫瘤N分期分為3期。根據WHO 2010版結直腸癌組織學分級標準[13],依照顯微鏡下腫瘤的腺樣結構的多少及腺管形態特征分為3級。
周圍脈管侵犯的判定標準:顯微鏡下送檢組織的小動、靜脈或淋巴管的管壁受到腫瘤細胞浸潤及破壞,或直接發現管腔內瘤栓。
1.4 圖像分析與數據采集 所有常規MRI圖像均由2名具有10年影像診斷經驗的醫師獨立進行TNM分期,且閱片者均不知曉患者的病理結果。當出現較大分歧時,經共同討論得出結果。另將患者的DKI序列圖像導入DKE軟件進行數據處理分析。ROI選取方式遵循以下原則:選取腫瘤最大層面且面積盡量大,參考T2WI平掃高清掃描圖像及彌散圖像,選取實性成分最明顯區域,同時避開出血、壞死、囊變及其內大血管組織(圖1A)。選取合適的感興趣區域(region of interest, ROI),所有ROI均為人工繪制。對同一患者在不同時間測量3次,取其平均值。通過軟件計算DKI參數值,包括MD值和MK值(圖1B、1C)。

圖1 典型病例的MRI特征

2 結 果
2.1 一般資料分析 共43例患者納入本研究,其中男性34例,女性9例,年齡50~85歲。T1期4例、T2期8例、T3期13例、T4期18例;N0期26例、N1期10例、N2期7例;高分化腺癌(Ⅰ級)5例,中分化腺癌(Ⅱ級)31例、低分化腺癌(Ⅲ級)7例;根據腫瘤是否突破肌層,分為早期組(T1+T2)12例,晚期組(T3+T4)31例;有脈管侵犯者11例,無脈管侵犯32例。
2.2 磁共振DKI各參數在腫瘤T分期間比較
2.2.1 不同T分期患者各參數比較 結果(表1)顯示:MK在各組患者間差異均有統計學意義(P<0.05)。MD值在各組間差異無統計學意義。
2.2.2 T1+T2與T3+T4分期患者各參數比較 結果(表2)表明:MK值在兩組間差異有統計學意義(P<0.001),MD值差異無統計學意義。
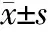
表1 不同T分期患者各參數比較
*P<0.05與T1期相比;△P<0.05與T2期相比
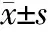
表2 T1+T2與T3+T4分期患者各參數比較
2.2.3 MK值對T分期的ROC曲線 結果(圖2)表明:MK值在診斷T分期的AUC為0.849,且MK診斷T分期的閾值為0.564時,靈敏度為83.9%、特異度為83.3%。

圖2 MK值對T分期的ROC曲線分析
2.3 磁共振DKI各參數在病理分級間比較 不同病理分級患者MK、MD經單因素方差分析結果(表3)顯示,各組患者間差異均有統計學意義(P<0.05)。
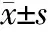
表3 不同病理分級患者各參數比較
2.4 DKI參數在有無脈管侵犯患者間比較
2.4.1 有無脈管侵犯患者間各參數比較 結果(表4)顯示:有脈管侵犯患者MK值明顯高于無脈管侵犯患者,差異有統計學意義(P<0.05)。MD值組間差異無統計學意義。

表4 有無脈管侵犯患者各參數比較
2.4.2 MK值對脈管侵犯的ROC曲線 結果(圖3)表明:MK值對脈管侵犯的ROC曲線的AUC為0.810,診斷脈管侵犯的閾值為0.772時,靈敏度為81.8%,特異度為68.7%。

圖3 MK對脈管侵犯的ROC曲線
2.5 DKI參數在直腸癌有無淋巴結轉移患者間比較 結果(表5)顯示:有淋巴結轉移的患者MK高于無淋巴結轉移患者,有淋巴結轉移患者MD低于無淋巴結轉移患者,差異有統計學意義(P<0.05)。

表5 有無淋巴結轉移患者間各參數比較
結果(圖4)表明:MK+MD聯合診斷淋巴結轉移的價值最高。MK+MD診斷淋巴結轉移的閾值對應的靈敏度為82.4%、特異度為76.9%。

圖4 不同參數對淋巴結轉移的ROC曲線
3 討 論
術前直腸癌準確的分期及分級對臨床治療方案選擇及患者預后具有重要指導意義。DKI采用的非高斯分布模型,能更好地反映高b值下組織內水分子的實際擴散分布情況,體現水分子擴散的受限程度及不均質性,從而更好地反映組織內部復雜的微觀結構。謝輝等[14]分別采用DKI和DWI定量參數評估直腸癌組織學特性,經比較發現,DKI能反映直腸癌組織結構的復雜性,其定量參數MD和MK比DWI的定量參數ADC對直腸癌組織結構的復雜性更敏感。然而DKI對直腸癌病理分期的診斷價值尚未得到臨床驗證,還需要結合病理基礎開展更進一步的研究。另外,胡飛翔等[15]在一項研究中對DKI和DWI成像預測及評價直腸癌新輔助放化療后病理完全緩解(pCR)的應用價值進行比較發現,DKI的MK參數特異度高于DWI,提示DKI可用于直腸癌患者在新輔助放化療的療效評價。本研究主要觀察DKI在直腸腺癌中的應用價值。
3.1 DKI各參數在直腸癌術前T分期中比較 本研究顯示,MK值在直腸癌各T分期的差異具有統計學意義,這與張玉娟等[16]的研究結果類似,表明MK值可作為潛在的生物學指標應用于直腸癌術前分期中。究其原因,隨著直腸癌T分期的增加,腫瘤病灶相對更大,腫瘤微血管組織等結構更復雜,細胞內密度更緊密,腫瘤向外浸潤程度更深,瘤內可出現壞死囊變導致密度更加不均勻,其內微觀結構更復雜。因此,中晚期直腸癌的腫瘤組織顯微結構較早期更為復雜和不均勻。組織的微觀結構越復雜,水分子偏離高斯分布越明顯,MK值越高。所以臨床上對早中期(T1+T2)患者多采用全直腸系膜切除術(total mesorectal excision, TME),對于局部晚期(T3+T4)患者一般先行新輔助化療,然后再行手術。本研究發現,T3+T4組的MK值高于T1+T2組,具有統計學意義。表明當臨床僅憑高分辨MRI對T1+T2及T3+T4分期患者鑒別困難時,MK值有一定的提示意義。本研究尚顯示MD值在T分期各組之間差異無統計學意義。這是因為理論上隨著T分期增加,病灶體積更大,惡性程度更高,細胞更密集,MD值會降低;但實際上隨著病灶增大,病灶內常出現壞死、出血及囊性變,進而導致MD值升高。這種病理變化過程導致MD值診斷價值有限。
3.2 DKI參數在病理分級之間的比較 直腸癌的預后與腫瘤分化程度密切相關[17],因此,術前評估腫瘤的分化程度在選擇治療方案及評估預后中有重要作用。有研究[18]表明,應用DKI進行腫瘤分化程度的研究具有可操作性,認為DKI可用來評價組織內部微觀結構的復雜性。本研究顯示MK與病理分級正相關,MD與病理分級負相關。直腸癌低分化的病理特征主要表現為周圍組織解剖結構的浸潤,細胞的增多、壞死、出血、內皮細胞增殖;其分化強度越低,腫瘤細胞所形成的腺體樣結構越多,異型性越明顯,腫瘤的異質性就越大。而高分化腫瘤病理學特征表現為腫瘤密度更均勻,細胞密度更低。所以低分化直腸癌比高分化直腸癌的腫瘤微環境更加復雜;腫瘤組織內部微環境越復雜,水分子擴散受限的程度就越嚴重,MD值就越低;同時水分子發生非高斯運動的情況更多,偏離高斯運動的程度可能越大,MK值越高[19]。
3.3 DKI參數在有無脈管侵犯之間的比較 直腸脈管有無侵犯是直腸癌患者的重要預后因素[20-21]。有脈管侵犯的患者,說明腫瘤已經發生轉移。有研究[20-21]表明,有脈管內癌栓的直腸癌患者生存率明顯低于無脈管癌栓患者。本研究顯示,脈管有侵犯的情況下腫瘤病灶MK值更大,差異有統計學意義,這與王錦錦等[22]研究結果類似。使用ROC曲線分析,MK診斷脈管侵犯的閾值為0.772,此時對應的靈敏度為81.8%、特異度為68.7%。MK值主要反映組織的復雜性,有脈管侵犯的患者惡性程度更高,分化程度可能更低;腫瘤內部出現大量不成熟新生血管,細胞體積更大、形態多樣,細胞排列更緊密,內部結構更復雜,腫瘤內異質性更明顯,MK值就越高。MD參數無明顯差異,可能由于本研究入組有脈管侵犯的病例較少,導致統計結果誤差較大,有待后續較大樣本量的進一步研究。
3.4 DKI參數對是否有淋巴結轉移的直腸癌的分析 實際工作中淋巴結轉移的診斷準確率較低,常規磁共振有時難以區分炎性增生淋巴結及轉移性淋巴結。有時即使MRI結果陰性,卻不能排除淋巴結內的微轉移[23]。本研究結果表明有淋巴結轉移的直腸癌患者,MK值更高,MD值更低,其差異有統計學意義,此研究結果與Yamada等[11]及Yu等[24]類似,ROC曲線分析顯示MK、MD聯合使用時擁有最大的曲線下面積,診斷效能高,這表明有淋巴結轉移直腸癌患者的病灶內水分子彌散受限程度及內部異質性較無淋巴結轉移者更明顯。一種可能的解釋是,與侵襲性較弱的直腸腫瘤相比,侵襲性較強的直腸腫瘤(有淋巴結轉移)的細胞大小和形狀有著更明顯的差異。在侵襲性較強的腫瘤組織中,細胞數量的增加通常會導致組織內屏障增多,擾亂細胞內外的正常平衡,從而限制了水的擴散,細胞內的微結構更復雜,更不均勻。本研究通過直接測量直腸癌病灶生物學特性間接反映淋巴結轉移情況。
本研究存在一定局限性:病例數較少;b值選取不同及測量者之間有差異;采用單層ROI勾畫而非腫瘤全體積參數分析,不能充分反映腫瘤的異質性而出現偏倚現象。
綜上所述,DKI參數MK值可輔助診斷直腸癌T分期。MK值、MD與病理分級分別呈正、負相關性,可預測直腸癌病理分化程度。DKI參數MK值可用來預測直腸癌周圍脈管是否有侵犯。DKI參數MK、MD值可輔助診斷直腸癌是否發生淋巴結轉移,MK、MD聯合時具有更好的診斷效能。

