礦山含銅酸性廢水硫化沉淀過程中硫化氫產(chǎn)生量的控制
藍碧波,熊明瑜,黃懷國,江 城,張玲文,羅增鑫
(紫金礦業(yè)集團股份有限公司,福建 上杭 361008)
金屬礦山廢水的pH較低,還含有銅、鐵和鋅等伴生重金屬離子,如不經(jīng)處理直接排放會產(chǎn)生嚴重的環(huán)境污染[1]。目前國內(nèi)外常用的金屬礦山廢水處理方法主要有中和法、硫化沉淀法、離子交換法、膜處理法和生物法等[2-3]。其中,硫化沉淀法具有沉淀率高、反應(yīng)速率快、沉淀物穩(wěn)定等優(yōu)點,廣泛應(yīng)用于礦山和有色金屬工業(yè)酸性廢水處理[4-7]。莊明龍[4]采用硫化鈉硫化沉淀處理某礦山酸性廢水,銅沉淀率達99.96%,鐵沉淀率為7.92%,達到了銅鐵分離的目的。陳明等[7]對某金屬礦山酸性廢水進行硫化沉淀和高濃度調(diào)漿處理,實現(xiàn)了銅的有效回收,處理后廢水可達標排放。目前,關(guān)于金屬礦山廢水硫化沉淀的研究主要集中在工藝參數(shù)優(yōu)化及硫化沉淀與石灰中和相結(jié)合等方面,而對硫化沉淀的反應(yīng)機理和硫化氫氣體產(chǎn)生過程的研究較少。在硫化沉淀過程中,要嚴格控制硫化氫氣體的產(chǎn)生量。目前,相關(guān)的研究都集中在硫化氫氣體的處理上[8-10],而針對如何控制硫化氫氣體產(chǎn)生量的研究較少。
本工作對含銅酸性廢水硫化沉淀的過程進行了理論分析,提出了控制硫化氫氣體產(chǎn)生量的措施,并針對某礦山含銅酸性廢水開展了驗證實驗。
1 實驗部分
1.1 試劑和儀器
硫氫化鈉:分析純,配制成硫氫化鈉質(zhì)量分數(shù)為22.39%的溶液;硫酸鐵、濃硫酸(質(zhì)量分數(shù)98%):分析純。
JJ-3型恒溫電動攪拌器:常州市金壇友聯(lián)儀器;PHSJ-3F型pH計:上海雷磁儀器有限公司;HI8424型氧化-還原電位計:哈納公司。
實驗用廢水為某礦山含銅酸性廢水,主要成分見表1。
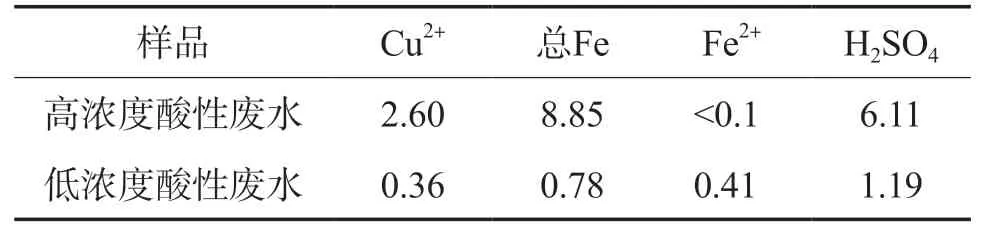
表1 某礦山含銅酸性廢水的主要成分 ρ/(g·L-1)
1.2 實驗方法
1.2.1 硫化沉淀終點電位實驗
實驗在通風櫥中進行,實驗裝置見圖1。取1 L高濃度酸性廢水加入四口燒瓶中,緩慢攪拌,慢慢加入硫氫化鈉溶液,采用氧化還原電位計實時監(jiān)測溶液的電位。通過控制硫氫化鈉溶液的添加量,分別進行反應(yīng)終點電位200,0,-100,-150,-200,-250,-300,-350 mV的硫化沉淀實驗。反應(yīng)結(jié)束后,過濾,分析濾液中的Cu2+和總Fe質(zhì)量濃度,計算Cu沉淀率和Fe沉淀率。
1.2.2 硫化氫氣體產(chǎn)生量的測定
取1 L酸性廢水加入四口燒瓶中,緩慢攪拌,攪拌槳用汞封攪拌器導管水封,緩慢加入一定量的硫氫化鈉溶液,采用氧化還原電位計實時監(jiān)測溶液的電位。產(chǎn)生的硫化氫氣體通過導管引入到裝有NaOH溶液(質(zhì)量分數(shù)10%)的燒瓶中。溶液電位達到目標電位后,攪拌反應(yīng)30 min。實驗結(jié)束后,通過化學分析測定NaOH溶液中的S2-質(zhì)量濃度,計算反應(yīng)過程產(chǎn)生的硫化氫氣體的量以及與酸反應(yīng)的硫氫化鈉的比例(與酸反應(yīng)的硫氫化鈉的量÷總的硫氫化鈉耗量×100%)。
1.2.3 硫酸質(zhì)量濃度對硫化氫氣體產(chǎn)生量的影響實驗
分別量取165 mL高濃度酸性廢水和835 mL低濃度酸性廢水混合,加入10.32 g硫酸鐵和一定量的濃硫酸(98%),配制成硫酸質(zhì)量濃度分別為2,3,4,5,6 g/L的溶液樣品,其中Cu2+質(zhì)量濃度為0.73 g/L,總Fe質(zhì)量濃度為5.00 g/L。
直觀的圖形圖像,往往是圖像志手冊作者心目中首選的、真正值得效仿的可靠來源,古人在錢幣與雕塑中的運用實例便屬其一。
分別用不同質(zhì)量濃度的硫酸溶液進行硫化沉淀實驗,反應(yīng)終點電位控制200 mV,分別測定硫化氫氣體的產(chǎn)生量,計算與酸反應(yīng)的硫氫化鈉的比例。
1.2.4 反應(yīng)終點電位對硫化氫氣體產(chǎn)生量的影響
采用質(zhì)量濃度為4 g/L的硫酸溶液進行硫化沉淀實驗,通過控制硫氫化鈉溶液的添加量,控制反應(yīng)終點電位分別為200,-20,-100,-200,-300 mV,分別測定硫化氫氣體的產(chǎn)生量,計算與酸反應(yīng)的硫氫化鈉的比例。
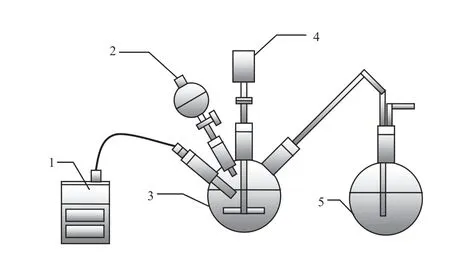
圖1 實驗裝置
1.3 分析方法
采用酸堿滴定法測定溶液中硫酸的質(zhì)量濃度,采用重鉻酸鉀法測定溶液中Fe2+和Fe3+的質(zhì)量濃度,兩者相加得到溶液中總Fe的質(zhì)量濃度[11];采用電感耦合等離子體光譜法測定溶液中Cu2+和S2-的質(zhì)量濃度[12]。
2 結(jié)果與討論
2.1 含銅酸性廢水硫化沉淀過程的理論分析
酸性廢水利用硫氫化鈉沉銅的過程主要發(fā)生以下反應(yīng):
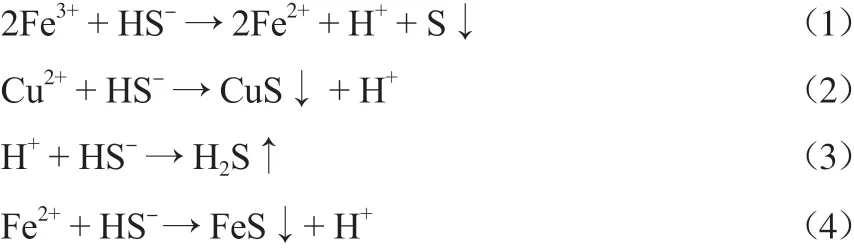
溶度積分別為Ksp(C u S)= 6.3×1 0-36,Ksp(FeS)= 6.3×10-18[13-14]。

反應(yīng)式(5)的平衡常數(shù)K5= 1.26×1042。


反應(yīng)式(8)的平衡常數(shù)K8= 1/Ksp(CuS) =1.59×1035。

反應(yīng)式(9)的平衡常數(shù)K9= 1/Ksp(FeS) =1.59×1017。
通過以上數(shù)據(jù),可以分別計算得到反應(yīng)(1)~(4)的平衡常數(shù):
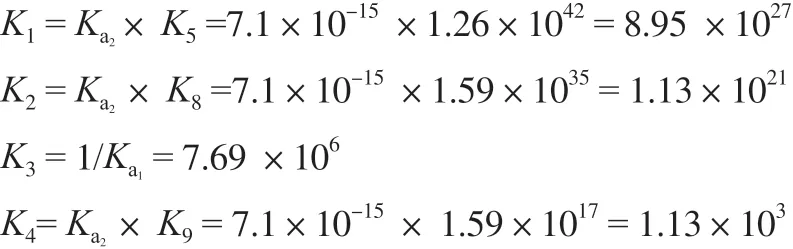
根據(jù)化學熱力學原理,化學反應(yīng)的平衡常數(shù)越大,其反應(yīng)的趨勢越強。從反應(yīng)(1)~(4)的化學平衡常數(shù)可知,K1>K2>>K3>K4,即反應(yīng)(1)到反應(yīng)(4)的化學反應(yīng)趨勢逐漸減弱,且反應(yīng)(1)和(2)的趨勢比反應(yīng)(3)和(4)的趨勢強的多。
在酸性廢水硫化沉銅過程中,硫氫化鈉被Fe3+還原成單質(zhì)硫的反應(yīng)最容易發(fā)生,其次為硫氫化鈉與Cu2+生成CuS沉淀的反應(yīng),產(chǎn)生硫化氫氣體的趨勢很弱,而生成FeS的趨勢最弱。
因此,含銅酸性廢水硫化沉淀過程中,可通過硫氫化鈉溶液的添加量,使銅基本沉淀完全,同時控制硫氫化鈉溶液的過剩量,盡量減少硫化氫氣體的產(chǎn)生量。
2.2 硫化沉淀終點電位的優(yōu)化
含銅酸性廢水硫化沉淀過程中,銅是主要的目標回收元素。應(yīng)控制適合的反應(yīng)條件,在獲得較高銅沉淀率的同時,盡可能降低硫氫化鈉的耗量,以降低藥劑成本,提高經(jīng)濟效益。
含銅酸性廢水中,由于存在高價態(tài)的Fe3+和Cu2+,氧化性較強,溶液電位約為600 mV。硫氫化鈉的還原性較強,硫氫化鈉溶液的電位遠小于0 mV。當硫氫化鈉溶液加入到含銅酸性廢水中時,依次與Fe3+和Cu2+反應(yīng),溶液電位逐漸降低。
終點電位對銅鐵沉淀率和硫氫化鈉消耗量的影響見圖2。由圖2可見:硫化沉淀終點電位為200 mV時,Cu2+基本都以CuS形式沉淀,銅沉淀率接近100%,F(xiàn)e3+幾乎全部被還原為Fe2+,鐵沉淀率極低;當終點電位低于0 mV后,鐵沉淀率逐漸增大。
因此,含銅酸性廢水硫化沉淀時,可通過控制終點電位約200 mV,使銅沉淀完全,同時硫氫化鈉的過剩量較小,可在最大程度上減少硫化氫氣體的產(chǎn)生量。
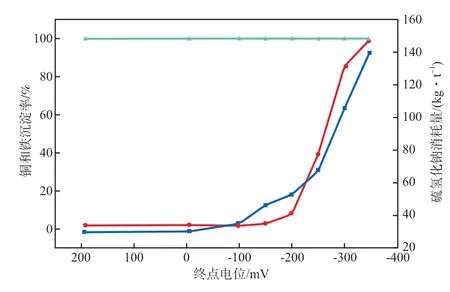
圖2 終點電位對銅鐵沉淀率和硫氫化鈉消耗量的影響
2.3 硫酸質(zhì)量濃度的優(yōu)化
在硫化沉淀終點電位為200 mV的條件下,硫酸溶液質(zhì)量濃度對硫化氫氣體產(chǎn)生量和與酸反應(yīng)的硫氫化鈉占硫氫化鈉消耗量的比例(簡稱與酸反應(yīng)的硫氫化鈉的比例)的影響見圖3。
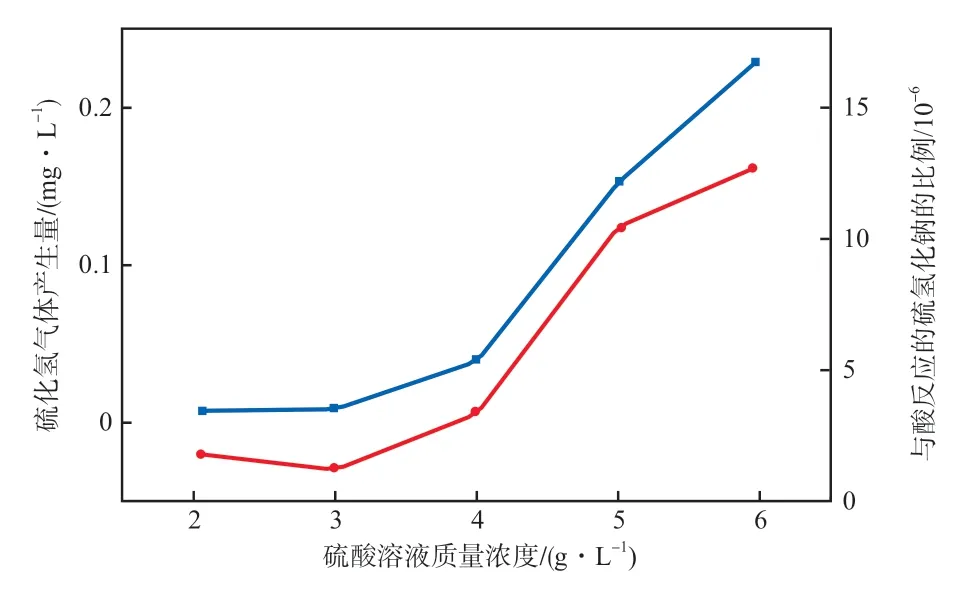
圖3 硫酸溶液質(zhì)量濃度對硫化氫氣體產(chǎn)生量和與酸反應(yīng)的硫氫化鈉比例的影響
由圖3可見:隨著硫酸溶液質(zhì)量濃度提高,硫化氫氣體的產(chǎn)生量逐漸增加;當硫酸溶液質(zhì)量濃度大于4 g/L時,硫化氫氣體產(chǎn)生量顯著增加;同時可見,與酸反應(yīng)的硫氫化鈉僅占硫氫化鈉消耗量的百萬分之幾。
硫化沉淀反應(yīng)體系的硫酸質(zhì)量濃度宜控制在小于4 g/L。
終點電位對硫化氫氣體產(chǎn)生量和與酸反應(yīng)的硫氫化鈉比例的影響見圖4。由圖4可知,反應(yīng)終點電位由200 mV逐漸減小到-300 mV,硫化氫氣體的產(chǎn)生量逐漸增加。反應(yīng)終點電位控制在0~200 mV時,硫化氫氣體的產(chǎn)生量很小。通過控制反應(yīng)終點電位約200 mV,使銅沉淀完全,同時硫氫化鈉的過剩量較小,可在最大程度上減少硫化氫氣體的產(chǎn)生量。

圖4 終點電位對硫化氫氣體產(chǎn)生量和與酸反應(yīng)的硫氫化鈉比例的影響
3 結(jié)語
a)在酸性廢水硫化沉銅過程中,硫氫化鈉被Fe3+還原成單質(zhì)硫的反應(yīng)最容易發(fā)生,其次為硫氫化鈉與Cu2+生成CuS沉淀的反應(yīng),產(chǎn)生硫化氫氣體的趨勢很弱,而生成FeS的趨勢最弱。
b)當反應(yīng)終點電位控制在200 mV時,銅基本上沉淀完全,鐵沉淀率很小。硫氫化鈉的過剩量較小,可在最大程度上減少硫化氫氣體的產(chǎn)生量。
c)隨著溶液酸度增加,硫化氫氣體的產(chǎn)生量逐漸增加。硫化沉淀反應(yīng)體系的硫酸質(zhì)量濃度宜控制在小于4 g/L。

