抗壞血酸和鐵系還原劑修復鉻污染土壤
張恩智,蹇 川,張 笑,譚紹林,高煥方
(1. 重慶理工大學 化學化工學院,重慶 400054;2. 重慶市生態環境監測中心,重慶 401147;3. 重慶市大渡口區生態環境局,重慶 400084)
Cr被廣泛應用于電鍍、制革、染色、防腐等工藝,使得鉻酸鹽合成、鉻冶煉等工業生產活動大量涌現[1-2]。早期工廠對鉻渣的不規范堆放,造成土壤的Cr(Ⅵ)含量和Cr(Ⅵ)浸出濃度嚴重超標[3-4]。飲用水和土壤灰塵的直接攝入及動植物體食物的間接攝入均會導致Cr(Ⅵ)中毒[5]。Cr(Ⅵ)的氧化性極強,除損傷人體器官外,還會損害DNA,造成癌癥、畸形等危險疾病,毒性比Cr(Ⅲ)大百倍[6-7]。
減少土壤的Cr(Ⅵ)污染,一是從土壤中去除Cr;二是將Cr固定在土壤中,從而降低Cr(Ⅵ)的浸出濃度,提高土壤的生物可用性。從去除土壤中Cr的角度出發,發展出了兩種主要方法:一種是利用化學藥劑將Cr從土壤中淋洗出來,該方法成本過高,且可能造成二次污染;另一種則是利用植物吸收土壤中的Cr,該方法經濟成本較低,但修復周期過長,時間成本過高[1,8]。從固定Cr于土壤的角度出發,則發展出了化學還原穩定技術,該技術因成本較低、修復效率高、修復速度快而成為目前Cr污染場地的主要修復技術[9-10]。
化學還原穩定技術的原理是基于Cr(Ⅲ)的遷移性遠低于Cr(Ⅵ),Cr(Ⅲ)可與土壤中的膠粒和氧化物結合形成難遷移的沉淀物[11]。已應用于場地修復的Na2S2O3等硫系還原劑能顯著還原和穩定土壤中的Cr(Ⅵ),但其浸出濃度會在修復數天后出現反彈[12-13]。而具有強還原性的抗壞血酸(C6H8O6)以及一些鐵系還原劑還少見于該領域的研究報道。其中,C6H8O6不會對環境造成二次污染。
本研究通過投加還原劑(NH4)2Fe(SO4)2、FeCl2、FeS和C6H8O6修復Cr污染土壤,考察了土壤的Cr(Ⅵ)含量、Cr(Ⅵ)浸出濃度、Cr形態、pH及晶體結構的變化,以評價其修復效果和長期穩定性能,為今后Cr污染土壤的實驗研究及場地修復提供科學依據。
1 實驗部分
1.1 試劑和材料
實驗所用還原劑FeCl2、FeS、(NH4)2Fe(SO4)2和C6H8O6均為采購自西隴科學股份有限公司的分析純試劑。實驗所用土壤取自重慶市某化工廠Cr污染場地的表層(0~50 cm)土壤,土壤質地為砂壤土,呈淺棕色,經風干研磨、過100目篩、混勻后待用,其基本理化性質見表1。

表1 供試土壤的基本理化性質
1.2 實驗方法
分別取200 g待試土樣,以溶液的方式投加40 mL去離子水溶解的FeCl2、(NH4)2Fe(SO4)2和C6H8O6,及固體方式投加碾碎后過100目篩的FeS。已有研究表明,亞鐵還原劑的投加量為理論值的3倍和4倍時的修復效果較好[14],故以此作為還原劑投加量的依據,具體實驗方案見表2。投加還原劑后手動攪拌,邊攪拌邊噴入去離子水,使土樣含水率在30%左右,并保持蓬松狀態。攪拌完成后用保鮮膜封住以減少水分蒸發,定期噴灑適量去離子水以保持30%左右的含水率,不定期取樣分析。
理論值即理論價態水平上恰好完全還原土壤中Cr(Ⅵ)的還原劑投加量。每200 g待試土樣的FeCl2,C6H8O6,(NH4)2Fe(SO4)2,FeS投加量的理論值分別為1.524,0.704,2.640,1.056 g。
1.3 分析方法
按照《土壤檢測 第12部分:土壤總鉻的測定》(NY/T 1121.12—2006)[15]測定土壤總Cr含量。
按照《固體廢物 浸出毒性浸出方法 硫酸硝酸法》(HJ/T 299—2007)[16]對土壤重金屬進行浸出,再按照《固體廢物 六價鉻的測定 二苯碳酰二肼分光光度法》(GB/T 15555.4—1995)[17]測定土壤Cr(Ⅵ)浸出質量濃度。根據處理前后的土壤Cr(Ⅵ)浸出質量濃度,計算還原劑對Cr(Ⅵ)的穩定效率[18]。

表2 Cr污染土壤修復實驗方案
按照《危險廢物鑒別標準 浸出毒性鑒別》(GB 5085.3—2007)[19]對土壤進行前處理,再按照GB/T 15555.4—1995測定土壤Cr(Ⅵ)含量。根據處理前后的土壤Cr(Ⅵ)含量,計算還原劑對Cr(Ⅵ)的還原率。
按照《土壤和沉積物 13個微量元素 形態順序提取程序》(GB/T 25282—2010)[20]分析土壤Cr形態。
將去離子水和土壤按照2.5∶1的質量比混合均勻后,采用上海儀電科學儀器股份有限公司pHS-3E型pH計測定土壤pH。
采用日本津島公司Shimadzu XRD-7000型X射線衍射儀分析土壤晶體結構:Cu靶,管電壓40 kV,管電流40 mA,掃描范圍10°~80°,掃描速率2 ( °)/min。
按照《土壤檢測 第5部分:石灰性土壤陽離子交換量的測定》(NY/T 1121.5—2006)[21]測定土壤陽離子交換量。
2 結果與討論
2.1 不同還原劑對土壤的修復效果對比
2.1.1 Cr(Ⅵ)浸出濃度
養護期間土壤Cr(Ⅵ)浸出質量濃度的變化見圖1。由圖1可知:C6H8O6對Cr污染土壤中的Cr(Ⅵ)穩定效果最好;4 d后,投加3倍和4倍理論值C6H8O6土壤的Cr(Ⅵ)浸出質量濃度快速降至1.32 mg/L和1.31 mg/L;4~30 d的Cr(Ⅵ)浸出質量濃度均低于《生活垃圾填埋場污染控制標準》(GB 16889—2008)[22]中Cr(Ⅵ)的浸出限值(1.5 mg/L);投加3倍理論值C6H8O6的土壤在32 d時Cr(Ⅵ)浸出質量濃度降至最低值0.83 mg/L,對Cr(Ⅵ)的穩定效率達98.3%;投加4倍理論值C6H8O6與3倍時相比,穩定效果無明顯提升;養護期間,Cr(Ⅵ)的浸出濃度趨于平穩,相比于鐵系還原劑在投加數天后出現浸出濃度增加,C6H8O6在修復過程中無反彈現象,這表明C6H8O6對Cr污染土壤的修復在長期穩定性方面更具優勢。C6H8O6在水中具有一定的溶解性,適度的水分能保證藥劑將土壤中的Cr(Ⅵ)快速還原為Cr(Ⅲ)。盡管C6H8O6在空氣和水中極不穩定,但處于土壤中的有機分子可以與土壤膠粒螯合,這不僅增加了C6H8O6與吸附在土壤膠粒上的Cr(Ⅵ)的反應面積,同時也提高了C6H8O6的穩定性[23]。
FeCl2和(NH4)2Fe(SO4)2對Cr污染土壤具有一定的修復效果,以3倍和4倍理論值投加的FeCl2以及以3倍和4倍理論值投加的(NH4)2Fe(SO4)2在第4天時對土壤Cr(Ⅵ)的穩定效果最好,Cr(Ⅵ)浸出質量濃度分別快速降至4.09,2.64,4.31,1.62 mg/L,這可能與FeCl2和(NH4)2Fe(SO4)2投加后土壤pH快速下降有關(見后續圖4)。已有研究表明,較低的土壤pH有利于Cr(Ⅵ)還原反應的發生[24]。在養護4 d后,土壤Cr(Ⅵ)浸出濃度持續上升,表明亞鐵離子在第4天已基本耗盡。最終,兩種還原劑對Cr(Ⅵ)的穩定效率均保持在73%以上。
即使添加了4倍理論值的藥劑,FeS對Cr污染土壤的修復效果仍不明顯。30 d時,土壤的Cr(Ⅵ)浸出質量濃度仍高達46.29 mg/L,與原土相差無幾。這主要是因為FeS不溶于水,不能電離出還原性離子Fe2+和S2-;再加上FeS的粒徑過大,導致與Cr(Ⅵ)的反應很難發生。盡管LI等[25]制備的納米FeS能顯著降低土壤的Cr(Ⅵ)浸出濃度至未檢出的程度,但藥劑成本的大幅升高將導致其很難應用于實際的工程修復。

圖1 養護期間土壤Cr(Ⅵ)浸出質量濃度的變化
2.1.2 Cr(Ⅵ)還原率
養護期間土壤Cr(Ⅵ)含量的變化見圖2。4種還原劑對土壤中的Cr(Ⅵ)均有一定的還原性。30 d時,不溶的FeS還原效果最差,其3倍和4倍理論投加量對Cr(Ⅵ)的還原率僅為60%左右。盡管已有研究表明特制的納米級FeS能顯著修復土壤的Cr(Ⅵ)污染[25],但本實驗使用的是工業生產的FeS,雖然對其進行了碾碎過篩處理,但相比于其他鐵系還原劑,其粒徑仍然較大,與Cr(Ⅵ)的接觸率較低。其余還原劑對土壤中的Cr(Ⅵ)均有顯著還原效果,而投加4倍理論值的(NH4)2Fe(SO4)2效果最好,其還原率可達86.88%,C6H8O6對Cr(Ⅵ)的還原率也可達86%以上。土壤顆粒的包裹導致還原劑無法接觸到顆粒內部的Cr(Ⅵ),故無法完全還原土壤中的Cr(Ⅵ)[26]。相比于其他還原劑,C6H8O6在整個養護期間的Cr(Ⅵ)還原率更為穩定,未出現反彈現象。3種還原劑FeCl2、(NH4)2Fe(SO4)2和C6H8O6對土壤中Cr(Ⅵ)的還原率均達到了80%以上。
2.1.3 Cr形態變化
本實驗按照GB/T 25282—2010對土壤中的Cr進行形態分級提取,共分為可交換態、碳酸鹽結合態、鐵錳氧化物結合態、有機物結合態和殘渣態5個形態[27]。其中,殘渣態Cr主要存在于礦物晶格和土壤膠粒中,其遷移性和生物有效性極低,不會危害到環境和生物[28]。在添加還原劑并養護30 d后,測定各個土壤樣品的Cr形態數據并與原土進行對比,結果見圖3。

圖2 養護期間土壤Cr(Ⅵ)含量的變化

圖3 修復后土壤與原土的Cr形態對比
由圖3可以看出,投加了含Fe2+的FeCl2和(NH4)2Fe(SO4)2的土壤,其Cr的殘渣態均為原土的2.3倍。有研究表明,Fe2+在還原Cr(Ⅵ)為Cr(Ⅲ)的同時,其自身的氧化產物Fe3+可與土壤中的OH-形成Fe(OH)3膠體,吸附重金屬Cr和土壤膠粒,Fe(OH)3和Cr(OH)3共沉淀形成鉻鐵礦殘渣態[29]。原土的pH為9.84,堿性較強,根據化學反應平衡有利于Fe(OH)3和Cr(OH)3的形成,促進了鉻鐵礦殘渣態的產生[30]。而投加了FeS的兩組樣品相比于原土,其形態幾乎沒有改變,與前述原因一樣,FeS顆粒較大,難以與土壤中的Cr(Ⅵ)反應并與之結合形成殘渣態,這也是FeS處理后的土壤浸出濃度較大的根本原因。投加了C6H8O6的土壤樣品相比于原土,其Cr的殘渣態增加了1倍左右。這主要是由于:C6H8O6本身并不能與Cr形成礦物殘渣態,被還原的Cr(Ⅲ)只能通過土壤本身所含的Al3+、Fe3+、Mn2+等陽離子形成的氧化物或氫氧化物,包裹或絡合而形成礦物殘渣態[31];另一方面,原土的陽離子交換量只有14.00 cmol/kg,土壤膠粒難以吸附大量的Cr3+,故其殘渣態的增量略低[32]。
2.2 不同還原劑對土壤pH的影響
養護期間土壤pH的變化見圖4。由圖4可知,FeCl2和(NH4)2Fe(SO4)2的投加會導致土壤pH的降低,其中,投加了FeCl2和(NH4)2Fe(SO4)2的土壤樣品pH出現不同程度的下降。這可能是由于FeCl2是以溶液的形式投加到土壤中,與土壤中的OH-有更多的接觸面積,導致土壤pH快速下降[33]。而投加了C6H8O6的土壤樣品的pH先迅速下降然后持續上升,最后穩定在9左右;與原土9.84的pH相比,土壤pH的變化較小。這主要是因為C6H8O6在土壤中會釋放出H+,這會導致土壤pH先降低,隨后在養護過程中C6H8O6逐漸與Cr(Ⅵ)反應而被消耗,土壤pH緩慢上升然后保持穩定[23]。由于FeS顆粒較大,與土壤中Cr(Ⅵ)的接觸面積較小,反應較慢,土壤pH緩慢降低后趨于穩定,最后維持在9附近。
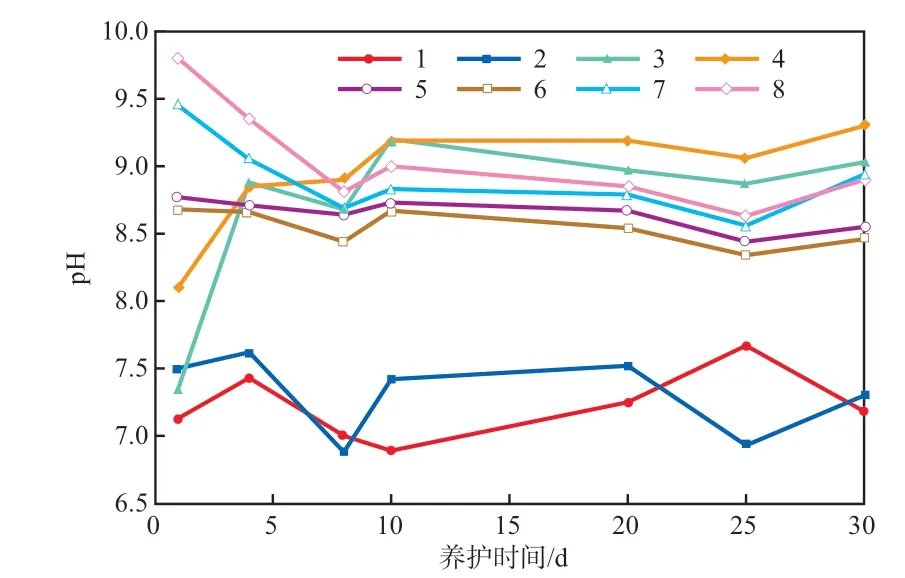
圖4 養護期間土壤pH的變化
2.3 不同還原劑對土壤晶體結構的影響
以3倍理論值投加量還原劑修復土壤為例,不同還原劑修復后土壤與原土的XRD譜圖見圖5。由圖5可見,與原土相比,投加還原劑修復后的土壤,其晶體結構未見明顯改變,這主要是因為在還原劑修復過程中并沒有生成新的晶體結構。FeCl2和(NH4)2Fe(SO4)2的投加盡管會導致土壤中鐵含量的增加,但生成的晶體結構與土壤已存在的含Fe的晶體結構相同。C6H8O6的引入僅是利用土壤本身所存在的Al3+、Fe3+、Mn2+等金屬離子,同樣不會產生新的晶體結構。雖然FeS因其難溶、難分解的特性會在土壤中引入新的晶體結構,但由于含量較少,加上土壤結構的復雜性而難以被檢測到。綜上,4種還原劑的投加所引入或產生的新的結晶物質均未對土壤晶體結構產生明顯影響。

圖5 不同還原劑修復后土壤與原土的XRD譜圖
3 結論
a)還原劑FeS對土壤Cr(Ⅵ)的還原率僅為60%左右,且穩定效率極低。另外3種還原劑FeCl2、(NH4)2Fe(SO4)2和C6H8O6均能顯著降低土壤的Cr(Ⅵ)含量和Cr(Ⅵ)浸出濃度,且投加量為理論值3倍和4倍時的效果相差不大,對土壤中Cr(Ⅵ)的還原率均達到了80%以上,穩定效率均超過了73%。
b)C6H8O6相比于鐵系還原劑表現出更好的長期穩定性,4~30 d的Cr(Ⅵ)浸出質量濃度均低于《生活垃圾填埋場污染控制標準》(GB 16889—2008)中Cr(Ⅵ)的浸出限值(1.5 mg/L);投加3倍理論值C6H8O6的土壤在30 d時的Cr(Ⅵ)浸出質量濃度降至最低值0.83 mg/L,對Cr(Ⅵ)的穩定效率達98.3%。而亞鐵還原劑FeCl2和(NH4)2Fe(SO4)2對Cr(Ⅵ)的穩定效率在養護數天后均出現反彈現象。
c)除FeS外,其余3種還原劑均顯著增加了土壤中生物有效性極低的Cr殘渣態占比;C6H8O6處理后的Cr污染土壤的殘渣態是原土的約2倍,而FeCl2和(NH4)2Fe(SO4)2處理后的是原土的2.3倍。
d)C6H8O6還原劑的投加對土壤pH無明顯影響;FeCl2和(NH4)2Fe(SO4)2還原劑的投加會導致土壤pH降低;FeS對土壤pH的影響較小。
f)4種還原劑的投加所引入或產生的新的結晶物質均未對土壤晶體結構產生明顯影響。

