松樹內生蠟樣芽孢桿菌NJSZ-13菌株發酵培養基及條件優化
尹艷楠,吳佳雯,談家金,郝德君
(南京林業大學,江蘇 南京 210037)
松材線蟲病(pine wilt disease)又稱松樹枯萎病,是由松材線蟲Bursaphelenchus xylophilus引起的植物病害。自從1982 年于南京中山陵的黑松Pinus thunbergii上首次發現松材線蟲病以后[1],30 多年來,該病相繼在江蘇、安徽、浙江、廣東、山東、臺灣、香港、江西、湖南、云南、湖北、重慶和貴州等多個省、市暴發,給農林業和國家經濟帶來了嚴重的損失[2]。目前,在松材線蟲病防治方面主要采用對疫木進行砍伐、鐵砂網罩等物理方法,但是處理困難,需要耗費大量人力和物力;向感病疫木或林地噴灑化學農藥的化學方法,雖然方法簡單有效,但是長期使用化學農藥對環境會造成不可逆的毀壞;以及利用毒殺線蟲的細菌、真菌或者植物性殺松材線蟲活性物質進行生物防治來實現[3-5]。
在利用微生物防治松材線蟲病方面,具有前景的細菌有芽孢桿菌Bacilllus,假單胞菌Pseudomonas,巴氏桿菌Pasteurella等,特別是可以在不同的宿主快速定殖,被廣泛應用于植物病害的生物防治方面的芽孢桿菌,包括解淀粉芽孢桿菌B.amyloliquefaciens,枯草芽孢桿菌B.subtilis,巴氏芽孢桿菌B.pasteurii,側孢芽孢桿菌B.lateralis,蠟樣芽孢桿菌B.cereus,蘇云金芽孢桿菌B.thuringiensis,短小芽孢桿菌B.pumilus和球形芽孢桿菌B.sphaericus等[6-9]。蠟樣芽孢桿菌B.cereus是一種革蘭氏陽性桿菌,主要分布于空氣、土壤、水及植物中,能產生抗逆性內生芽孢,對高溫、干燥、紫外線輻射等惡劣環境都具有很強的抵抗能力,在植物的表面容易存活、定殖,且其抑菌范圍較廣泛,能有效地防治許多植物病害[10-12]。本文選用的蠟樣芽孢桿菌NJSZ-13 菌株是一株從南京濕地松P.elliottii上篩選的并且可以在馬尾松P.massoniana上定殖的具有殺松材線蟲作用的松樹內生細菌,前期研究表明該菌株菌體水懸液處理線蟲48 h 后,線蟲死亡率達到81.5%[13]。若將蠟樣芽孢桿菌NJSZ-13菌株應用于生產,要通過發酵使細胞富集,制成活菌制劑。因此,將蠟樣芽孢桿菌NJSZ-13 菌株發酵液單位體積活菌數提高是關鍵的一步。本試驗通過對菌株發酵培養基和培養條件進行優化,進一步提高發酵液活菌數,從而為后期蠟樣芽孢桿菌NJSZ-13 菌株的微生物制劑開發與生防應用奠定基礎。
1 材料與方法
1.1 材料
1.1.1 供試菌株 蠟樣芽孢桿菌NJSZ-13 菌株由南京林業大學森林保護學病理實驗室提供。
1.1.2 供試培養基 NJSZ-13 菌株種子培養基:蛋白胨10 g·L-1,牛肉膏5 g·L-1,氯化鈉5 g·L-1,pH 值7.2~ 7.4。
1.2 方法
1.2.1 NJSZ-13 菌株的活化 將實驗室保存的NJSZ-13 菌種移接到斜面試管培養基中,在恒溫培養箱28℃恒溫培養24 h 待用。
1.2.2 種子液的制備 取一環活化后的NJSZ-13 菌株接種于盛有40 mL 種子培養基的100 mL 三角瓶中,28℃、200 r·min-1條件下搖床振蕩培養24 h。
1.2.3 搖瓶發酵初始條件 按5%的接種量將NJSZ-13 菌株的種子液接種到有40 mL 發酵培養基的100 mL 三角瓶里,在28℃、200 r·min-1的條件下搖床振蕩培養24 h。進行單因素試驗、培養基正交優化試驗和發酵條件的優化試驗。
1.2.4 NJSZ-13 發酵液活菌計數 活菌數的測定采用稀釋平板計數法[14]。
1.2.5 基礎培養基篩選 選擇4 種不同的培養基(見表1),將NJSZ-13 菌株在不同的基礎培養基中進行搖瓶發酵,分別測定NJSZ-13 菌株發酵液的活菌數。
1.2.6 單因素試驗
(1)碳源種類及其濃度篩選
分別用等量的葡萄糖、玉米粉、麥芽糖、可溶性淀粉、蔗糖、甘露醇替代基礎培養基中的碳源(C 源),以不加C 源的基礎培養基為對照(CK),其他發酵條件不變,進行搖瓶發酵,每處理重復3 次。采用活菌計數法測定不同C 源發酵液的活菌數,篩選最佳C 源。在篩選出最佳C 源種類的基礎上,在相同條件下設置0.4%,0.6%,0.8%,1.0%,1.2%,1.4%即4,6,8,10,12,14 g·L-16 種不同濃度C 源的培養基進行搖瓶發酵,以篩選出最佳C 源濃度。
(2)氮源種類及其濃度篩選
在C 源篩選的基礎上,分別用等量的蛋白胨、牛肉膏、尿素、硫酸銨、大豆蛋白胨、玉米漿干粉、酵母粉代替發酵培養基中的氮源(N 源),以不加N 源的培養基為對照(CK),其他發酵條件不變,進行搖瓶發酵,每處理重復3 次。用活菌計數法計算不同N 源發酵液的活菌數,篩選最佳N 源。在篩選出最佳N 源的基礎上,在相同條件下設置0.4%,0.6%,0.8%,1.0%,1.2%,1.4%即4,6,8,10,12,14 g·L-16 種不同濃度N 源的培養基進行搖瓶發酵,以篩選出最佳N 源濃度。

表1 供試培養基及其配方Table 1 Basic medium and their formula
(3)無機鹽種類及其濃度篩選
在C 源、N 源優化的基礎上,分別添加0.6%的ZnSO4,NaCl,CaCl2,MnSO4,MgSO4,KCl 代替發酵培養基中的無機鹽,以不加無機鹽的培養基作為對照(CK),其他發酵條件不變,每處理重復3 次。采用活菌計數法計算不同無機鹽發酵液的活菌數,篩選最佳無機鹽。在篩選出最佳無機鹽的基礎上,在相同條件下考察在大量元素無機鹽不同濃度(0.2%,0.3%,0.4%,0.5%,0.6%,0.7% 即2,3,4,5,6,7 g·L-1)發酵液中的活菌數,篩選出最佳無機鹽的濃度。
1.2.7 發酵培養基正交試驗優化 篩選得到的培養基最佳C 源為可溶性淀粉,最佳N 源為大豆蛋白胨,最佳無機鹽為CaCl2。將可溶性淀粉(A)、大豆蛋白胨(B)和CaCl2(C)三因素按L9(33)設計正交試驗的因素與水平,見表2。按正交驗設計,在28℃、200 r·min-1、pH 7.2 的條件下振蕩培養24 h,以發酵液的活菌數為優化指標,比較不同組合發酵液的活菌數,確定最佳培養基配方。
1.2.8 搖瓶發酵條件優化 在培養基的優化基礎上,對搖瓶發酵的發酵溫度、初始pH、接種量、裝液量進行優化。每個試驗組設置3 次重復,進行一個因素優化期間保證其他條件不變,計數不同條件下搖瓶發酵液的活菌數。
發酵溫度:將NJSZ-13 菌株接種后分別在25,28,31,34,37℃條件下搖床發酵;初始pH:用HCl 和NaOH調節培養基的初始pH 值分別為6.5,7.0,7.5,8.0,8.5;接種量:將NJSZ-13 菌株按照體積分數分別為為1%,2%,3%,4%,5%的接種量進行接種;裝液量:將NJSZ-13 菌株分別接種到按體積分數為10%,20%,30%,40%,50%裝液量的培養基中(即100 mL 三角瓶分別裝入盛有10,20,30,40,50 mL 培養基)搖瓶發酵。
1.2.9 蠟樣芽孢桿菌NJSZ-13 生長曲線的繪制 將活化好的蠟樣芽孢桿菌接種于發酵培養基中,利用芬蘭制造Bio Screener 全自動微生物生長曲線分析儀FP-1100-C 每間隔2 h 測定發酵液的被檢測物吸收掉的光密度OD600值,繪制菌體生長曲線。

表2 正交試驗的因素與水平Table 2 Factors and levels of orthogonal test
2 結果與分析
2.1 基礎發酵培養基篩選
由圖1 可知,將蠟樣芽孢桿菌菌株NJSZ-13 接種到不同培養基上進行搖床震蕩培養,不同培養基成份對發酵液活菌數量的影響差異顯著(P<0.05),其中,1 號與3 號培養基發酵液中蠟樣芽孢桿菌菌株NJSZ-13 的活菌數量之間沒有顯著差異(P>0.05),但是菌株NJSZ-13 在3 號培養基中搖瓶發酵培養下,單位體積的活菌數量最高,為10.00×108cfu·mL-1,1 號培養基單位體積發酵液的活菌數量為9.27×108cfu·mL-1,2 號和4 號培養基單位體積發酵液的活菌數量與1 號、3 號相比顯著降低,其中,4 號培養基發酵液對應的單位體積內活菌數量為6.97×108cfu·mL-1。所以,選擇3 號培養基作為蠟樣芽孢桿菌菌株NJSZ-13 搖瓶發酵的基礎培養基。
2.2 培養基優化的單因素試驗
2.2.1 培養基C 源的優化 由圖2 可知,不同C 源對蠟樣芽孢桿菌NJSZ-13 的活菌數量有較大的影響,其中,以可溶性淀粉作為培養基C 源時,單位體積的活菌數量達到最大值,為16.17×108cfu·mL-1,其余C 源對活菌數量的影響由大到小依次為玉米粉、蔗糖、麥芽糖、甘露醇和葡萄糖,CK 最低,為7.93×108cfu·mL-1。另外,還可以看出,蠟樣芽孢桿菌NJSZ-13 對多糖的利用高于單糖和二糖,所以選擇可溶性淀粉作為蠟樣芽孢桿菌NJSZ-13 搖瓶發酵培養基的C 源。
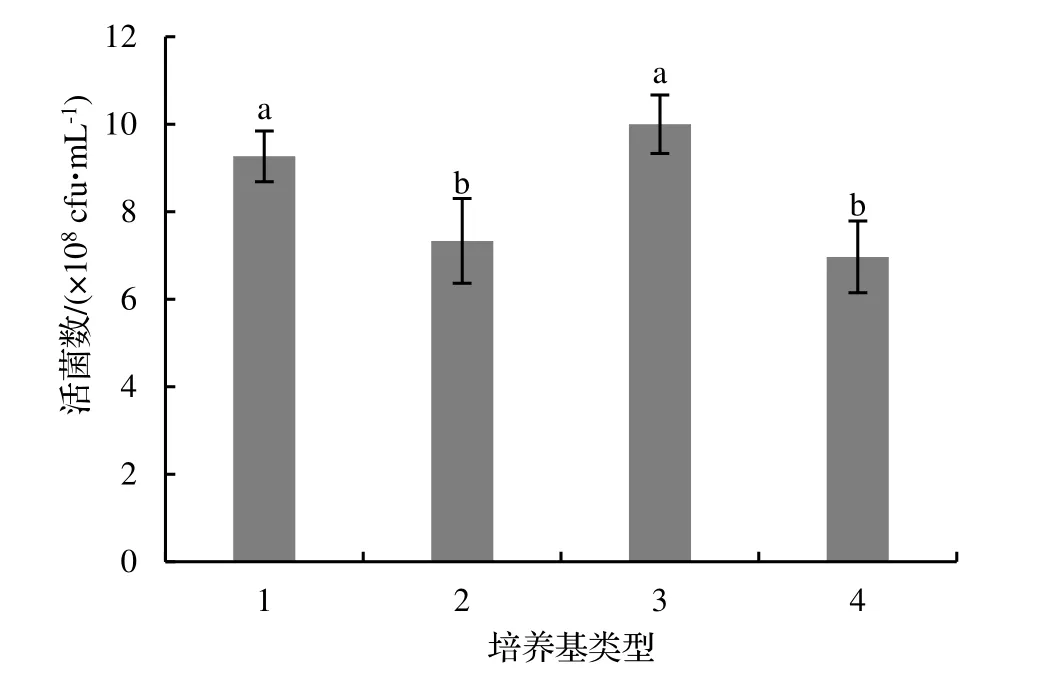
圖1 不同培養基對菌株NJSZ-13 發酵液活菌數量的影響Figure 1 Effect of different culture media on viable count of strain NJSZ-13 in fermentation broth
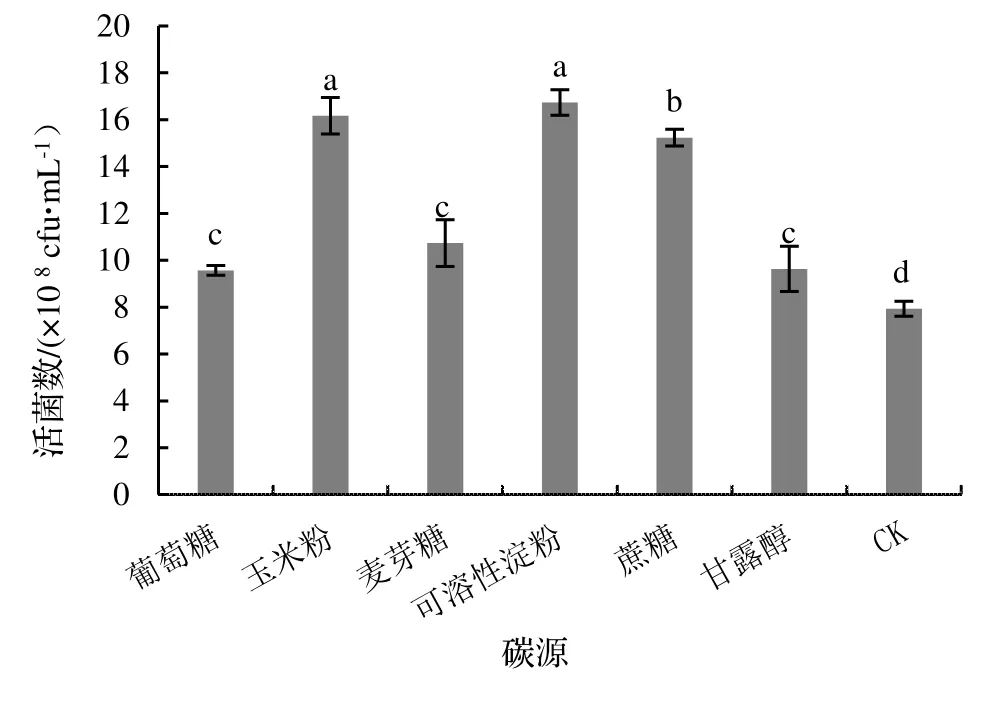
圖2 不同C源培養基對菌株NJSZ-13活菌數量的影響Figure 2 Effect of different carbon source in culture medium on viable count of strain NJSZ-13 in fermentation broth
2.2.2 C 源濃度的篩選 由圖3 可知,在一定濃度范圍內,蠟樣芽孢桿菌NJSZ-13 單位體積發酵液的活菌數量隨著可溶性淀粉濃度的增加而增加,當可溶性淀粉的濃度增加到10 g·L-1時,單位體積發酵液中的活菌數量達到最高,為16.80×108cfu·mL-1。而當濃度超過10 g·L-1時,隨著濃度的增加單位體積發酵液中的活菌數量隨之減少,所以選擇8,10,12 g·L-1這3 個濃度作為正交試驗C 源濃度的三個水平。
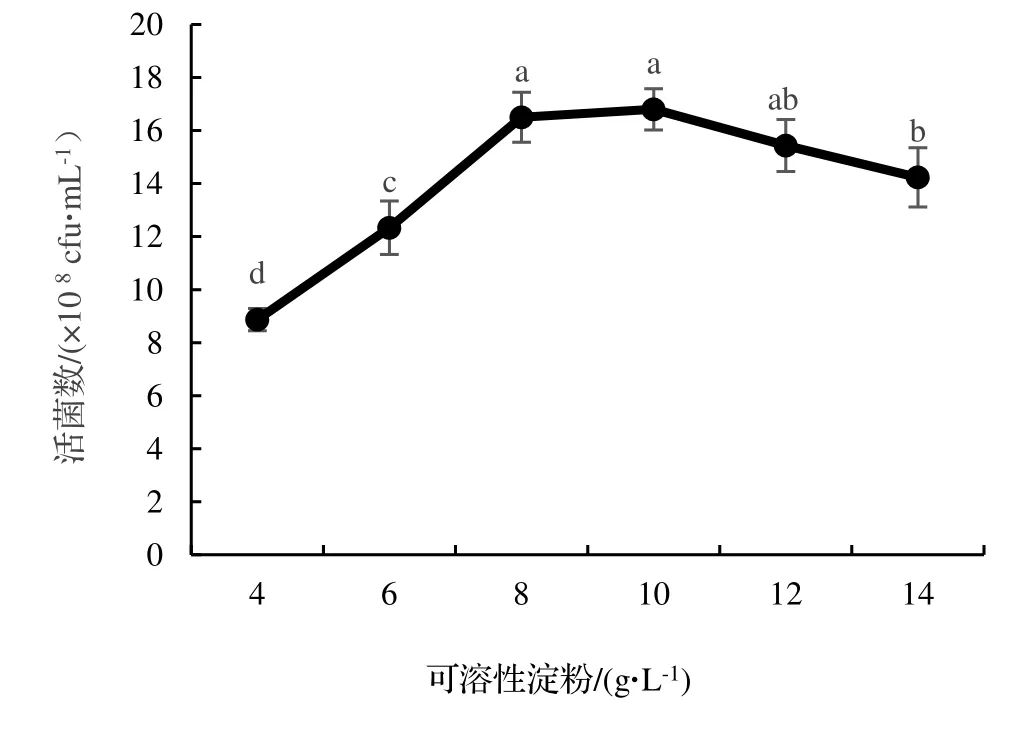
圖3 不同濃度可溶性淀粉對菌株NJSZ-13 活菌數量的影響Figure 3 Effect of different concentrations of soluble starch in culture medium on viable count of strain NJSZ-13 in fermentation broth
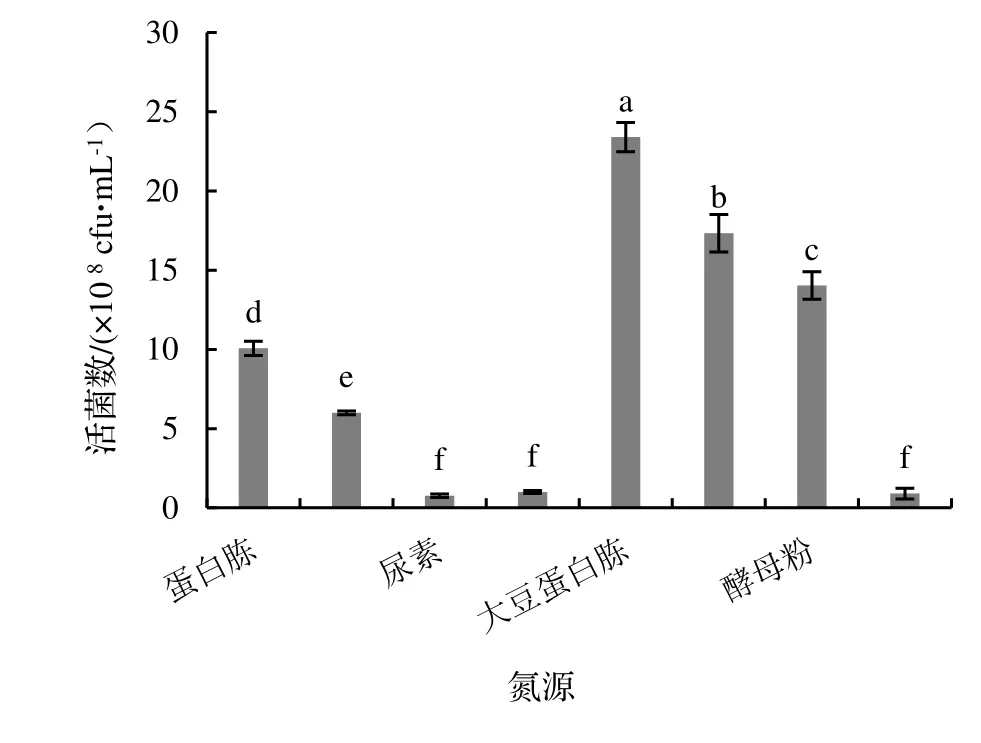
圖4 不同N 源培養基對菌株NJSZ-13 活菌數量的影響Figure 4 Effect of different nitrogen source in culture medium on viable count of strain NJSZ-13 in fermentation broth
2.2.3 培養基N 源的優化 由圖4 可知,蠟樣芽孢桿菌NJSZ-13 以不同的N 源為培養基成分時,對單位體積的活菌數量影響顯著(P<0.05)。其中,以大豆蛋白胨作為單一N 源時活菌數量最大,為17.3×108cfu·mL-1,其余N 源對單位體積的活菌數量的影響由大到小依次為玉米漿干粉、酵母粉、蛋白胨、牛肉浸膏、CK、硫酸銨和尿素,其中,大豆蛋白胨、玉米漿干粉、酵母粉、蛋白胨、牛肉浸膏是有機N 源,硫酸銨是無機N 源。從實驗結果可看出,蠟樣芽孢桿菌NJSZ-13 對大多數有機氮的利用遠遠超過對無機氮的利用,將無機氮作為單一N 源的時候單位體積發酵液的活菌數量甚至比不加N 源的CK 還低。有機N 源的成分相對豐富,不只是提供了N 源,還包含了C源和無機鹽,而無機N源的成分相對來說比較單一。因此,選擇大豆蛋白胨作為蠟樣芽孢桿菌NJSZ-13搖瓶發酵培養基的N 源。
2.2.4 N 源濃度的篩選 由圖5 可知,大豆蛋白胨濃度對蠟樣芽孢桿菌NJSZ-13 的活菌數量影響顯著(P<0.05)。在一定濃度范圍內,NJSZ-13 單位體積發酵液的活菌數量隨著大豆蛋白胨濃度的增加而增加,當大豆蛋白胨的濃度為12 g·L-1時,單位體積發酵液中的活菌數量達到最高值,為24.77×108cfu·mL-1。當濃度超過12 g·L-1時,隨著大豆蛋白胨濃度的增加,單位體積發酵液中的活菌數量反而隨之減少,所以選擇10,12,14 g·L-1這3 個濃度作為正交試驗N 源濃度的三個水平。
2.2.5 培養基無機鹽的優化 由圖6 可知,無機鹽種類對蠟樣芽孢桿菌NJSZ-13 單位體積發酵液的活菌數量影響顯著(P<0.05),以CaCl2為無機鹽時,NJSZ-13 對無機鹽的利用最好,單位體積發酵液的活菌數量達到最大值,為26.67×108cfu·mL-1,以ZnSO4,MnSO4,MgSO4為無機鹽時,單位體積發酵液的活菌數量都小于不加無機鹽的對照組。因此,選擇CaCl2作為蠟樣芽孢桿菌NJSZ-13 搖瓶發酵培養基的無機鹽。
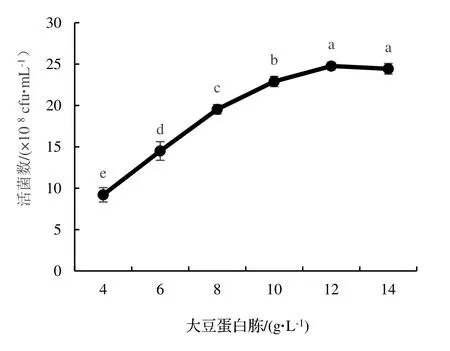
圖5 不同濃度大豆蛋白胨對菌株NJSZ-13 活菌數量的影響Figure 5 Effect of different concentrations of soy peptone in culture medium on viable count of strain NJSZ-13 in fermentation broth
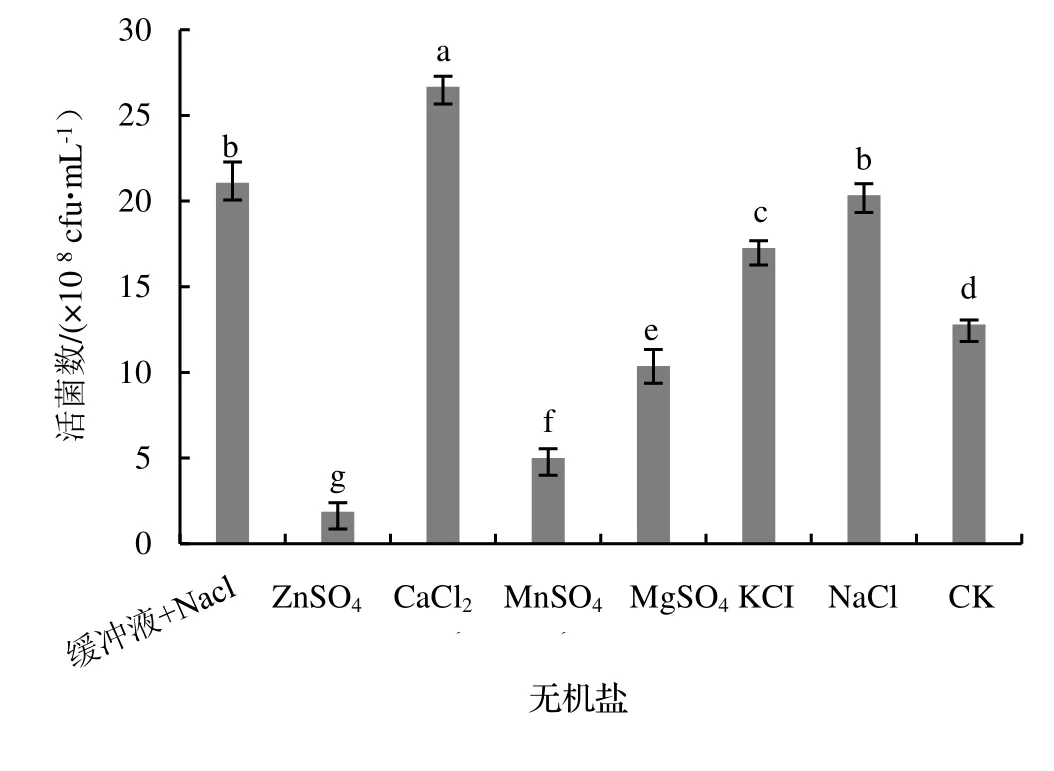
圖6 無機鹽種類對菌株NJSZ-13 活菌數量的影響Figure 6 Effect of inorganic salt types in culture medium on viable count of strain NJSZ-13 in fermentation broth
2.2.6 無機鹽濃度的篩選 不同濃度 CaCl2對菌株NJSZ-13 活菌數量的影響見圖7。
由圖7 可知,向培養基中加入不同濃度的CaCl2對蠟樣芽孢桿菌菌株NJSZ-13 的活菌數量影響顯著(P<0.05),培養基中添加的CaCl2濃度越高,菌株NJSZ-13 在發酵液中的生長情況越好,對CaCl2的利用越好,單位體積發酵液中的含菌量也越高,在CaCl2濃度為6 g·L-1或者7 g·L-1時,單位體積發酵液中的活菌數量之間沒有顯著性差異(P>0.05),但是濃度在7 g·L-1時的活菌數量最高,為28.4×108cfu·mL-1,因此,選擇5,6,7 g·L-1這3 個濃度作為正交試驗中CaCl2濃度的三個水平。
2.3 培養基正交優化試驗
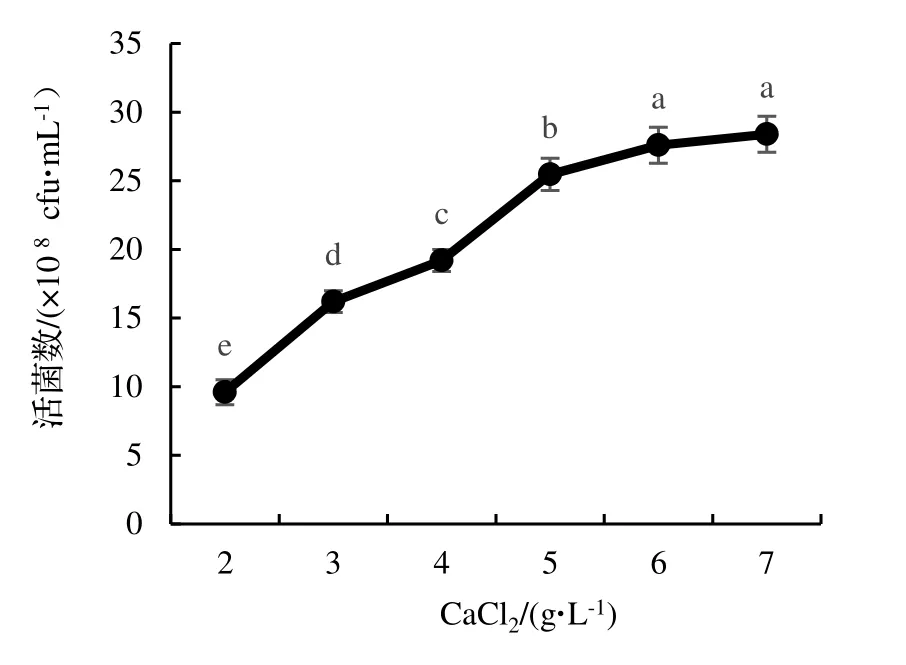
圖7 不同濃度CaCl2 對菌株NJSZ-13 活菌數量的影響Figure 7 Effect of different concentration of CaCl2 in culture medium on viable count of strain NJSZ-13 in fermentation broth
由圖8 可知,培養基C 源可溶性淀粉、N 源大豆蛋白胨及無機鹽CaCl2不同濃度比對菌株NJSZ-13 活菌數量影響差異顯著(P<0.05),正交試驗結果通過極差分析可知(表3),N 源大豆蛋白胨對蠟樣芽孢桿菌NJSZ-13 單位體積發酵液中的的活菌數量影響最大,其次是無機鹽CaCl2,C 源可溶性淀粉,對應的組合為4號培養基A2B1C2,其單位體積發酵液中的活菌數量為37.00×108cfu·mL-1。因此,確定蠟樣芽孢桿菌NJSZ-13 的發酵培養基配方為可溶性淀粉10 g·L-1,大豆蛋白胨14 g·L-1,CaCl26 g·L-1。
2.4 搖瓶發酵條件優化
2.4.1 發酵溫度的優化 由圖9 可知,不同溫度下搖瓶發酵得到的單位體積蠟樣芽孢桿菌NJSZ-13 活菌數量差異顯著(P<0.05),在28℃時搖瓶得到發酵液中最大單位體積的活菌數量,為35.80×108cfu·mL-1,當溫度超過28℃時,隨著溫度的增加,發酵液中單位體積活菌數量急劇減少,特別是超過34℃以后,單位體積活菌數量比在28℃時培養的減少了大半,說明蠟樣芽孢桿菌NJSZ-13 的發酵培養溫度不適合超過34℃,其最適培養溫度為28℃。
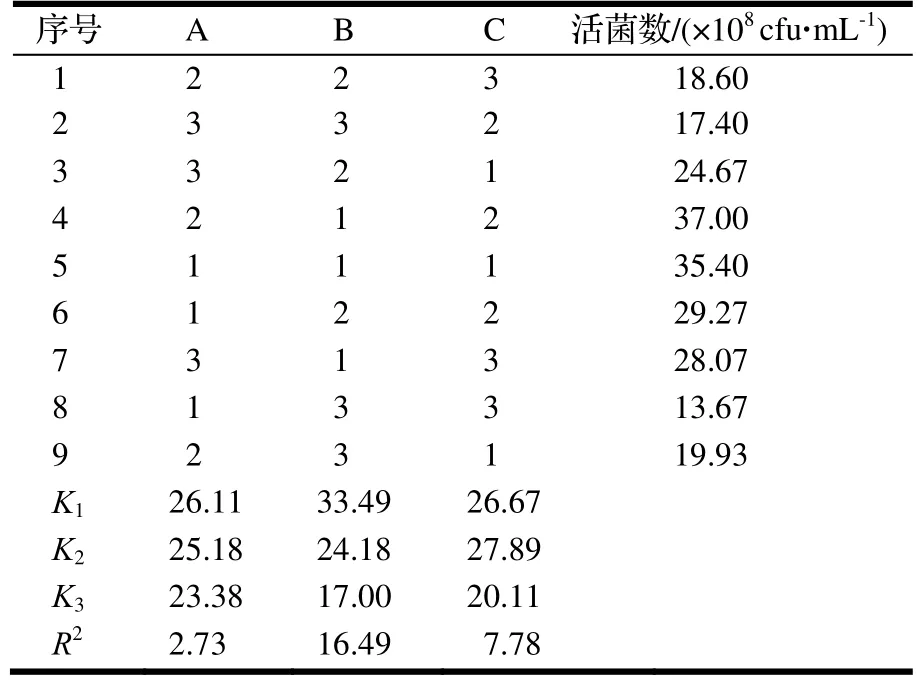
表3 正交試驗及結果Table 3 Orthogonal test and results

圖8 正交各組培養基對菌株NJSZ-13 活菌數量的影響Figure 8 Effect of orthogonal groups of medium on viable count of strain NJSZ-13 in fermentation broth
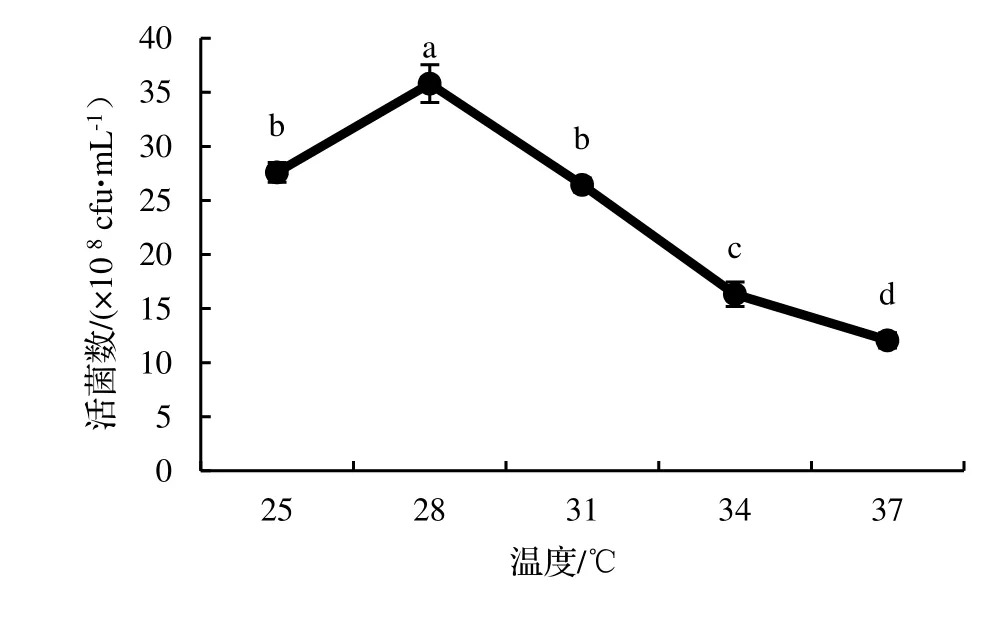
圖9 不同發酵溫度對菌株NJSZ-13 活菌數量的影響Figure 9 Effect of different fermentation temperature on viable count of strain NJSZ-13 in fermentation broth
2.4.2 發酵初始pH 的優化 由圖10 可知,培養基初始pH 在6.5~ 8.5,蠟樣芽孢桿菌菌株NJSZ-13 單位體積發酵液中的含菌量差異顯著(P<0.05),在發酵初始pH 7.5 時單位體積發酵液中的含菌量最高,其活菌數量為37.67×108cfu·mL-1,但是pH 在 8.0~ 8.5 時,菌株NJSZ-13 單位體積發酵液中的活菌數量雖然有差異,但活菌數量保持較高的水平,說明蠟樣芽孢桿菌菌株NJSZ-13 對pH 適應范圍較寬且更偏向弱堿性的生活環境,因此,選擇pH 7.5 為菌株NJSZ-13 搖瓶發酵的最佳初始pH 值。
2.4.3 發酵接種量的優化 由圖11 表明,不同接種量對發酵最終活菌數量的影響有顯著差異(P<0.05),在接種量為1%和2%時,對菌株NJSZ-13 單位體積發酵液中的活菌數量沒有顯著影響,但是在2%接種量時單位體積發酵液中的活菌數量達到最大值,為3.81×109cfu·mL-1,接種量超過2%時,隨著接種量的增加單位體積發酵液中的活菌數量逐漸降低,所以選擇2%為搖瓶發酵的最佳接種量。
2.4.4 發酵裝液量的優化 由圖12 表明,發酵裝液量對菌株NJSZ-13 活菌數量的影響差異顯著(P<0.05),在培養基為20%的裝液量時,單位體積發酵液中的活菌數量顯著高于其他裝液量的活菌數,其有效含菌量最高值為4.13×109cfu·mL-1,當裝液量超過30%時,隨裝液量的增加單位體積發酵液中的活菌數量顯著降低。但是考慮到發酵設備的空間充分利用,選擇30%作為搖瓶發酵的最佳裝液量。
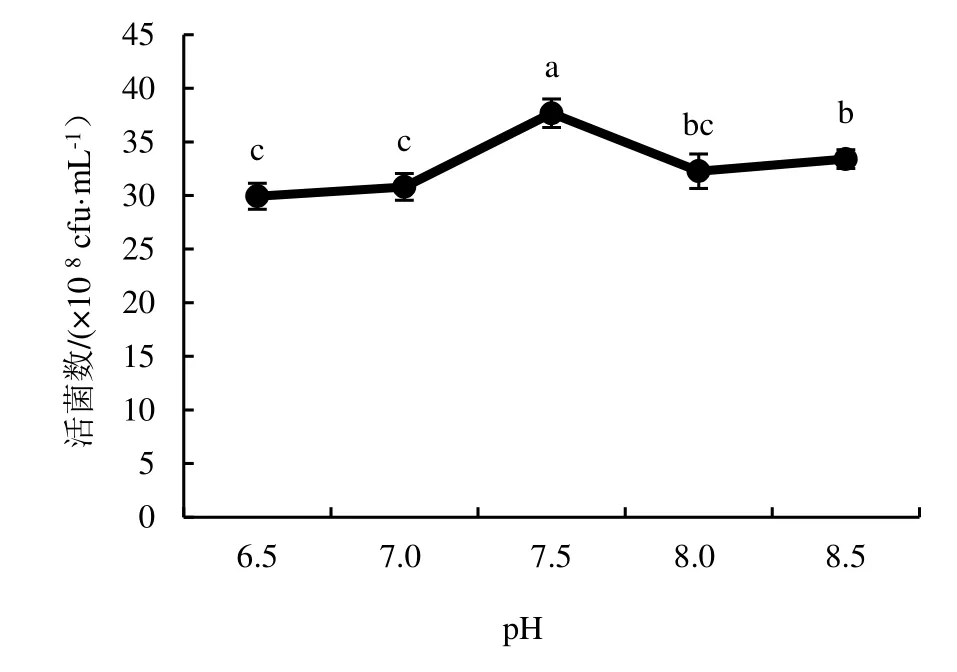
圖10 不同發酵初始pH對菌株NJSZ-13活菌數量的影響Figure 10 Effect of different initial pH of fermentation on viable count of strain NJSZ-13 in fermentation broth
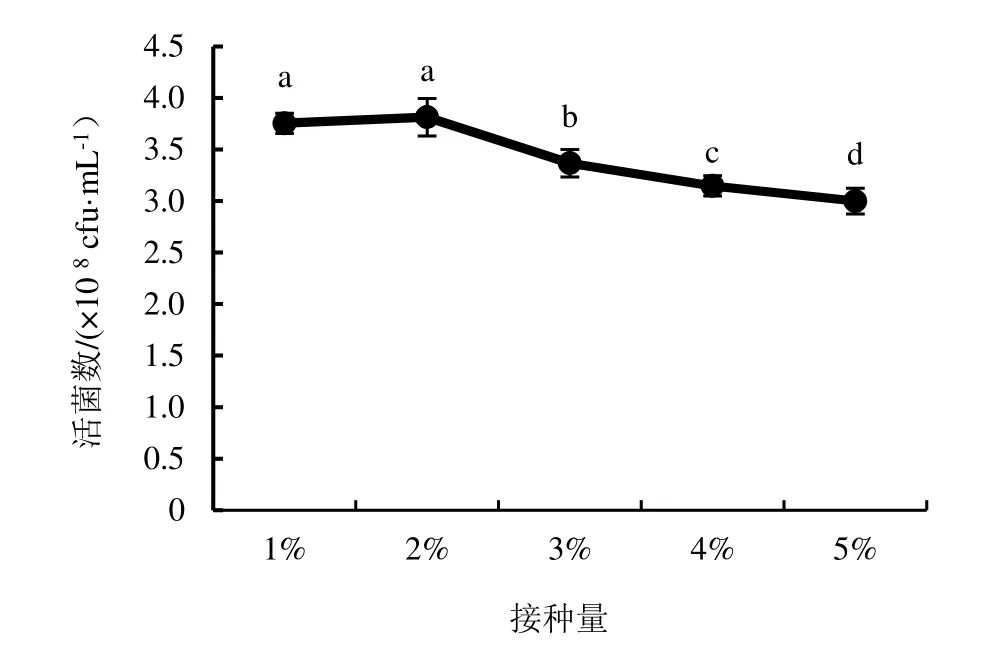
圖11 不同接種量對菌株NJSZ-13 活菌數量的影響Figure 11 Effect of different inoculum size on viable count of strain NJSZ-13 in fermentation broth
2.5 NJSZ -13 培養基優化前后的生長曲線與活菌數量對比
從圖13 可以看出,在0~ 4 h,蠟樣芽孢桿菌NJSZ-13處于延緩期。在4 h 以后開始進入指數期,但是在指數期間,使用優化前的培養基即3 號培養基進行搖瓶培養的指數期為4~ 24 h,優化后的培養基培養指數期為4~ 30 h,相較優化前的條件指數期延長了6 h,使得菌體在這個階段呈現了倍數增長,在30 h 以后才進入穩定期。使用優化后的培養基和培養條件進行搖瓶發酵,24 h 后取樣稀釋涂布,優化后單位體積發酵液中的活菌數量平均值為4.10×109cfu·mL-1,是原始發酵培養液的4.1 倍(表4)。
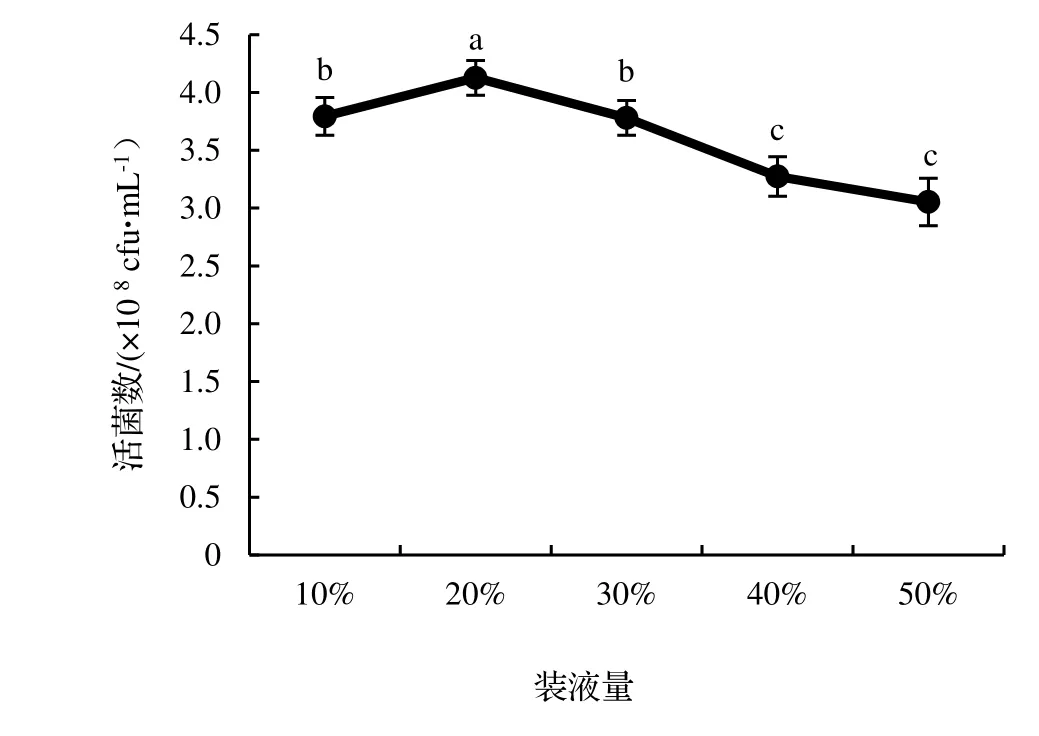
圖12 不同裝液量對菌株NJSZ-13 活菌數量的影響Figure 12 Effect of different liquid volume on viable count of strain NJSZ-13 in fermentation broth

表4 菌株NJSZ-13 搖瓶發酵優化前后的活菌數量Table 4 The viable count before and after optimization of culture
3 結論與討論
3.1 結論
本試驗通過單因素試驗篩選出了蠟樣芽孢桿菌NJSZ-13 發酵培養基的最適C 源為可溶性淀粉,最適N 源為大豆蛋白胨,最適無機鹽為CaCl2。應用正交試驗確定了培養基的最佳配比:可溶性淀粉10 g·L-1,大豆蛋白胨14 g·L-1,CaCl26 g·L-1。在此基礎上,單因素優化獲得了最佳發酵條件:發酵溫度為28℃,發酵初始pH 值為7.5,接種量為2%,裝液量為30%。使用優化后的培養基和培養條件進行搖瓶發酵,延長了發酵過程的指數期,使得菌體在這個階段呈現了倍數增長,單位體積發酵液中的活菌數量達到4.10×109cfu·mL-1,是原始發酵培養液單位體積活菌數量的4.1 倍。
3.2 討論
對于在工業生產中具有開發潛力及利用價值的菌株,通常要先對其發酵條件進行優化以達到菌體富集的目的。除了受到自身代謝調控的影響外,芽孢桿菌的發酵液活菌數量還會受外界環境條件(主要是發酵培養基成分、濃度和發酵條件)的影響。在工業化發酵生產中,溫度是影響菌體生長繁殖的一個重要因素,溫度過低影響菌體的代謝從而影響它的生長,溫度升高可以增加菌體內酶的反應速率從而提高代謝,但溫度過高時又會抑制菌體生長甚至使菌體失活;適度的酸堿環境及溶氧量是滿足微生物生長、繁殖及產生次級代謝產物的基本要求;較大的接種量可以使菌體快速進入生長指數期,縮短發酵周期,但是接種量過大容易造成營養消耗快,菌體營養供應不上,影響菌體的生長和芽孢的形成。因此對微生物進行富集培養通常對其發酵培養基成分和條件優化。
為了環境保護,減少松材線蟲病防治中對化學藥品的依賴,國內已有多名研究者從生物防治角度篩選獲得對松材線蟲有毒殺活性的芽孢桿菌菌株[15-17]。在微生物發酵產品產業化中的首要環節就是發酵工藝的優化,目前有很多實驗技術和試驗設計方法應用于發酵工藝的優化。已有研究表明,張慧等[18]對枯草芽孢桿菌(B.subtilis)CS27 液體發酵條件進行優化后單位體積發酵液中的細胞生物量達到1.75×109cfu·mL-1,廣澤宇等[19]對生防蠟樣芽孢桿菌BQ-4 發酵培養基優化后單位體積發酵液中的的細胞生物量達到2.936×109cfu·mL-1。本試驗選用的蠟樣芽孢桿菌NJSZ-13 已經證實了對松材線蟲有殺線蟲效果[13]。為了將該菌株用于生產,提高菌株的利用價值,對該菌株進行了發酵參數優化。蠟樣芽孢桿菌NJSZ-13 單位體積發酵液中的活菌數量除了受自身代謝的影響外,外界環境條件(培養基成分,發酵過程參數)也是重要因素。為了使蠟樣芽孢桿菌NJSZ-13 盡快結束生長遲緩期進入對數期,同時延長穩定期,以提高單位體積發酵液中的菌體濃度,對其培養基和發酵條件進行了優化。本試驗先是通過單因素試驗篩選培養基碳源、氮源和無機鹽,接著利用三因素三水平正交試驗進行優化,在保證準確性的前提下,減少了試驗次數,縮短了周期。相比劉瑩瑩等[20]對兩株生防菌株芽孢桿菌 STW-2 和 STW-64 進行發酵條件優化和王勇等[21]對解淀粉芽孢桿菌B.amyloliquefaciensGZ-5 發酵條件中以OD600為優化參數,本文以單位體積發酵菌體的活菌數量為優化參數具有更直接更準確的效果。

