血清微小RNA-106b-5p、RNA-30a-5p水平與結直腸癌患者預后的關系及其診斷價值
張煌,魯恒珍,周帥躍,鄭華理,朱愛萍
結直腸癌是消化系統常見的惡性腫瘤,發病率和病死率僅次于胃癌,嚴重威脅人民身體健康及生命安全。近年來,受飲食結構、生活方式改變等諸多因素影響,我國結直腸癌發病率呈逐年上升趨勢[1]。結直腸癌早期發病癥狀隱匿,不易被察覺,大多數患者就診時已處于中晚期并伴有遠處轉移,錯過了最佳手術治療時機,導致患者5年生存率低、預后差[2]。尋找有效的輔助預測結直腸癌預后并具有診斷價值的血清標志物,對提高患者生存率、改善患者預后具有積極意義。微小RNA(microRNA,miR)是一類高度保守的非編碼小RNA,參與調節多種生理過程。因其在血液、尿液及腦脊液等體液中的穩定性較好,miR已被證實具有成為多種疾病血清生物標志物的潛能,也是目前腫瘤研究領域的熱點[3]。miR-106b-5p具有調控腫瘤細胞增殖、侵襲、遷移等功能[4];miR-30a-5p與多種惡性腫瘤發生發展密切相關[5],可能通過多種途徑發揮抑癌功能,但miR-106b-5p、miR-30a-5p在結直腸癌中的意義尚不十分明確。現分析結直腸癌患者血清miR-106b-5p、miR-30a-5p檢測的應用價值,為臨床提供依據,報道如下。
1 資料與方法
1.1 臨床資料 選取2013年1月—2014年12月安徽省安慶市第一人民醫院腫瘤科手術治療的結直腸癌患者(結直腸癌組)、門診確診的結直腸腺瘤患者(結直腸腺瘤組)和同期健康體檢者(健康對照組)作為研究對象,各90例。結直腸癌組男53例,女37例,年齡42~73(45.13±7.58)歲,≤60歲56例,>60歲34例;腫瘤直徑:<5 cm 46例,≥5 cm 44例;腫瘤分化程度:中高分化 60例,低分化30例;腫瘤浸潤深度:T1+T2 57例,T3+T4 33例;有淋巴結轉移49例,無淋巴結轉移41例;有遠處轉移患者57例,無遠處轉移患者33例;臨床分期:Ⅰ+Ⅱ期65例,Ⅲ+Ⅳ期25例。結直腸腺瘤組男49例,女41例,年齡41~74(44.98±6.95)歲,≤60歲54例,>60歲36例;患者均無惡性腫瘤、家族性息肉病及潰瘍性結腸炎等結直腸疾病。健康對照組男54例,女36例,年齡43~75(45.64±6.73)歲,≤60歲52例,>60歲38例;納入健康體檢者均無惡性腫瘤、肝腎疾病及其他嚴重疾病史。3組研究對象的性別、年齡比較,差異無統計學意義(P>0.05),具有可比性。本研究經醫院醫學倫理委員會核準,患者及家屬知情同意并簽署知情同意書。
1.2 病例選擇標準 (1)納入標準:①完整的病歷資料及術后隨訪資料;②術后經病理組織學確診;③卡氏(Karnofsky)評分≥70分。(2)排除標準:①結直腸癌復發病例;②合并家族性腺瘤性息肉病;③合并胃癌等其他惡性腫瘤;④合并免疫系統、血液系統等疾病;⑤合并糖尿病等慢性疾病。
1.3 觀察指標與方法
1.3.1 樣本采集: 結直腸癌組于術前1天、結直腸腺瘤組于確診后次日、健康對照組于體檢時,抽取所有研究對象的空腹外周靜脈血5 ml,在4℃時離心收集上層血清,置于-80℃冰箱保存備用。
1.3.2 血清miR-106b-5p、miR-30a-5p表達檢測:血清樣本中加入cel-miR-39(終濃度500 fmol/ml,購自美國ABI公司),RNA提取試劑盒(購自南京諾唯贊生物科技有限公司)提取血清總RNA,微量紫外分光光度計(Nanodrop 1000,美國賽默飛世爾科技公司)檢測RNA濃度及純度,TaqMan miR逆轉錄試劑盒(美國ABI公司)進行逆轉錄反應,miRNA特異性TaqMan miR試劑盒(美國ABI公司),7500實時熒光定量PCR儀(美國ABI公司)進行TaqMan real-time PCR檢測;每個樣本設置3個復孔,采用2-△△Ct計算miRNA相對表達量。引物序列(由上海生工生物工程股份有限公司設計)如下,miR-106b-5p正向引物5’-TGCGGCAACACCAGTCGA TGG-3’,反向引物5’-CCAGTGCAGGGTCCGAGGT-3’;miR-30a-5p正向引物5’-CACTCTCATGTAAACATCCTCGAC-3’,miR-30a-5p反向引物5’-TATGGTTGTTCTGCTCTCTGTGTC-3’;正向引物5’-CAGAGTCACCGGGTGTAAAT,內參cel-miR-39反向引物5’-CCAGTGCGTGTCGTGGAGTC-3’。

2 結 果
2.1 3組血清miR-106b-5p、miR-30a-5p表達水平比較 血清miR-106b-5p相對表達量比較,結直腸癌組>結直腸腺瘤組>健康對照組(P均<0.01);血清miR-30a-5p相對表達量比較,結直腸癌組<結直腸腺瘤組<健康對照組(P均<0.01),見表1。

表1 3組血清miR-106b-5p、miR-30a-5p相對表達水平比較
2.2 結直腸癌患者血清miR-106b-5p、miR-30a-5p表達水平在不同臨床病理特征中比較 結直腸癌患者血清miR-106b-5p水平在不同性別、年齡、腫瘤位置、分化程度及浸潤深度方面比較,差異無統計學意義
(P均>0.05),而在不同腫瘤直徑、淋巴結轉移、遠處轉移及臨床分期方面比較,差異有統計學意義(P均<0.05);結直腸癌患者血清miR-30a-5p水平在不同性別、年齡、腫瘤位置、腫瘤直徑及遠處轉移方面比較,差異無統計學意義(P均>0.05),而在不同腫瘤分化程度、浸潤深度、淋巴結轉移及臨床分期方面比較,差異有統計學意義(P均<0.05),見表2。
2.3 結直腸癌患者血清miR-106b-5p、miR-30a-5p表達水平在不同預后情況中比較 以血清miR-106b-5p中位數(4.64)、miR-30a-5p中位數(0.39)分別為界,將結直腸癌患者分為高表達亞組(45例)和 低表達亞組(45例),Kaplan-Meier結果顯示,血清miR-106b-5p高表達亞組患者術后5年總生存率為22.22%(10/45),中位生存時間為(35.24±2.98)個月,低表達亞組為64.44%(29/45),中位生存時間為(44.47±3.19)個月,2亞組比較差異有統計學意義(χ2=11.449,P=0.001),見圖1。血清miR-30a-5p高表達亞組患者術后5年總生存率為60.00%(27/45),中位生存時間為(31.36±3.06)個月,低表達亞組為26.67%(12/45),中位生存時間為(46.89±2.75)個月,2亞組比較差異有統計學意義(χ2=12.613,P=0.000),見圖1。
2.4 結直腸癌患者血清miR-106b-5p、miR-30a-5p表達水平與預后的相關性 結直腸癌患者血清miR-106b-5p與患者預后呈負相關(r=-0.429,P=0.039), 血清miR-30a-5p表達水平與患者預后呈正相關(r=0.458,P=0.041)。

表2 血清miR-106b-5p、miR-30a-5p表達水平在不同臨床病理特征中比較
2.5 血清miR-106b-5p、miR-30a-5p表達水平診斷結直腸癌的價值 ROC分析結果顯示,miR-106b-5p、miR-30a-5p診斷結直腸癌的cut-off值分別為4.52、0.39,AUC為0.785、0.692、0.824,血清miR-106b-5p、miR-30a-5p聯合檢測對結直腸癌的診斷價值較大,AUC為0.824,見表3,圖2。
3 討 論
越來越多的研究發現,結直腸癌組織和細胞中存在異常表達的miR分子,如高表達的miR-19a-3p和低表達的miR-874[6-7],miR可通過轉錄后調控機制影響結直腸癌細胞的增殖、浸潤、侵襲等活動,參與結直腸癌的癌變、病情進展,且與結直腸癌患者預后密切相關[8-9]。癌胚抗原、糖類抗原19-9(CA19-9)等均是臨床上篩查結直腸癌的常用血清標志物,但由于上述指標在多種癌癥中亦有類似的變化,因此對患者預后預測特異性不高[10-12]。近年來,隨著miR研究深入,發現其不僅存在于細胞和組織中,在體液中也能穩定表達,血清miR在腫瘤預后預測及輔助診斷等方面具有重要作用[13-15]。
有研究表明,miR-106b在胃癌中表達增加,且促進細胞侵襲[16],發揮促癌功能,本研究也證實結直腸癌患者血清miR-106b-5p水平升高,且與腫瘤較大直徑、淋巴結轉移、遠處轉移及較晚臨床分期密切關聯,與以往研究證實的miR-106b-5p促進結直腸癌細胞增殖、侵襲的結論一致[17-19],而其他相關研究團隊則認
為miR-106b-5p表達降低,促進了結直腸癌細胞侵襲[20],以上研究結論相悖,筆者分析miR-106b呈現多種不同效應,可能與不同研究體系有關,后續需要從分子生物學層面深入探究miR-106b-5p在結直腸癌細胞侵襲過程的具體調控機制,以支持本研究結論。
miR-30家族中的miR-30a包含miR-30a-3p和miR-30a-5p 2個亞型,分別來源于miR-30a前體莖環的3’端和5’端。目前對miR-30a-5p的研究,大多集中在腫瘤細胞增殖、侵襲方面,miR-30a-5p定位于人類6號染色體q13,除被證實可作為炎性因子外[21-23],miR-30a-5p在不同類型腫瘤中表達趨勢并不一致,如在Li等[24]的研究中,miR-30a-5p通過調控Erk/Ets信號通路活性,抑制乳腺癌增殖、侵襲,而Jia等[25]發現miR-30a-5p在膠質瘤中具有促癌基因功能,可能與不同腫瘤具有特異分子生物機制有關,說明miR-30a-5p參與調控腫瘤的復雜性。目前關于miR-30a-5p在結直腸癌中表達意義的研究有限,本研究發現,與結直腸腺瘤患者、健康體檢者相比,結直腸癌患者血清miR-30a-5p表達降低,結合患者臨床病理特征發現,血清miR-30a-5p低表達與腫瘤組織低分化、較深浸潤深度、淋巴結轉移及較晚臨床分期關系緊密,上述結果表明miR-30a-5p低表達促進了結直腸癌癌變,并參與了腫瘤細胞去分化過程,如miR-30a-5p可通過作用于多種靶蛋白,對非小細胞肺癌等多種惡性腫瘤EMT過程產生抑制作用[26],而miR-30a-5p在結直腸癌中的分子調控機制,值得進一步探究。
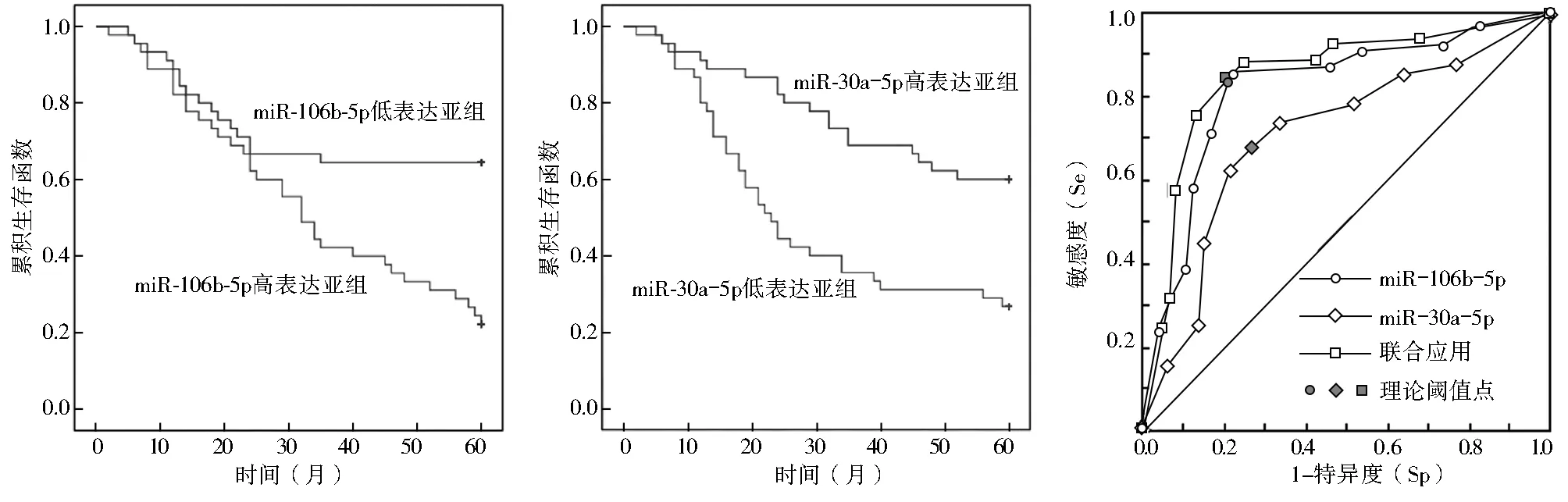

圖1 血清miR-106b-5p、miR-30a-5p表達水平在結直腸癌患者不同預后中比較 圖2 血清miR-106b-5p、miR-30a-5p表達水平診斷結直腸癌價值的ROC曲線圖

表3 血清miR-106b-5p、miR-30a-5p表達水平對結直腸癌診斷價值的ROC分析
對結直腸癌患者而言,腫瘤細胞浸潤侵襲,進而發生淋巴結轉移、遠處轉移是導致患者病情惡化、生存率低、預后差的重要因素。根據患者術后隨訪資料,繪制Kaplan-Meier生存曲線發現,血清miR-106b-5p高表達組、miR-30a-5p低表達組患者的預后均較差,術后5年生存率低且中位生存時間短,提示血清miR-106b-5p、miR-30a-5p可作為結直腸癌患者預后預測的分子標志物;ROC分析結果表明,血清miR-106b-5p、miR-30a-5p對結直腸癌均有較高的診斷價值,且二指標聯合檢測的敏感度、特異度明顯升高。活檢或術后的病理診斷是目前臨床上結直腸癌的主要診斷手段,同時輔以血清腫瘤標志物檢測,本研究結果表明,血清miR-106b-5p,miR-30a-5p檢測可用于結直腸癌患者的輔助診斷,減少患者篩查結直腸癌的負擔。但鑒于本研究為單中心回顧性研究,樣本量小,存在一定局限性,研究結論有待進一步證實。
綜上,結直腸癌患者血清miR-106b-5p呈現高表達、血清miR-30a-5p呈現低表達,且均與患者病情惡化進展、不良預后相關,檢測血清miR-106b-5p、miR-30a-5p水平或可作為輔助結直腸癌的預后預測和診斷的有效手段。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
張煌:提出研究方向、起草論文、撰寫論文;魯恒珍:數據收集和分析整理;周帥躍、鄭華理:實施研究過程,進行文獻調研與整理;朱愛萍:設計研究方案、研究思路、研究選題、修訂論文、論文終審

