利用水蘇糖的腸道細菌的分離鑒定及其利用特性研究
鄔佳穎,毛丙永,谷佳玉,崔樹茂,張秋香
(江南大學 食品學院,江蘇 無錫,214122)
人體腸道內定植著1014個微生物,包括1 000多個種[1],腸道菌群組成受到基因、飲食、疾病等多種因素的影響。水蘇糖天然存在于地黃或大豆中,是一種由半乳糖(α1→6)半乳糖(α1→6)葡萄糖(α1→2β)果糖組成的功能性低聚糖,具有預防齲齒、調節腸道菌群、緩解便秘、保護肝臟等功能[2-4]。水蘇糖不能被人體消化吸收,會直接進入大腸,有些腸道細菌能利用水蘇糖產氣[5],因此攝入過量水蘇糖可能會導致脹氣等不良反應。
目前關于腸道菌利用水蘇糖的相關研究較少。HAYAKAWA等在1990年研究大豆低聚糖對人類腸道菌群的影響時發現,實驗所用的125株腸道細菌中,包括雙歧桿菌屬、乳桿菌屬、多形桿狀菌屬、光崗菌屬、巨單胞菌屬、梭狀芽孢桿菌屬、克雷伯氏菌屬在內的7個屬的58株菌能夠利用水蘇糖[6]。WAGNER等[7]發現給大鼠飼喂水蘇糖后會產H2,但未研究是哪些菌利用水蘇糖產氣;ZHONG等[8]發現水蘇糖可以促進嗜酸乳桿菌CICC22162的生長;水蘇糖與棉籽糖結構類似,從自然發酵的綠桌橄欖中分離到的乳酸菌幾乎都能利用棉籽糖,其中81%的菌株也能發酵水蘇糖[9]。
本實驗從健康人糞便中篩選能夠利用水蘇糖的細菌,并結合培養液上清液中糖的組成、菌株產氣情況、酶活以及基因組草圖分析等,研究菌株對水蘇糖的利用特性,對于水蘇糖與人體健康關系的研究具有一定的指導意義。
1 材料與方法
1.1 實驗試劑
水蘇糖,上海源葉生物科技有限公司;棉籽糖,生工生物工程(上海)股份有限公司;酵母提取物、胰蛋白胨,英國Oxoid公司。
改良腸道微生物培養基(gut microbical culture medium,GMM):水蘇糖8 g,胰蛋白胨4 g,KH2PO42 g,酵母提取物2 g,NaCl 0.08 g,CaCl20.008 g,MgSO4·7H2O 0.002 g,FeSO4·7H2O 0.73 mg,吐溫-80 0.5 mL,L-半胱氨酸鹽酸鹽1 g,ATCC Trace Mineral Mix 10 mL,ATCC Vitamin Mix 10 mL。固體培養基在此基礎上加入1.5%~2.0%(質量分數)的瓊脂粉,并添加15 mL 0.5%(質量分數)的溴甲酚紫作為指示劑。
1.2 利用水蘇糖的腸道菌的分離與鑒定
采集2名健康成年人的新鮮糞便樣本,并將樣本懸浮在0.9%(質量分數)的生理鹽水中;梯度稀釋,將樣品涂布在以水蘇糖作為唯一碳源、并添加溴甲酚紫指示劑的GMM固體培養基上[10],置于厭氧工作站37 ℃培養24~48 h;挑取能使培養基變黃的菌落,轉接到GMM固體培養基上,劃線分離、純化菌株,并對菌株進行16S rRNA測序鑒定。
1.3 細菌培養上清液中水蘇糖的高效液相色譜分析
菌株在以水蘇糖作為唯一碳源的GMM培養基中37 ℃厭氧培養24 h,以8 000×g離心5 min收集上清液,采用高效液相色譜儀Water 1525測定上清液中水蘇糖的含量,外標法定量。色譜條件:采用SugarPak1糖柱(300 mm,id 3.5 μm),柱溫85 ℃,流動相為純水,流量為0.4 mL/min。
1.4 細菌利用水蘇糖生長的表征
將菌株接種于以水蘇糖作為唯一碳源的GMM培養基中,37 ℃厭氧培養,每隔1 h取樣,測定菌液的pH值和600 nm處的吸光度(OD600)。同時取1 mL待測菌液于1.5 mL離心管以8 000×g離心5 min,收集上清液備用。當菌株生長進入穩定期后,停止實驗。
1.5 α-半乳糖苷酶活力測定
α-半乳糖苷酶活力測定主要參照SCALABRINI等[11]的方法:經8 000×g離心5 min得菌泥和上清液,其中菌泥經檸檬酸-檸檬酸鈉緩沖液洗滌2次后重懸,與100 μL氯仿混合,振蕩破碎,制成粗酶液。將250 μL粗酶液或上清液與對硝基苯α-D-氨基半乳糖苷混合,在37 ℃下反應30 min,加入0.2 mol/L 500 μL Na2CO3溶液終止反應,測定420 nm下的吸光值。菌泥測定結果對應胞內酶活,上清液測定結果對應胞外酶活。
酶活定義:在測定條件下,1 min釋放1 μmol的對硝基苯酚所消耗的酶量(mL)為1個酶活力單位。
1.6 產氣實驗
將菌株以3%的接種量接種于裝有倒置杜氏小管的水蘇糖GMM培養基中,37 ℃厭氧培養24~48 h,觀察產氣情況并記錄。
1.7 基因組草圖的測定
將菌株以4%的接種量接種至5 mL MRS液體培養基中進行活化,置于厭氧工作站37 ℃恒溫培養24 h。活化2次的菌株以4%的接種量接種至裝有80 mL MRS液體培養基的藍蓋瓶中,置于厭氧工作站培養24~48 h。之后將菌液以8 000×g離心10 min得到菌泥,送至上海美吉生物醫藥科技有限公司進行基因組草圖測序。
采用Illumina HiSeq 2000(Illumina Inc USA)[11]測序平臺對送測菌株的基因組進行雙末端測序,獲得原始數據即大于基因組100倍的PE150測出數據量。然后對其堿基質量、堿基錯誤率、堿基分布進行質量控制,對低質量reads和adapter進行質量剪切,得到高質量的讀長數據。上述步驟均由上海美吉生物醫藥科技有限公司完成。
使用短序列組裝軟件SOAPdenovo2進行從頭組裝[12],調試不同K-mer值,選取N50較長和Scaffold數量較小的K-mer值進行拼接,同時調節-u、-r、-R、-F等參數,獲得初步組裝結果。基于reads的paired-end和overlap關系,將reads對比到contigs上,獲得最終組裝結果。調用Gap Closer軟件填補contigs間的內部空白[13],過濾500 bp讀長以下的結果,獲得完整序列。
采用GeneMark1.1[14]和Glimmer3.02[15]軟件預測送測菌株草圖序列中的蛋白質編碼基因,已默認參數獲取開放閱讀框(open reading frame,ORF)的相關信息。在預測得到的編碼基因基礎上進行基因的功能注釋,將草圖基因的蛋白質序列與各大數據庫進行對比,保留前5條序列相似性較高的結果,獲得相應的功能注釋信息,以此初步確定該蛋白序列與數據庫中的蛋白質具備相似的功能。上述步驟均由上海美吉生物醫藥科技有限公司完成。本實驗主要使用的是京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)的數據庫,該數據庫包括了完整或部分測序基因組的序列、細胞生化過程的圖解以及酶分子、酶反應等信息[16]。
1.8 SignalP 5.0預測信號肽
在SignalP 5.0軟件中輸入菌株基因片段的氨基酸或核酸序列,選擇物種(革蘭氏陽性菌或革蘭氏陰性菌)后,系統將對其進行信號肽預測。結果以圖表形式呈現,根據出現Sec信號肽(Sec/SPI)、脂蛋白信號肽(Sec/SPII)、Tat信號肽(Tat/SPI)或無信號肽(other)的概率來確定測試基因片段是否存在信號肽。
1.9 數據分析
實驗中pH值、OD600、糖含量與酶活力的測定均為3次平行,結果以平均值±標準差表示,采用Origin 9.0作圖。
2 結果與分析
2.1 能利用水蘇糖的腸道細菌的分離與鑒定
腸道細菌利用水蘇糖會產酸,使指示劑變色。根據指示劑變色結果,并結合16S rRNA測序鑒定,從糞便樣品中初步鑒定出23株能利用水蘇糖的細菌,包括6個屬、8個種(表1)。

表1 健康成年人糞便中分離到的能利用水蘇糖的細菌Table 1 The intestinal bacteria capable of utilizing stachyose isolated from the feces of healthy adults
由于實驗所使用的水蘇糖純度僅為85%,試劑中含有的其他成分也可能被菌株利用,因此進一步采用高效液相色譜法測定菌株上清液中水蘇糖的含量,根據水蘇糖的消耗量確定能夠利用水蘇糖的細菌。結果表明,實際能利用水蘇糖的細菌有12株,包括3個屬、4個種,分別為肺炎克雷伯氏菌、屎腸球菌、糞腸球菌和產氣莢膜梭狀芽孢桿菌(表2)。
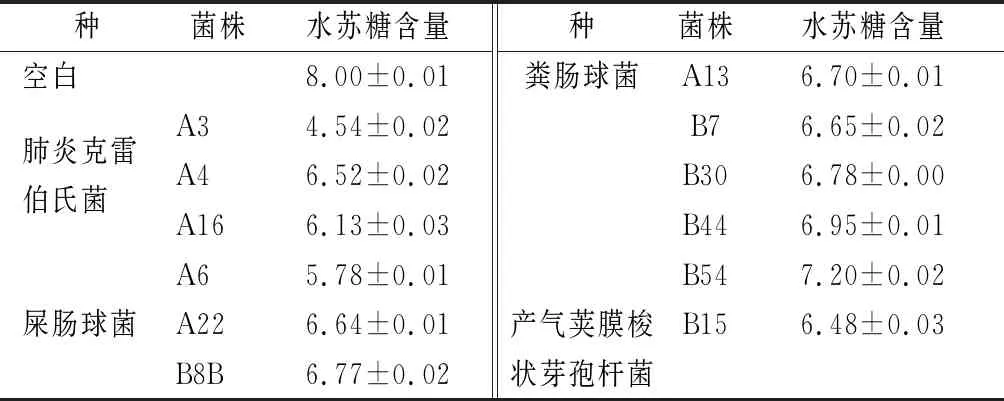
表2 細菌培養上清液中水蘇糖含量的測定 單位:g/L
已有文獻報道短雙歧桿菌、發酵乳桿菌、羅伊氏乳桿菌、肺炎克雷伯氏菌等多種菌株能夠利用水蘇糖[17-18],而屎腸球菌、糞腸球菌和產氣莢膜梭狀芽孢桿菌利用水蘇糖的研究為首次報道。在BARBARA等[18]的實驗中,屎腸球菌并不能利用水蘇糖,而本實驗成功篩選到多株能夠利用水蘇糖生長的屎腸球菌(A6、A22、B8B)。
2.2 腸道菌在GMM培養基中的生長曲線
為研究篩選出來的腸道菌對水蘇糖的利用情況,從4種菌中各選1株測定其在以水蘇糖作為唯一碳源的GMM培養基中的生長曲線(圖1)。各菌株以相同的接種量、相同的培養條件進行生長,呈現出不同的生長情況。肺炎克雷伯氏菌A3生長最快,在3 h左右進入穩定期,培養至5 h結束實驗;屎腸球菌A6、糞腸球菌A13、產氣莢膜梭狀芽孢桿菌B15在培養5 h后進入穩定期,培養至8 h結束實驗。進入穩定期后,4株菌的上清液pH值為4.40~5.40,A6、A13和B15的OD600達到1.30以上。

A-肺炎克雷伯氏菌A3;B-屎腸球菌A6;C-糞腸球菌A13;D-產氣莢膜梭狀芽孢桿菌B15圖1 菌株在以水蘇糖作為唯一碳源的GMM培養基中的生長曲線Fig.1 The growth curves of the strains in GMM medium with stachyose as the sole carbon source
2.3 腸道菌培養上清液中水蘇糖及棉籽糖含量測定
由圖1可知,不同菌株對水蘇糖的利用情況不同。采用高效液相色譜跟蹤測定菌株培養上清中的水蘇糖和棉籽糖含量,發現所有菌株的上清液中水蘇糖的含量隨時間增長而減少(表3、表4),而棉籽糖含量的變化并不相同。其中,屎腸球菌A6和糞腸球菌A13的棉籽糖含量逐漸增加;而產氣莢膜梭狀芽孢桿菌B15上清液中的棉籽糖含量逐漸減少;肺炎克雷伯氏菌A3生長較快,棉籽糖含量呈現先增加后減少的趨勢(表4)。
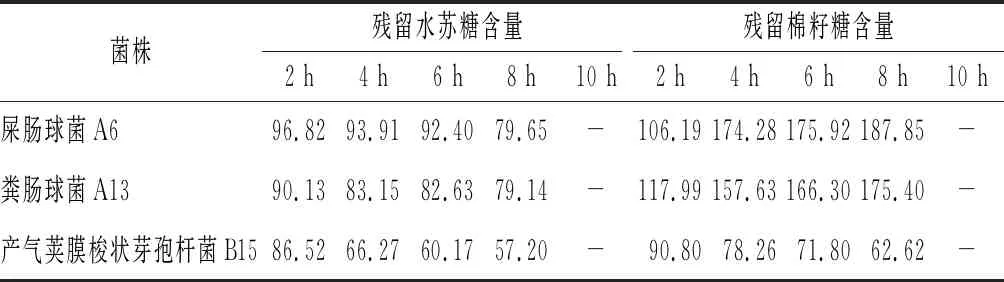
表3 不同時間菌株上清液中殘留糖含量 單位:%

表4 不同時間肺炎克雷伯氏菌A3上清液中殘留糖含量 單位:%
2.4 腸道菌α-半乳糖苷酶活力測定
細菌水解水蘇糖需要α-半乳糖苷酶,根據酶所處位置(胞外、胞內),可以進一步推斷其利用機制。選擇穩定期的菌株進行酶活測定,由表5可知,肺炎克雷伯氏菌A3具有較高的胞外α-半乳糖苷酶活力,是胞內酶活力的20倍;屎腸球菌A6、糞腸球菌A13的胞內酶活力較高,是胞外酶活力的30~40倍;產氣莢膜梭狀芽孢桿菌B15的胞內酶活力也較胞外酶活力高。由此可見,肺炎克雷伯氏菌A3的α-半乳糖苷酶以胞外為主,其余3株菌的α-半乳糖苷酶以胞內為主。α-半乳糖苷酶大多存在于細菌細胞內,除肺炎克雷伯氏菌A3外,實驗結果基本與報道符合[19-20]。

表5 α-半乳糖苷酶酶活力測定 單位:U/L
2.5 菌株利用水蘇糖產氣情況
水蘇糖進入人體后不被小腸消化吸收,可以達到大腸被腸道細菌發酵。攝入高劑量的水蘇糖,可能會出現腸胃脹氣、腹瀉、消化不良等不適反應[21-22]。我們對篩選出的12株菌進行了產氣實驗,實驗結果如表6所示,5株菌能夠利用水蘇糖產氣,分別為肺炎克雷伯氏菌A3、A4、A16、屎腸球菌B8和產氣莢膜梭狀芽孢桿菌B15,而其余7株不能產氣。其中,產氣莢膜梭狀芽孢桿菌B15產氣最明顯,杜氏小管被氣泡充滿。氣體的產生能為產氣莢膜梭狀芽孢桿菌提供一個良好的厭氧環境,有助于它的生長[23]。

表6 不同菌株在以水蘇糖作為唯一碳源的GMM培養基中的 產氣情況Table 6 Gas production of different strains in GMM medium with stachyose as the sole carbon source
腸道中的氣體主要有N2、O2、CO2、H2、CH4以及各種痕量氣體(如H2S、NO等)[24]。腸道菌發酵糖類產生的氣體主要有兩種:一是CO2,由戊糖磷酸途徑代謝6-磷酸葡萄糖產生;二是H2,由丙酮酸脫羧過程產生。丙酮酸脫羧產氫也可分為梭狀芽孢桿菌型和腸桿菌型[25]。在梭狀芽孢桿菌型中,丙酮酸脫羧后形成焦磷酸硫胺素(thiamine pyrohosphate,TPP)-酶復合物,該復合物將電子轉移給鐵氧還蛋白(ferredoxin,Fd),還原型的Fd被氫化酶氧化并產生H2;在腸桿菌型中,丙酮酸轉化為甲酸,通過甲酸裂解以及Fd氧化釋放CO2和H2[26]。研究實驗菌株產氣所涉及的酶系,需要結合基因組數據進行分析。
2.6 基因組草圖分析
對屎腸球菌A6、糞腸球菌A13、產氣莢膜梭狀芽孢桿菌B15、肺炎克雷伯氏菌A3進行基因組草圖測序,4株菌的基因組草圖數據已經上傳至NCBI的SRA數據庫,結果如表7所示。屎腸球菌和糞腸球菌的GC含量均在38%左右,與文獻報道相符[27-28]。產氣莢膜梭狀芽孢桿菌B15的GC含量約為39%,基因數量最少;肺炎克雷伯氏菌A3在4株菌中GC含量最高。
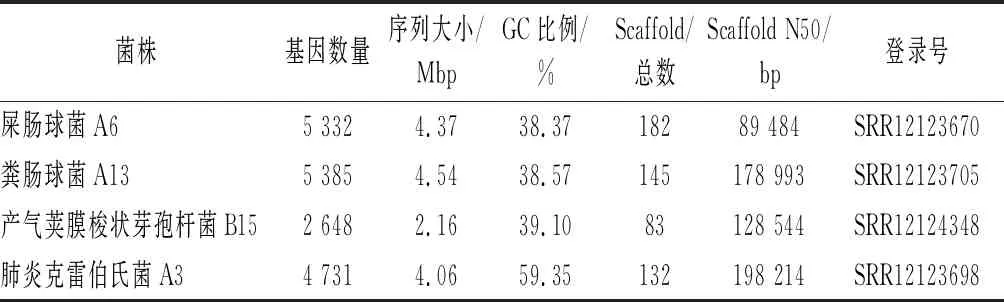
表7 細菌的基因組草圖信息Table 7 Bacterial genome sketch information
送測基因組草圖的菌株中,肺炎克雷伯氏菌A3和產氣莢膜梭狀芽孢桿菌B15均能利用水蘇糖產氣。已有研究表明,肺炎克雷伯氏菌等兼性厭氧菌在產氣過程中,通過丙酮酸甲酸裂解酶將丙酮酸轉化為甲酸,再由甲酸裂解酶系統的多酶復合物分解甲酸產氫[29]。一般來說,甲酸裂解酶是由甲酸脫氫酶-H、氫化酶以及電子載體組成的復合物[30]。甲酸裂解酶-H的大亞基由fdh基因編碼表現出催化性質,而其余部分是由hcyBCDEFG編碼起還原氫分子的作用[31];hypABCDE編碼合成氫化酶[32];fhlA作為決定性基因,是中央調節因子[33]。肺炎克雷伯氏菌A3的基因組草圖數據中能夠找到上述相關基因片段(圖2)。

A-氫化酶以及電子載體部分基因片段;B-甲酸脫氫酶-H大亞基部分基因片段圖2 肺炎克雷伯氏菌A3中與產氣相關的基因簇Fig.2 Gene clusters related to gas production in Klebsiella pneumoniae A3注:圖譜上箭頭的長度和方向分別代表了基因的長度和編碼方向;如果出現基因上下錯開的情況,說明該基因與上游或下游基因有重疊(下同)
產氣莢膜梭狀芽孢桿菌產氫途徑是梭狀芽孢桿菌型,產氫過程主要涉及丙酮酸脫氫酶復合物。在銅綠假單胞菌中該復合物由調節基因(pdhR),丙酮酸脫氫酶E1(aceE),二氫脂酰胺乙酰轉移酶E2(aceF)和二氫脂酰胺脫氫酶E3(lpd)構成[34]。產氣莢膜梭狀桿菌B15存在類似的基因片段(圖3),由丙酮酸脫氫酶E1的α-亞基(pdhA)、丙酮酸脫氫酶E1的β-亞基(pdhB),二氫脂酰胺乙酰轉移酶E2(aceF)和二氫脂酰胺脫氫酶E3(lpd)構成。丙酮酸脫氫酶復合物在TPP作用下,將丙酮酸轉化為乙酰輔酶A并釋放CO2,并在由por基因編碼的丙酮酸鐵氧還蛋白還原酶作用下將Fe3+轉化為Fe2+,Fe2+又被氫化酶氧化釋放H2。

圖3 產氣莢膜梭狀芽孢桿菌B15中丙酮酸脫氫酶 復合物基因片段Fig.3 Gene fragment of pyruvate dehydrogenase complex in Clostridium perfringens B15
菌株徹底代謝水蘇糖需要α-半乳糖苷酶、β-呋喃果糖苷酶以及相關轉運蛋白[35]。ALEXANDER等[36]研究了變異鏈球菌中多糖代謝(msmEFGK)轉運體,擁有msmEFGK轉運體的變異鏈球菌能夠轉運代謝蜜二糖、棉籽糖、水蘇糖、異麥芽糖、異麥芽糖醇(圖4),缺失msmE基因時,菌株不能利用棉籽糖或水蘇糖。aga、galA、melA等基因能夠編碼合成α-半乳糖苷酶參與水蘇糖的水解,當水蘇糖被α-半乳糖苷酶水解后2個半乳糖就生成了蔗糖[35,37]。據報道,代謝蔗糖的基因簇由5個基因組成,包括sacK(果糖激酶)、PTS(PTS轉運系統)、sacA(β-呋喃果糖苷酶)、sacR(轉錄調節蛋白)以及agl(α-葡萄糖苷酶)[38]。

圖4 變異鏈球菌msmEFGK轉運體攝取碳水化合物Fig.4 Carbohydrate uptake by msmEFGK transporters in Streptococcus mutans
通過分析菌株的基因組草圖,發現產氣莢膜梭狀芽孢桿菌B15中與水蘇糖利用相關的基因與變異鏈球菌相似[36](圖4)。與變異鏈球菌相比,產氣莢膜梭狀芽孢桿菌B15缺少msmK基因,但轉運水蘇糖的功能并未受到影響,因此依靠msmEFG基因也能轉運水蘇糖。產氣莢膜梭狀芽孢桿菌B15利用msmEFG轉運體轉運水蘇糖,由galA基因編碼的α-半乳糖苷酶將其水解為2分子半乳糖和1分子蔗糖。由dexB(α-葡萄糖苷酶)、scrA(PTS系統)、sacA(β-呋喃果糖苷酶)、scrR(轉錄調節因子)、scrK(果糖激酶)構成的基因簇負責水解蔗糖并用于后續代謝(圖5)。

圖5 產氣莢膜梭狀芽孢桿菌B15中與水蘇糖利用 相關的基因簇Fig.5 Gene clusters related to stachyose utilization in Clostridium perfringens B15
屎腸球菌A6和糞腸球菌A13在糖組成分析、α-半乳糖苷酶活力測定以及與水蘇糖代謝相關的基因方面均呈現出一定的相似性(圖6-A、圖6-B),表明2株菌可能采用相同的方式利用水蘇糖。通過查閱《伯杰氏系統細菌學手冊》(《Bergey′s Manual of Systematic Bacteriology》),發現屎腸球菌和糞腸球菌不能利用棉籽糖[39]。高效液相色譜結果顯示屎腸球菌A6和糞腸球菌A13在生長過程中上清液中的棉籽糖含量增加(表3),表明屎腸球菌A6和糞腸球菌A13均不能利用棉籽糖,這種現象與保加利亞乳桿菌利用乳糖的情況類似。保加利亞乳桿菌中存在乳糖/半乳糖逆向轉運系統(圖6-C),乳糖通過lacS基因編碼的乳糖通透酶進入細胞內被水解成葡萄糖和半乳糖,葡萄糖被代謝利用,而游離的半乳糖則被釋放到細胞外[40]。屎腸球菌A6、糞腸球菌A13都有一段連續的galA、msmE、msmF、msmG基因,可能通過msmEFG轉運體將水蘇糖轉運胞內,由galA基因編碼的α-半乳糖苷酶將水蘇糖水解為半乳糖和棉籽糖,再將不能利用的棉籽糖釋放到細胞外。而負責轉運棉籽糖至胞外的轉運蛋白,目前尚不清楚,需要進一步研究。

A-屎腸球菌A6;B-糞腸球菌A13;C-乳糖/半乳糖逆向轉運系統圖6 屎腸球菌A6、糞腸球菌A13中水蘇糖利用 相關基因及保加利亞乳桿菌中乳糖/半乳糖逆向轉運系統Fig.6 Gene clusters related to stachyose utilization in Enterococcus faecium A6 Enterococcus faecalis A13 and lactose/galactose reverse transport system in Lactobacillus bulgaricus圖譜上箭頭的長度和方向分別代表了基因的長度和編碼方向
根據α-半乳糖苷酶酶活力測定結果(表5),肺炎克雷伯氏菌A3可能在胞外水解水蘇糖,但是分析基因組草圖并未發現能將α-半乳糖苷酶釋放至胞外的轉運蛋白基因(圖7)。利用SignalP 5.0對菌株基因片段中的信號肽進行預測,發現α-半乳糖苷酶的基因片段中并無信號肽,無法產生分泌蛋白(表8)。因此,肺炎克雷伯氏菌A3是否能在胞外水解水蘇糖還有待驗證。

圖7 肺炎克雷伯氏菌A3中α-半乳糖苷酶及 β-呋喃果糖苷酶所在基因簇Fig.7 Gene clusters of α-galactosidase and β-fructofuranosidase in Klebsiella pneumoniae A3
綜上所述,初步判斷菌株對水蘇糖可能的利用方式為:
(1)產氣莢膜梭狀芽孢桿菌B15通過msmEFG轉運體將水蘇糖轉運至胞內,然后由胞內α-半乳糖苷酶和β-呋喃果糖苷酶水解成單糖進行后續利用;
(2)屎腸球菌A6和糞腸球菌A13利用msmEFG轉運體轉運水蘇糖,α-半乳糖苷酶將其水解為半乳糖和棉籽糖,通過類似乳糖/半乳糖逆向轉運系統的方式,將不利用的棉籽糖釋放到細胞外;
(3)肺炎克雷伯氏菌A3對水蘇糖的利用方式目前尚不明確,仍需要進一步研究驗證。

表8 肺炎克雷伯氏菌A3中α-半乳糖苷酶信號肽預測結果Table 8 Prediction results of α-galactosidase signal peptide in Klebsiella pneumoniae A3
3 結論
本實驗從糞便中成功篩選到12株能夠利用水蘇糖的腸道細菌,分別屬于肺炎克雷伯氏菌、屎腸球菌、糞腸球菌和產氣莢膜梭狀芽孢桿菌。
不同菌株利用水蘇糖的生長情況不同,利用水蘇糖的方式也存在差異。大部分菌株以胞內α-半乳糖苷酶為主,肺炎克雷伯氏菌以胞外α-半乳糖苷酶為主,12株菌中僅肺炎克雷伯氏菌A3、A4、A16、屎腸球菌B8和產氣莢膜梭狀芽孢桿菌B15能夠利用水蘇糖產氣。不同菌株的產氣方式也不同,肺炎克雷伯氏菌A3通過丙酮酸甲酸裂解酶將丙酮酸轉化為甲酸,再由甲酸裂解酶分解甲酸產氣;產氣莢膜梭狀芽孢桿菌B15利用丙酮酸脫氫酶復合物產生CO2。
菌株對水蘇糖的利用可能存在以下2種方式:(1)利用msmEFG轉運體將水蘇糖轉運至胞內,由α-半乳糖苷酶和β-呋喃果糖苷酶將其水解利用;(2)利用msmEFG轉運體轉運水蘇糖,α-半乳糖苷酶將其水解為半乳糖和棉籽糖,將不利用的棉籽糖釋放到細胞外。
本實驗篩選得到了12株能利用水蘇糖的腸道細菌,并采用高效液相色譜技術結合基因組學分析,研究了菌株對水蘇糖的利用方式。今后可以更深入地研究腸道細菌對水蘇糖的利用機制,揭示攝入過量水蘇糖引起人體不適的機理,對于探究水蘇糖與人體健康的關系具有一定的指導意義。

