國內外生產用傳代細胞系致瘤性檢驗方法的比較與分析
王 磊,楊承槐,劉 瑩
(中國獸醫藥品監察所,北京 100081)
1 概 況
自1981年,World Health Organization(WHO) 生物制品標準化專家委員會(Expert Committee on Biological Standardization,ECBS)第一次批準使用純凈的傳代細胞系用于骨髓灰質炎疫苗的生產后,針對傳代細胞系作為生產用細胞基質的安全性爭論已經持續了近半個世紀[1]。對于如何評價作為生產用基質的傳代細胞系是否安全依然是目前各國藥品監管機構關心和討論的重點問題之一。傳代細胞系的安全性主要體現在兩個方面:一是細胞本身是否純凈,有無攜帶外源因子;二是細胞及其組分(包括外源因子、細胞DNA和細胞裂解物等)是否具有致瘤性特性[2]。傳代細胞系失去了細胞接觸抑制的特性,具有體外無限增殖的能力,存在發生惡性轉化和致瘤性風險。傳代細胞系自身的致瘤性與否會直接關系到作為生產用基質的生物制品種類、質量標準制定等諸多方面[3-4]。在2010年第61屆生物制品標準化專家委員會發布了關于生物制品生產用動物源性細胞基質技術指南(簡稱技術指南)即WHO動物細胞基質生產生物醫藥產品和細胞庫特性的評價建議(Recommendations for the Evaluation of Animal Cell Culture as Substrates for the Manufacture of Biological Medicinal Products and for the Characterization)[5]。2013年,ECBS對其進行了修訂,發布了最新版本的技術指南。該技術指南旨在為各國藥品監管機構制定關于生產用細胞庫的檢定與特性描述的相關技術要求時提供必要參考。各國家可以結合自身情況,對技術指南內容做必要修改或者直接采納作為本國技術要求[6]。下面對WHO技術指南中關于生產用傳代細胞系致瘤性檢驗的相關要求進行介紹并同我國現行獸藥典中的致瘤性檢驗要求進行梳理和比較,以期為完善我國生產用傳代細胞系致瘤性評價的技術要求提供參考。
2 WHO技術指南與現行獸藥典中關于致瘤性檢驗方法和檢測對象的要求
由于WHO技術指南是生物制品生產用細胞基質的通用要求,因此,具有普適性,適用對象比較寬泛,主要包括新建二倍體細胞系(除公認無致瘤性細胞(如WI-38、MRC-5、FRhL-2))、傳代細胞系(除了雜交瘤細胞和公認有致瘤性細胞系(如BHK-21、CHO、HEK293、CL27))、干細胞系。致瘤性檢測方法分為兩類,一是動物體內成瘤法(簡稱體內法);二是動物體外檢測方法(軟瓊脂克隆形成實驗)。我國獸用生物制品采用原代細胞和傳代細胞系作為生產基質。原代細胞是公認不存在致瘤性的風險的基質。因此,我國獸藥典中致瘤性檢驗的對象只包括了傳代細胞系,并采用動物體內成瘤法作為檢驗方法[7]。
3 動物體內成瘤法
動物體內成瘤法是評價細胞系致瘤性與否的標準方法。該方法是按照規定選擇動物的種類,以一定量的活細胞培養物或者裂解產物接種實驗動物,培養一段時間后,通過剖檢和病理學檢查是否有腫瘤細胞生長來判定細胞的致瘤性。動物體內法具有檢驗敏感性好、判定結果直觀等諸多優點,是細胞致瘤性檢驗的經典方法。
表1中對現行獸藥典和WHO技術指南收錄的采用動物體內成瘤法進行致瘤性檢驗的要求進行了簡單梳理。WHO技術指南采用動物體內成瘤法評價細胞系致瘤性時,分為了兩個層次進行評價即成瘤性檢驗和致瘤性檢驗。成瘤性檢驗是對傳代細胞系活培養物在動物體內成瘤能力的檢查,是細胞系本身生物特性體現。在成瘤性檢驗中產生的腫瘤細胞一部分來自接種的待檢細胞活培養物,另一部分則來自待檢細胞誘導實驗動物細胞形成的。當某種特定的細胞系成瘤性檢驗呈陽性時,即開展致瘤性檢驗。WHO技術指南要求的致瘤性檢驗是檢查細胞組分(包括細胞裂解物、細胞DNA和外源因子等)在動物體內是否可以誘導形成腫瘤,因此,致瘤性檢驗中產生的腫瘤細胞完全由待檢細胞組分中包含的致瘤因子誘導實驗動物細胞形成。
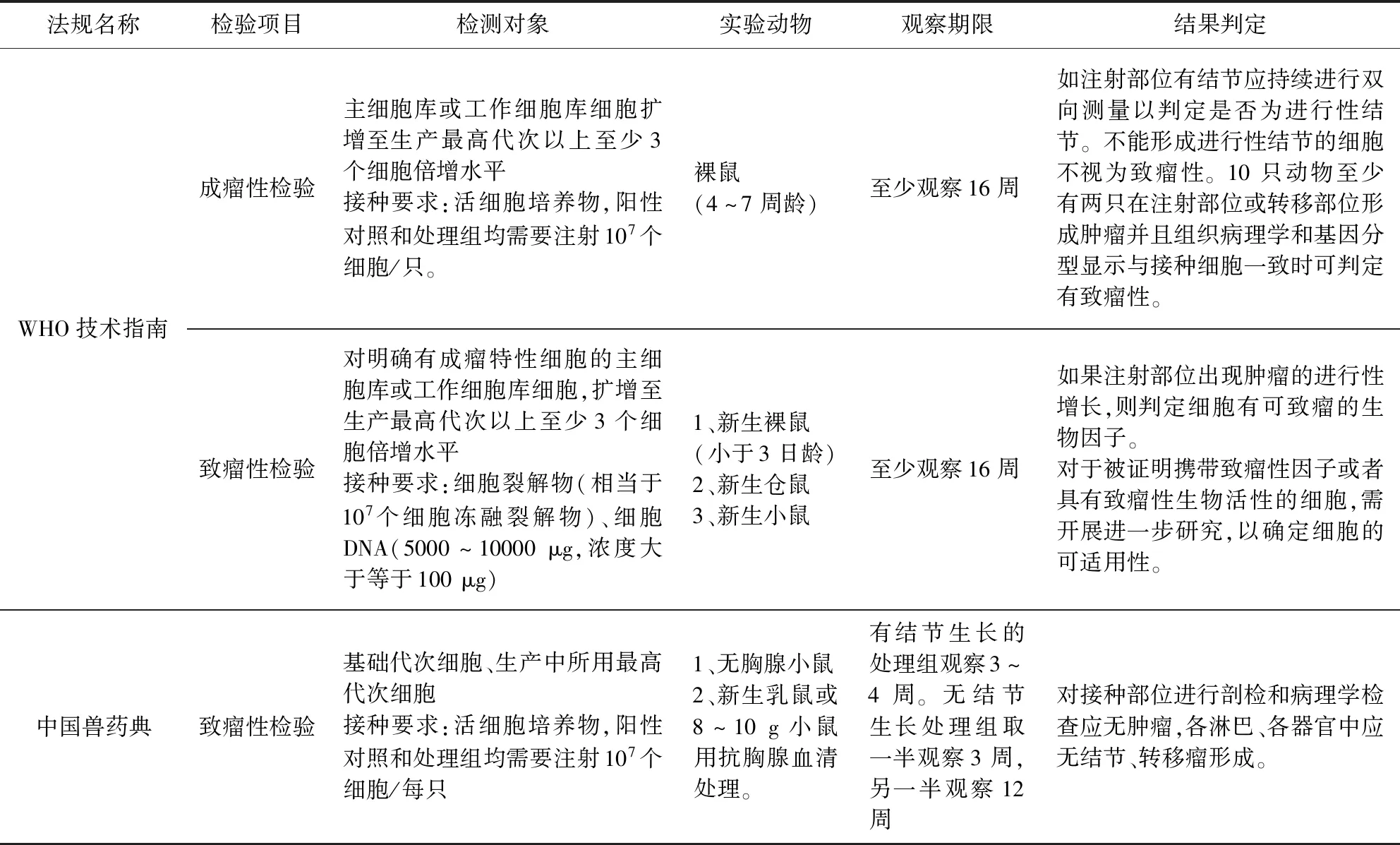
表1 現行獸藥典與WHO技術指南在采用動物體內成瘤法進行致瘤性檢驗的要求[6-7]Tab 1 Requirements of Current Veterinary Pharmacopoeia and WHO technical guidelines for tumorigenicity test by in vivo[6-7]
現行版獸藥典的致瘤性檢驗要求大致對應了WHO技術指南中成瘤性檢驗的方法。但是,目前在我國獸用滅活疫苗的研發和生產當中,使用了大量的成瘤性檢驗陽性的細胞(如BHK-21、PK-15、Marc-145細胞等)作為生產用細胞基質[8-9]。而現有方法還不能全面的了解和評估這些細胞在破碎裂解后是否依然會攜帶致瘤因子誘導宿主產生腫瘤。因此,建議參照WHO技術指南的方法,將成瘤陽性細胞檢驗進一步細化,評價成瘤陽性細胞組分(破碎裂解細胞或者細胞DNA等)是否完全不會攜帶致瘤因子,同時評價對生物制品的滅活工藝是否可以完全消除成瘤陽性或致瘤陽性細胞造成的潛在致瘤風險。
3.1 實驗動物選用 目前在成瘤性/致瘤性實驗規定的實驗動物主要包括成年無胸腺小鼠、新生無胸腺小鼠和用抗胸腺血清/球蛋白處理的小鼠(新生乳鼠、倉鼠或8~10 g小鼠)。表2對于幾種實驗動物在致瘤性檢驗中的優缺點進行了比較。
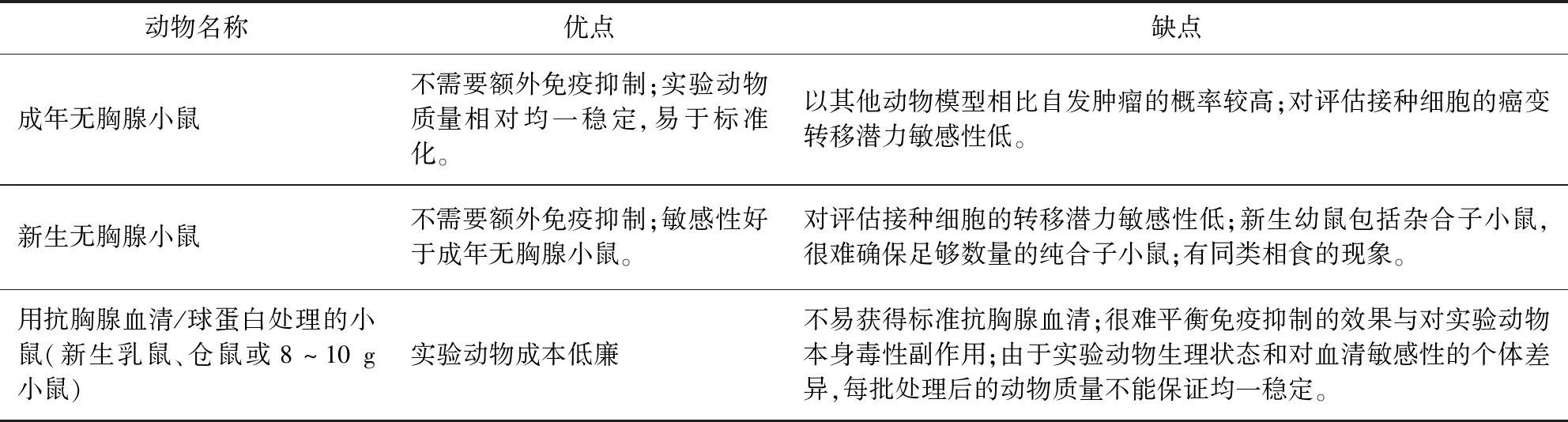
表2 實驗動物模型在致瘤性檢驗中的優缺點比較Tab 2 Comparison of advantages and disadvantages of several experimental animal models in tumorigenicity test
WHO技術指南中成瘤性檢驗只要求成年的無胸腺小鼠。我國獸藥典除此之外還補充了用抗胸腺血清處理的新生乳鼠或8~10 g小鼠亦可作為實驗動物并對以上動物任選其一。不同實驗動物對同一因素的反應雖然往往是相似的, 但有它的特殊性,因此,檢驗中常要選用那些對待檢細胞最敏感的動物作為檢驗對象。成年無胸腺小鼠容易獲得,可以滿足多數常用生產用細胞的致瘤性檢驗。而抗胸腺血清/球蛋白處理的小鼠雖不易獲得,但是是檢測待檢細胞癌變轉移潛力的敏感模型,可以用于檢測有潛在形成轉移瘤風險的細胞系[7]。因此,我國獸藥典在選用動物模型對傳代細胞系進行致瘤性檢驗時,補充了其他可選擇的實驗動物,沒有局限于無胸腺小鼠, 是有其科學性的。
3.2 結果判定 WHO技術指南的結果判定標準注重在一定時間內對注射部位產生的腫塊動態生長過程的監測。腫塊如果在觀察期內可以自行消退或經雙向測量判斷為非進行性結節,那么判定為不具有致瘤性。10只動物至少有兩只在注射部位或轉移部位形成腫瘤,判定為致瘤。此外,在分析實驗動物腫瘤的形成時,要求腫塊的組織病理學和基因分型結果應接種細胞一致,就避免了由于實驗動物模型自身的免疫缺陷造成自發形成腫瘤對檢驗結果的干擾,因此,更加科學。獸藥典相比之下更加注重判定時間點的檢查結果,3~5周時對實驗動物進行剖檢,即使有一只動物出現非進行性結節沒有完全消退的情況,也應判定為有致瘤性,因此,獸藥典結果判定更加嚴格。
4 體外檢測方法
雖然動物體內成瘤法是致瘤性檢驗的“金標準”。但依然存在實驗周期長、實驗過程復雜、檢驗成本較高、實驗動物質量不穩定等缺點。此外,用于體內法成瘤實驗的動物模型體溫37±1 ℃并不適用于所有傳代細胞系的常規培養溫度(如昆蟲細胞SF9培養溫度為28 ℃,禽類細胞DF-1的最佳培養溫度為39 ℃),針對這類細胞動物體內法成瘤實驗并不能全面的反映出細胞自身的致瘤特性。因此,WHO技術指南以動物體內成瘤法作為標準方法的基礎上,還增加了一些體外檢測方法加以輔助,以對特定細胞的致瘤性與否進行綜合判定。
軟瓊脂克隆形成實驗作為WHO技術指南推薦體外檢測方法可檢測細胞的致瘤性。該方法也是中國藥典以及歐洲藥典的推薦方法[10-11]。其利用了惡性轉化細胞培養時細胞伸展性差、接觸抑制消失,并不具備錨定依賴性,可以在軟瓊脂內增殖的原理。也常被用于腫瘤細胞的分離純化、單克隆抗體雜交瘤細胞的克隆篩選和抗腫瘤藥物的體外抑瘤活性的評價[12]。由于軟瓊脂克隆法過于敏感,并且其結果與動物體內成瘤法的結果的一致性和相關性還需進一步驗證,因此,該方法只能作為檢測某些不適用于動物體內成瘤法檢驗致瘤性的特定細胞系的補充替代方法。
5 其他問題及建議
WHO動物細胞基質生產生物醫藥產品和細胞庫特性的評價建議,對生物制品生產用細胞基質的檢定和安全性評價提供了非常有意義的參考。因此,建議根據WHO技術指南中采用動物體內成瘤法進行致瘤性檢驗的要求,結合我國實際情況對下一版獸藥典中對傳代細胞系致瘤性檢驗的要求進行進一步細化完善。由于,目前沒有一種方法可以全面客觀的評估所有傳代細胞系的致瘤性風險。針對特定的細胞系根據其特點選擇適合的檢驗方法顯得尤為重要。因此,建議增加適當的體外檢測方法作為補充評價的方法。
目前在國內,新獸用生物制品研發過程中對于生產用傳代細胞系的致瘤性評價都是由研發單位自主完成。從最大限度降低農產品質量安全風險的角度考慮,建議對于初檢成瘤性陽性的特定細胞,應送交國家指定機構完成進一步的安全性評價,以判定是否可以用于特定生物制品的生產。
以傳代細胞系作為生產基質的獸用生物制品在新上市監測期內,應要求研發、生產企業收集新獸藥的致瘤性風險信息資料。獸藥管理部門也應與檢疫部門、畜牧企業、屠宰企業和寵物醫院聯動,定期開展經濟動物和伴侶動物的腫瘤病流行病學調查,匯總相關數據,以便綜合分析研判疫苗用藥與腫瘤發生的相關性,對成品獸用疫苗以及生產用細胞基質安全性評價方法的適用性、可行性提供技術參考,以最大限度的保障農產品質量的安全。

