鋅摻雜氧化鎳空心球的制備
彭子童,姚軍龍,姚 楚,江學良
(武漢工程大學材料科學與工程學院,湖北 武漢 430205)
隨著科技的發展,超級電容器逐漸發展成為了介于傳統超級電容器和電池之間的一種可以快速充放電,同時還具備與電池相同的儲能機理、環境友好且無可替代的新型儲能器件[1-3]。與傳統電容器不同,超級電容器不僅能快速傳輸能量,有高的功率密度和能量密度,同時還具有壽命長和可回收性良好等特點[4-6]。作為新型儲能器件,普通超級電容器的電極材料包括過渡金屬氧化物、導電聚合物以及各種形式的碳材料等。其中,金屬氧化物基于活性物質的氧化還原反應可以存儲電荷,通常表現出比其他材料更高的比電容性能。最近的研究表明,由于過渡金屬氧化物氧化鎳具有較高比電容量、低成本和環境友好等特點,已經成為了一種有前途的超級電容器電極材料[7-8]。但是,NiO本身是一種電化學可逆性差、極化率低的p型半導體,由于其內部結構糾纏,NiO的載流子無法流動,從而導致電導率較低[9]。
為了克服NiO自身特性帶來的限制,進行了許多相關研究。結果表明,中空多孔結構可提供豐富的三維介孔,增加活性物質與電解質的接觸面積,拓寬離子擴散通道,促進電解質離子的快速擴散,提高電化學反應效率和NiO的電導率[10-12]。龐[13]使用草酸鎳鈷水合物作為前驅體,通過簡單的沉淀法合成以及退火法獲得了分層結構,表現出更豐富的介孔和較高的比表面積[14-16]。然而,沉淀法具有許多缺點,例如所制得的膠體狀樣品難以洗滌,產物易與雜質混合,且粒度難以控制。 Ahmed[17]以十六烷基三甲基溴化銨(CTAB)為表面活性劑,通過溶膠-凝膠法制備了一系列新型的介孔NiO/TiO2納米粒子。與沉淀法不同,溶膠-凝膠法具有控制粒徑均一、在較低溫度下易于反應的優點。但是,通常用溶膠-凝膠法制備樣品的原料價格昂貴、對健康有害、反應時間過長,且煅燒過程中氣體和有機物的逸出容易導致孔隙塌陷。 Hao[18]以檸檬酸鋅為模板,通過離子交換和化學蝕刻成功地制備了具有多孔結構的空心NiO微球。這種獨特的中空多孔納米結構提高了傳質速率,緩解氧化鎳空心球在循環過程中體積的急劇變化,有利于電化學性能的提高。但是,以模板法制備存在成本過高的問題[19]。因此,迫切需要開發一種新穎的制備NiO空心微球的有效方法。
以六水合硫酸鎳(NiSO4·6H2O)為原料,聚乙烯吡咯烷酮(PVP)為表面活性劑,通過一步水熱法成功合成了鋅摻雜氧化鎳空心球(Zn-NiOHS)。從材料設計的角度來看,導電性良好的過渡金屬元素Zn被摻入NiO中,解決了充放電反應不完全的問題,可以降低電阻,提高放電效率,從而達到提高材料循環性能的效果。通過SEM、TEM對鋅摻氧化鎳空心球(Zn-NiOHS)的形貌結構進行了表征,并對其進行了電化學性能測試,研究了空心球的形貌和不同摻雜量對Zn-NiOHS電化學性能的影響。
1 實驗部分
1.1 主要試劑和原料
主要試劑和原料包括葡萄糖(C6H12O6,國藥集團化學試劑有限公司,AR)、甲醛溶液(國藥集團化學試劑有限公司,AR)、六水合硫酸鎳(Ni(SO4)2·6H2O,國藥集團化學試劑有限公司,AR)、六水合硝酸鋅(Zn(NO3)3·6H2O,國藥集團化學試劑有限公司,AR)、環六亞甲基四胺(C6H12N4,國藥集團化學試劑有限公司,AR)、聚乙烯吡咯烷酮(PVP,西隴化工股份有限公司,AR)和尿素(CO(NH2)2,西隴化工股份有限公司,AR)。
1.2 主要儀器和設備
主要儀器和設備包括D8 Advance 型X射線衍射儀(德國Bruker公司)、JSM-5510LV型掃描電子顯微鏡(日本JEOL公司)、JEM-2100型透射電子顯微鏡(日本JEOL公司)和上海辰華CH6700型電化學工作站。
1.3 鋅摻雜氧化鎳空心球的制備
將4 g葡萄糖和100 mL去離子水加入到250 mL的燒瓶中,磁力攪拌10 min,加入4 g甲醛溶液、2 mL已配好的0.1 mmol/L的硫酸鎳溶液、3 g尿素以及3 g環六亞甲基四胺,常溫磁力攪拌至固體完全溶解,緩慢加入PVP以及不同質量分數的Zn(NO3)3溶液(Zn:Ni=1%,2%,3%和4%),邊加入,邊攪拌,直至所有原料混合均勻。將混合溶液倒入帶有聚四氟乙烯內襯的高溫高壓反應釜中,升溫到180℃,反應6h。待反應結束后,自然冷卻到常溫,取出反應后的混合液,分別用無水乙醇和去離子水清洗3次,在80℃下,烘干6h后得到褐色物質,即為前軀體/C球復合微球。將得到的前軀體/C球復合微球放入馬弗爐中,500℃煅燒2h后自然冷卻,得到最終產物為Zn-NiOHS。
2 結果與討論
2.1 X射線衍射分析
圖1a所示為NiOHS、1%Zn-NiOHS、2%Zn-NiOHS和4%Zn-NiOHS的X射線衍射圖。從圖中可以看出,衍射峰的位置與標準衍射卡(JCPDS#47-1049)基本一致,衍射角2θ在37°,43°,63°,75°和79°處的衍射峰分別對應于(110),(200),(220),(311)和(222)晶面,無其他衍射峰出現,證明實驗已經成功制備出立方相NiO。圖1b是位于(200)晶面的衍射峰,從圖中可以看出,摻雜使得位于(200)晶面上NiO衍射峰的半峰變寬,衍射峰向小角度偏移,導致樣品的晶格常數增加。主要是因為Zn2+的半徑(0.74 nm)與Ni2+的半徑(0.72 nm)相似,Zn2+可以進入到NiO晶格內部替代Ni2+,導致發生晶格畸變和晶格膨脹,在晶體框架內或在NiO表面處形成Zn-O-Ni鍵,并且通過限制晶體之間的接觸來抑制微晶的生長。
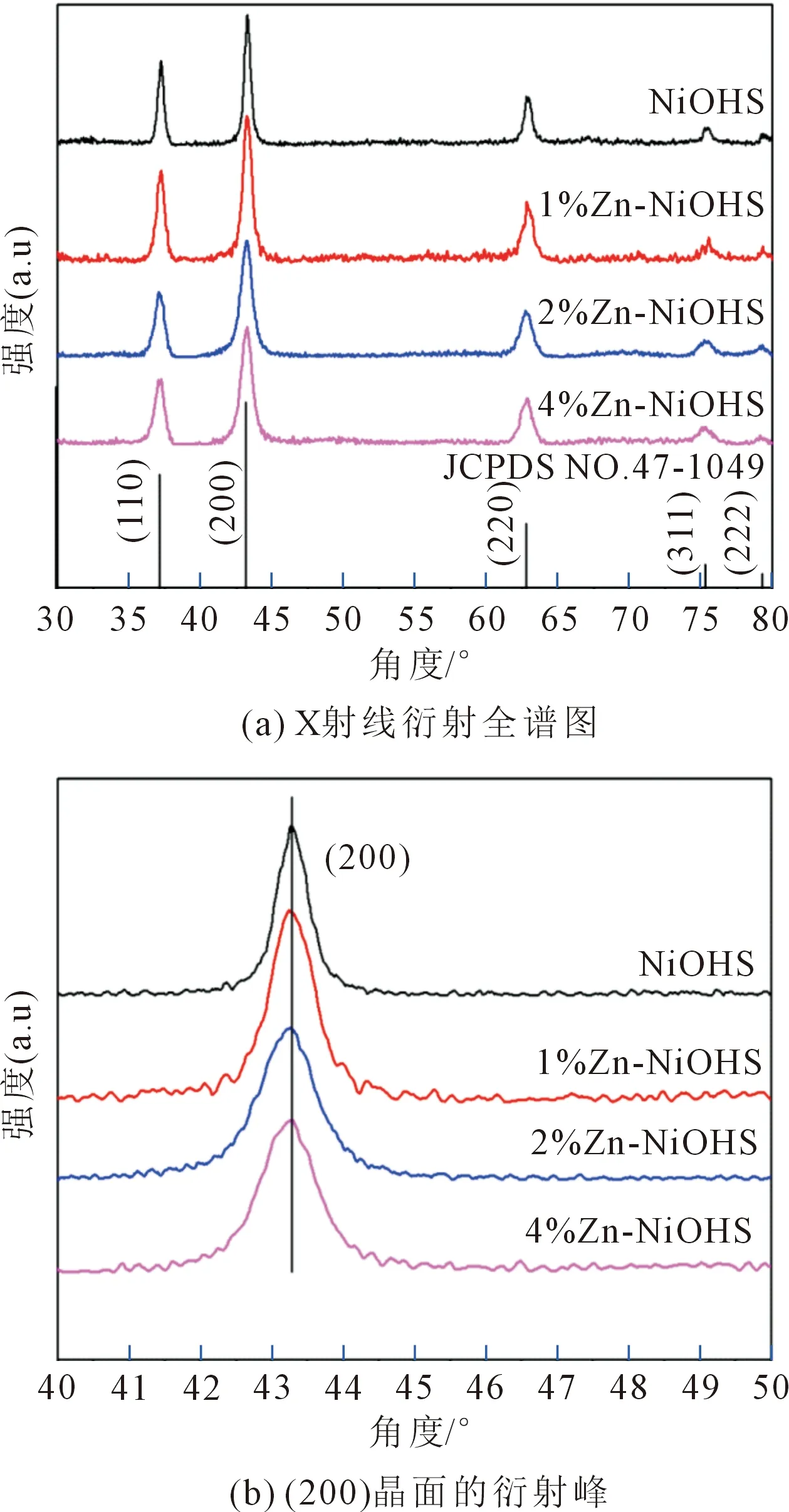
圖1 不同樣品的X射線衍射譜圖
2.2 掃描電鏡分析
圖2是NiOHS和不同Zn含量的Zn-NiOHS的SEM圖像。圖2a為NiOHS的SEM圖像,可以清楚地看到,NiOHS粒徑大小均一,且分散性良好。圖2b、圖2c和圖2d分別是1%,2%和4%Zn摻雜量的Zn-NiOHS,可以看出1%Zn-NiOHS的形態沒有顯著變化,與NiOHS同樣具有均一的尺寸和良好的分散性(圖2b);2%Zn-NiOHS的形狀最規則,沒有明顯的團聚,并且粒徑分布均勻,平均粒徑約為2 μm左右(圖2c)。隨著鋅摻雜量的增加,NiOHS逐漸開始團聚,當Zn的摻雜率達到4%時,Zn-NiOHS出現部分團聚,粒徑變大,表面粗糙,說明過量的Zn摻雜會使得NiOHS分散性變差,容易出現團聚(圖2d)。

圖2 不同樣品的掃描電鏡圖
2.3 透射電鏡分析
圖3是NiOHS和2%Zn-NiOHS的TEM圖像。與NiOHS相比,2%Zn-NiOHS的粒徑尺寸更大,表面更光滑。由圖3b可以看出,球體內部為明顯的中空結構,球體邊緣顏色明暗對比強烈,且平均粒徑大約為2 μm,壁厚約50 nm。證明所制備的2%Zn-NiOHS為獨特的空心球結構。

圖3 不同樣品的透射電鏡圖
2.4 電化學測試分析
圖4為不同樣品分別在掃速為5mV/s、10 mV/s、15 mV/s、20 mV/s和30 mV/s下的循環伏安曲線。圖4a是粉體NiO的循環伏安曲線,圖4b是NiOHS的循環伏安曲線,圖4c,4d和4e是不同Zn含量的Zn-NiOHS的循環伏安曲線,圖4f是不同樣品在不同掃速下的比電容量。通過圖4a-e中循環伏安曲線可知,相關電極材料的比電容來自于NiO基電極材料快速可逆的氧化還原反應,從圖中可以看出,位于0.45 V左右的氧化還原峰對應Ni2+→Ni3+的氧化反應,位于0.3 V左右的還原峰對應Ni3+→Ni2+的還原反應,在電壓掃描方向快速轉變時,電流具有很快的響應速度,說明電極材料擁有很好的可逆性和電容性。通過積分CV曲線計算樣品的比容量,計算出不同樣品在不同掃速下的比電容量(Cs),具體計算結果見圖4f,在5 mV/s 掃速下,NiOHS的比電容量為294.32 F/g,隨著Zn元素的摻雜,Zn-NiOHS的比電容開始提高,并且2%Zn-NiOHS的比電量最高達到357.08 F/g,但是,4%Zn-NiOHS的比電容量開始下降到256.68 F/g。可見,適量的Zn摻雜量可以提高樣品的比容量,但是過多的Zn摻入反而會引起比容量的下降。當掃描速度較快時,只有少數電解質離子能夠通過通道達到活性物質的內部,使得活性物質的氧化還原反應程度不高,比容量下降。
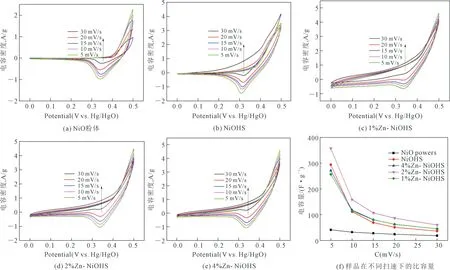
圖4 不同樣品在不同掃速下的循環伏安曲線
圖5 為不同樣品在低頻區的交流阻抗譜圖,可以明顯看出,商業粉體NiO的斜率最小,隨著Zn元素的摻雜,Zn-NiOHS的內阻相較NiOHS有所降低;Zn-NiOHS在高頻區的直徑都小于NiOHS,這表明了Zn的摻入可以促進電荷的轉移;2%Zn-NiOHS在低頻區的斜率達到最大,證明離子的擴散程度最佳,而過多的Zn摻入反而會阻礙NiOHS中電荷及離子的傳遞。
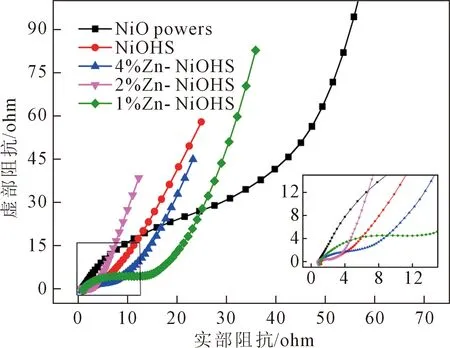
圖5 不同試樣的交流阻抗譜圖
圖6是2%Zn-NiOHS在不同電流密度下的放電曲線,根據GCD計算比電容量公式可得在0.5A/g的充放電流密度下,2%Zn-NiOHS比電容量最大,為255.28 F/g。此外,在電流密度為1 A/g時,2%Zn-NiOHS的比電容量為167.3 F/g。而在充放電電流的密度為2 A/g、3 A/g時,比電容量分別是97.44 F/g、54 F/g。以3 mol/L KOH溶液為電解質溶液,在1A/g電流密度下對2%Zn-NiOHS進行1 000次重復充放電性能測試。圖7為2%Zn-NiOHS充放電循環次數-電容保持量曲線,曲線反應了2%Zn-NiOHS的循環壽命。從圖中可知,2%Zn-NiOHS在第一次充放電時比電容就達到最大值,且隨著循環次數的增加,比電容量逐漸減小。這是因為在充電和放電測試期間,樣品上的應力增加使得電極材料本身的結構塌陷。當循環300次時達到穩定,保持在80%左右。這表明2%Zn-NiOHS循環1 000次后表現出良好的化學穩定性和一定的可逆性。
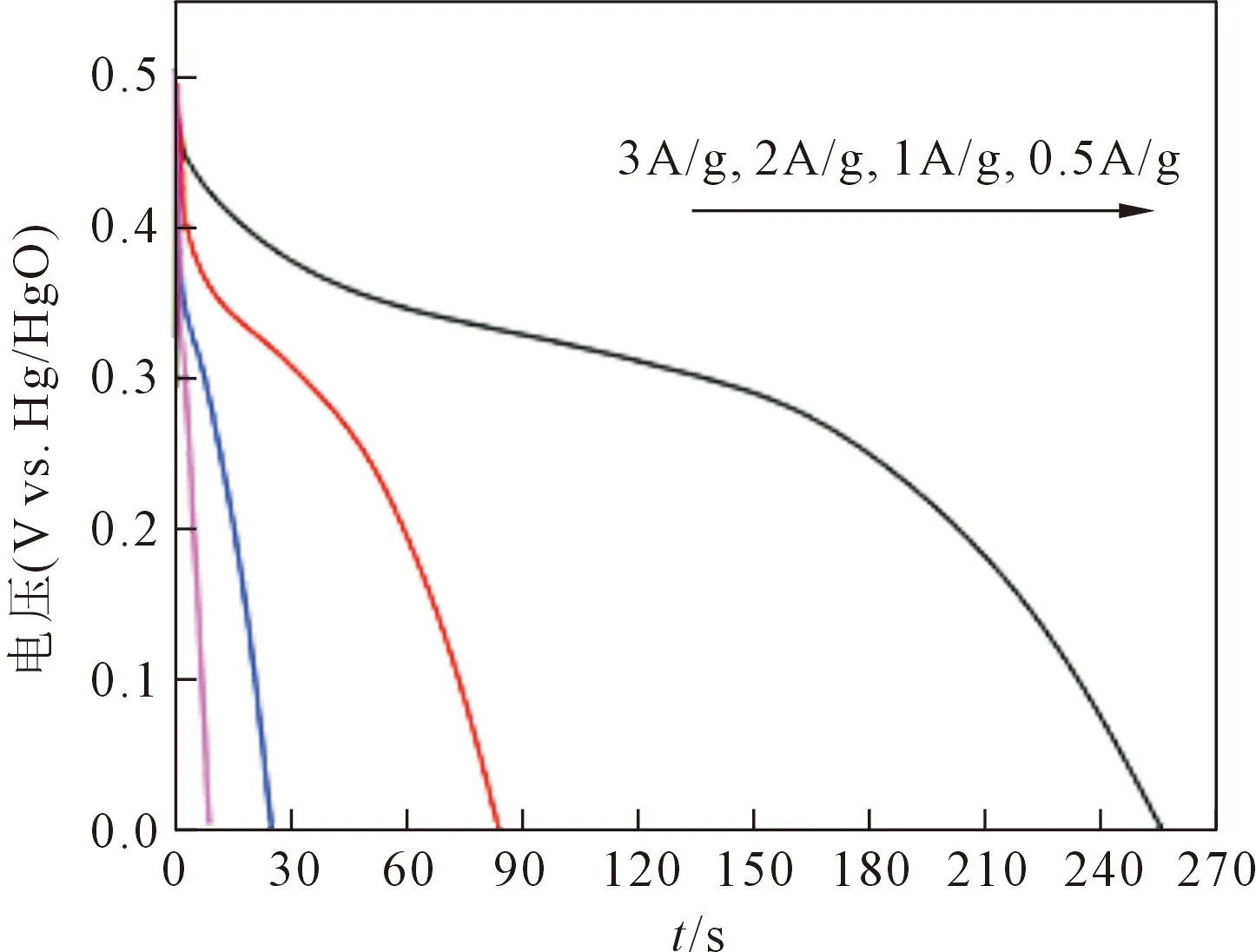
圖6 2%Zn-NiOHS在不同電流密度下的恒流放電曲線
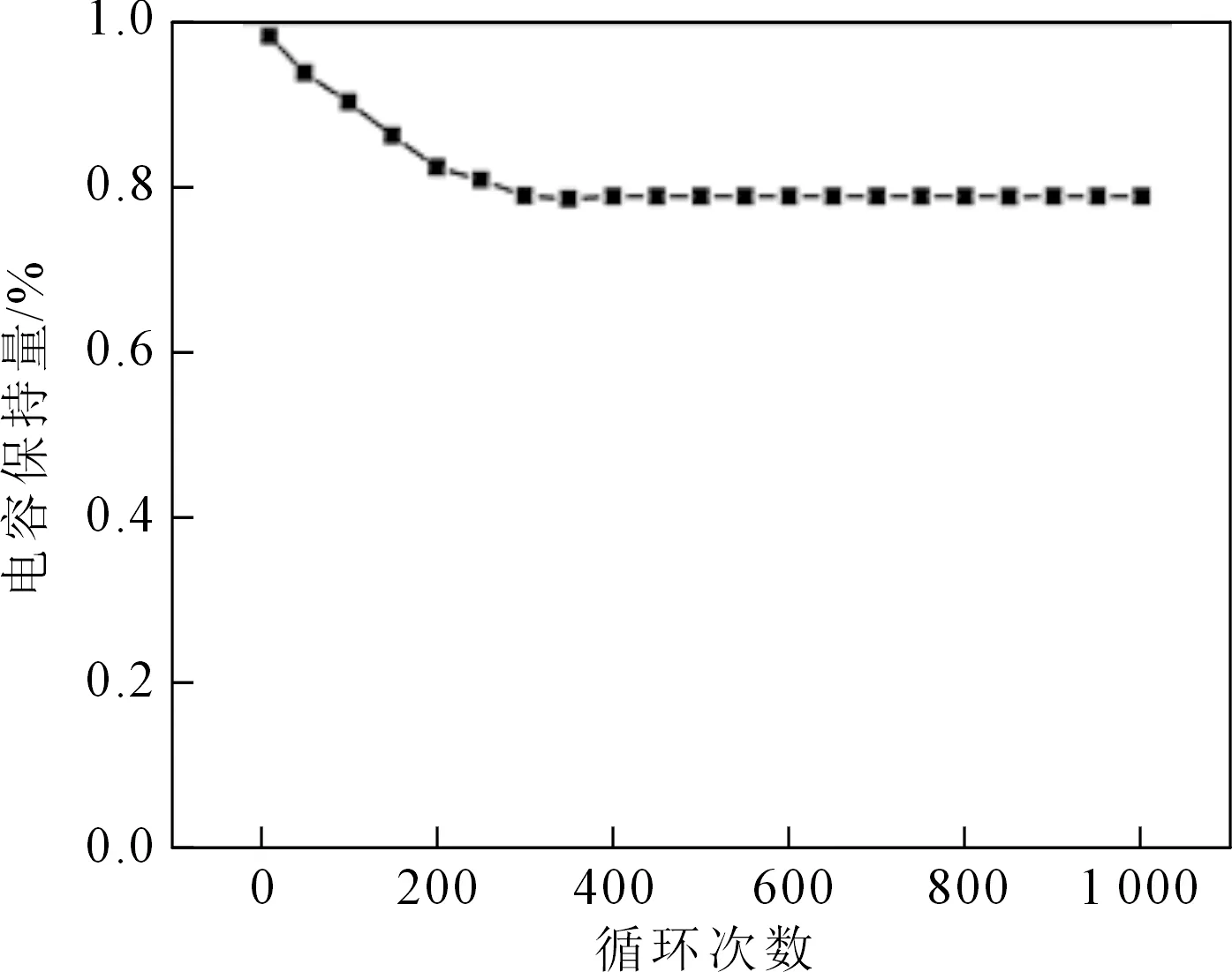
圖7 在1A/g電流密度下的循環次數-電容保持量曲線
2.5 Zn摻雜氧化鎳空心球的合成機理分析
圖8為Zn-NiOHS的合成機理。以葡萄糖、硫酸鎳為原料,硝酸鋅作為摻雜鋅源,在表面活性劑PVP的作用下,通過水熱反應將陽離子(Ni2+和Zn2+)吸附到碳層表面,然后煅燒除去碳層,最終得到Zn-NiOHS。根據氫氧化物沉淀的理論,因為Zn(OH)2的溶度積常數(Ksp=3.47×10-17)小于Ni(OH)2的溶度積常數(Ksp=6.31×10-16),所以Zn(OH)2與Ni(OH)2相比,更容易生成,在水熱反應過程中,碳層更容易被Zn(OH)2覆蓋。此外,Zn2+半徑(0.074nm)和Ni2+半徑(0.072nm)相似,Zn2+可能會替換氧化鎳晶格部分Ni2+,形成Ni-O-Zn鍵,引起晶格畸變,但不會改變氧化鎳的最終晶型[20-21]。因此,適量的Zn摻雜使得鋅離子在煅燒過程中更容易在碳層的表面附著,并且反應速度更快。然而,當摻雜量較小時,反應速度相對較慢,并且在煅燒過程中很可能發生結構崩塌。當摻雜量較大時,晶格畸變嚴重,容易引起表面粗糙。
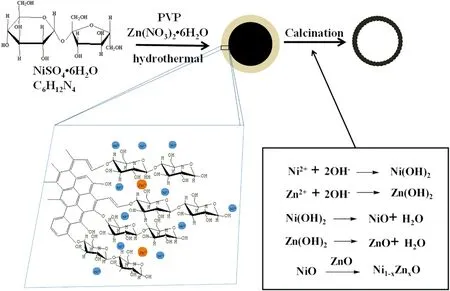
圖8 水熱法合成Zn-NiOHS的合成機理
3 結語
本文以葡萄糖、硫酸鎳為原料,硝酸鋅作為摻雜鋅源、PVP為表面活性劑,利用水熱法制備出了粒徑約為2 μm的氧化鎳空心球。結果表明,當鋅的摻雜量為2%時,所得空心球沒有明顯的團聚,且粒徑分布均勻,摻雜和未摻雜的氧化鎳空心球都是純立方相。電化學性能測試結果表明,當掃速為5 mV/s時,2%Zn-NiOHS的比電容量達到最大,為357.08 F/g。根據計算可知,Zn摻雜氧化鎳空心球的比電容量始終要高于未摻雜氧化鎳空心球。當Zn的摻雜量達到2%時,在1A/g的電流密度下進行1 000次重復充放電性能測試,容量保持率可以維持約80%。

