跗骨竇微創小切口與傳統L型延長切口治療閉合性跟骨SandersⅡ、Ⅲ型骨折的療效對比研究
郝連升 穆勝凱 劉士凱 董吉哲
(山東省聊城市中醫醫院,山東 聊城 252000)
跟骨骨折屬于臨床上常見的骨折,以青壯年為主,致傷暴力較大,為高能量損傷,約85%-90%為關節內骨折,非手術治療可能會出現創傷性關節炎、腓骨肌腱撞擊、平足畸形、外翻畸形等后遺癥,增加距下關節融合幾率,導致致殘率增加[1],手術治療也成為主要治療方式,甚至治療的“金標準”[2],手術目的主要恢復關節面平整、跟骨高度及跟骨寬度,跟骨骨折手術方式很多,傳統的L型手術切口一直沿用至今,具有不可替代作用,手術視野暴露清楚,有利于關節面、骨折復位,還可以保護腓腸神經,雖然手術技術不斷成熟,但是并發癥一直較多,如感染、皮瓣壞死、骨髓炎等[3]。跟骨所處位置特殊,皮膚彈性差,處于末端,傷后腫脹,又給手術增加難度。隨著技術理念的改善,以保護軟組織為前提的微創技術備受關注,國內外很多學者提出跗骨竇入路治療跟骨骨折[4-5],本文將傳統L型手術入路與跗骨竇手術入路進行比較,回顧性分析了2016年1月-2018年12月分別采用2種手術入路患者的病例資料,現報告如下。
臨床資料
1 一般資料:回顧性分析納入研究的患者共91例,男67例、女24例。年齡25-56歲。均為**省**市中醫醫院的閉合性跟骨骨折患者,左側31例,右側60例。Sanders[6]Ⅱ型43例、Ⅲ型48例。從受傷到手術3-10天。致傷原因:跌落傷70例,交通事故傷21例。(1)診斷標準:參照《骨與關節損傷》中跟骨骨折的診斷標準[7]:①有明確的外傷史;②足跟部腫脹明顯,皮下瘀斑,或出現較對側增寬;③按壓痛明顯,叩擊痛陽性;④主動活動受限;⑤骨折處可觸及骨擦感;⑥X線或者CT見跟骨骨折。(2)納入標準:①符合上述診斷標準;②年齡18-60歲;③受傷在2周以內,且未進行影響研究的治療,如局部膏藥外敷引起水泡、非專業手法復位石膏外固定;④所有患者均為單側骨折;⑤按照分型屬于SandersⅡ、Ⅲ型者。⑥經過醫院倫理委員會同意;⑦所有患者行跟骨正側位、軸位、CT三維重建檢查。(3)排除標準:①合并自身免疫性骨病、骨腫瘤、骨囊腫者;②精神系統疾病患者;③合并復合傷,影響整個治療、康復過程的患者;④開放性或者陳舊性跟骨骨折;⑤手術切口周圍有皮膚病,影響手術切口者;⑥隨訪資料不完整者。
2 方法
2.1 分組方法:符合標準的91例患者,隨機分為觀察組、對照組,觀察組45例采用跗骨竇小切口,46例對照組采用傳統L型延長切口。2組患者基線對比資料,經統計學分析無意義,見表1。

表1 2組閉合性脛骨遠端骨折患者基線資料比較
2.2 治療方法:(1)觀察組。入院后先行手法復位糾正跟骨寬度后石膏固定,出現皮紋后行手術治療。在手術開始前30-60 分鐘常規應用抗生素。椎管內麻醉成功后,取健側臥位,放置止血帶,在外踝尖下約1cm處向第4跖骨基地部做長約4cm直行手術切口,切開皮膚、皮下,分離并保護腓腸神經、腓骨長短肌肌腱、跟腓韌帶,分離趾短伸肌肌腹并牽開,顯露跗骨竇及距下關節,清除關節內淤血、小骨片及軟組織,整個皮瓣剝離,生理鹽水反復沖洗;與跟骨結節打入1枚3.5mm克氏針,沿跟骨軸向牽引,結合正骨手法先復位跟骨寬度及高度,糾正跟骨內翻畸形,克氏針臨時固定,在直視下復位關節面,由跟骨結節外側向塌陷關節面處打入1枚2.5mm克氏針臨時固定,透視下確定跟骨高度寬度、關節面復位良好,骨缺損處給予自體髂骨植骨。給予跟骨解剖異形鎖定接骨板結合螺釘固定,后方可采用小切口植入螺釘,可吸收線縫合刀口,內置引流管1枚。術后彈力繃帶略加壓包扎,術后抬高患肢,24小時冰敷,應用抗生素預防感染,術后24小時引流量<50ml后拔出引流管。術后前3天靜脈滴注20%甘露醇125ml,日2次。術后第2天開始主動踝關節背伸活動鍛煉,術后3周后行踝關節滾動式鍛煉,骨折完全愈合后開始部分負重鍛煉,3個月后可完全負重。(2)對照組。術前、術后處理方法與微創組相同。于外踝尖上方約3-5cm處與跟腱連線的終點向下到外側與跖側皮膚交界處,然后轉向前至第5跖骨基地部近側約1cm處,切口直至骨面,禁止皮下剝離,將皮瓣全層銳性剝離,聯合腓腸神經、腓骨肌腱一并掀起,顯露距下、跟骰關節,復位與固定方法與觀察組基本相同,嚴密縫合皮下組織,放置引流管,皮膚縫合采用Donati-Allgower方法縫合[8]。術后處理方法與觀察組相同。
3 療效及安全性評價方法:比較2組患者的手術時間、手術切口長度、術后引流量、術后1天疼痛數字分級評分、骨折愈合時間、術后12個月AO-FAS踝與后足功能評分[9]、術前術后Bohler角及Gissane角變化,并觀察并發癥發生情況。X線檢查顯示有連續性骨痂通過骨折斷端,且患肢完全負重時無疼痛表明骨折愈合。
4 數據統計方法:采用SPSS1 8.0統計軟件對所得數據進行統計學分析,2組患者性別及Sanders分型的組間比較采用x2檢驗,年齡、手術時間、術后1天疼痛數字分級評分、切口長度、術后引流量、骨折愈合時間、及AO-FAS踝與后足功能評分、術前術后Bohler角及Gissane角的組間比較采用t檢驗,并發癥發生率的組間比較采用四格表校正x2檢驗,檢驗水準α=0.05。
5 結果
5.1 2組評價指標對比:納入研究患者經過12個月隨訪。2組患者手術時間、手術切口長度、術后引流量、術后1天疼痛數字分級評分、骨折愈合時間、術后12個月AO-FAS踝與后足功能評分[8]見表2。術前術后Bohler角及Gissane角變化見表3、表4。
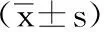
表2 2組跟骨骨折患者療效比較

表3 2組跟骨骨折患者影像學檢查比較

表4 2組測量角度對比
5.2 2組并發癥比較:對照組發生刀口感染10例,其中5例經過抗生素、換藥處理后自行愈合,3例清創后再次縫合后愈合,1例抗感染后接骨板外漏,行皮瓣轉移手術;2例發生鋼板外露及切口感染,清創、抗感染治療后行皮瓣轉移術;觀察組未出現刀口感染,但出現皮膚淺表壞死2例,換藥后自行愈合;2組患者均未出現骨髓炎。2組患者并發癥發生率,觀察組比率4.44%,對照組發生率21.74:%,差異具有統計學意義(x2=0.5.21,P=0.019)。
討 論
跟骨解剖形態不規則,周圍軟組織結構比較薄弱,解剖學特點造就了跟骨骨折在治療時軟組織條件是考慮的重點因素,術后并發癥較容易出現,比如切口感染、皮瓣壞死、骨髓炎、創傷性關節炎等[10]。手術治療跟骨骨折一直被認為是最有效的措施,手術目的在于恢復跟骨高度、寬度、軸線、長度以及Bohler角及Gissane角,其中以關節完整最為重要,它直接影響預后[11]。現在公認的跟骨骨折手術適應證是:(1)關節內骨折合并移位>1 mm;(2)關節外骨折導致跟骨高度及寬度改變 (外翻畸形 >10°,Bohler角 <15° 或內翻畸形 >5°);(3)經手法復位或者經保守治療無效。
傳統外側L型手術切口治療跟骨骨折被稱為“金標準”,但軟組織并發癥一直是一個難題,外側L型手術切口幾乎可以應用于所有跟骨骨折手術,術中可以充分暴露跟骨結節、距下關節、跟骰關節,避免出現腓骨長短肌肌腱、腓腸神經損傷,可以在直視下獲得滿意復位,并堅強固定,一直被認為為最有效和安全入路[12]。隨著隨訪及研究的不深入,L型手術切口對周圍軟組織剝離較多,周圍組織血運差,容易造成切口并發癥,甚至形成骨髓炎,有學者進行回顧性分析,切口并發癥發生率在20%左右[13],并認為L型切口的并發癥與諸多因素有關,比如手術時間把握、術中操作、手術時間、切口弧度以及是否引流等。為把軟組織影響降到最低,開始采用跗骨竇入路治療跟骨骨折[14-15]。跗骨竇由外踝下1cm開始延長至第4跖骨基底部,切口可以直接顯露距下、跟骰關節,該入路相比傳統外側L手術切口具有以下優點:(1)減少對軟組織損傷,避開跟骨外側血管;(2)對軟組織要求相對較低,可以早期手術治療,縮短住院時間;(3)有效減少切口并發癥的發生;(4)充分暴露距下、跟骰關節以及前外側骨塊;(5)該手術入路適當內翻增加關節間隙,可保留跟腓韌帶、腓骨肌下支持帶完整,出血少、創傷小。跗骨竇手術入路技術要求相對較高,手術時間的長短在很大程度上由經驗及技術水平決定。該手術入路也有缺點:對跟骨后外側面暴露不沖分,增加恢復跟骨高度及寬度難度,容易出現腓腸神經損傷;可能造成醫源性跟骨內翻畸形[16],對手術醫師技術要求更高,其中腓腸神經損傷為主要并發癥[17]。本研究認為在術前仔細研究關節面塌陷位置,術中合理利用克氏針復位,術中仔細分離并保護腓腸神經,可以獲得良好復位同時避免并發癥發生。觀察組在術后引流量、切口長度、術后患者疼痛評分、并發癥方面優于對照組,具有較好手術安全性;2組患者手術時間、骨折愈合時間、踝關節功能評分、Bohler角及Gissane角比較無統計學意義,2組患者均獲得良好復位及固定。表明跗骨竇手術入路與傳統L型手術入路都可作為跟骨骨折SandersⅡ、Ⅲ型的治療方式,跗骨竇入路具有明顯優點,主要體現在術后并發癥上,傳統L型手術切口出現皮膚問題發生率21.74%,要明顯高于跗骨竇入路4.44%,這與足部軟組織解剖特點密不可分,因此也把這一項作為重要臨床工作,但是跗骨竇入路不能成為所有跟骨骨折的治療方式,它具備臨床操作局限性。本研究存在不足的地方,研究之間可能會出現異質性,原因與手術技術熟練程度、術后護理甚至統計學方法有關,可能需要擴大樣本研究證實。對于Sanders Ⅳ型跟骨骨折跗骨竇入路存在缺陷,傳統外側L型手術切口具有恢復跟骨生物力學絕對優勢[18]。
跗骨竇微創切口對于SandersⅡ、Ⅲ型跟骨骨折具有切口小、出血少等優點,術中可獲得良好復位及固定,對手術醫師技術要求較高,需避免出現腓腸神經損傷,術后功能恢復與很多因素有關,需要進一步研究證實。

