非編碼RNA在前列腺癌上皮間質(zhì)轉(zhuǎn)化中的研究進展*
尹 冶,丁明霞,陳振杰 綜述,王玉明 審校
昆明醫(yī)科大學第二附屬醫(yī)院:1.檢驗科;2.泌尿外科,云南昆明 650000
前列腺癌是嚴重威脅全球中老年男性健康的惡性腫瘤之一,到2020年美國前列腺癌確診人數(shù)預計達19萬余人,3.3萬余人死于該病[1]。近十年來,前列腺癌已成為我國增速最快的男性惡性腫瘤,且晚期患者比例較西方國家更高,80%的患者雖得益于初期的雄激素剝奪療法,但最終均會抵抗雄激素剝奪療法,發(fā)展為去勢抵抗性前列腺癌[2]。去勢抵抗性前列腺癌極具轉(zhuǎn)移性和侵襲性的特點使得器官轉(zhuǎn)移成為多數(shù)患者死亡的主要原因,惡性腫瘤轉(zhuǎn)移的機制極為復雜,其中,上皮間質(zhì)轉(zhuǎn)化(EMT)被認為是這一行為特征的關(guān)鍵因素。
EMT是指上皮細胞失去上皮表型,并獲得間質(zhì)表型后轉(zhuǎn)化為間質(zhì)細胞的過程。起源于前列腺上皮而惡性增殖的癌細胞經(jīng)過EMT失去細胞極性,導致細胞間黏附力減弱,侵襲與遷移能力增強,同時,伴隨上皮細胞標志物E-鈣黏蛋白(E-cadherin)、β-連環(huán)素(β-catenin)和緊密連接蛋白ZO-1的表達下調(diào),以及間質(zhì)細胞標志物N-鈣黏蛋白(N-cadherin)和波形蛋白(vimentin)的表達上調(diào)[3]。EMT作為前列腺癌惡化轉(zhuǎn)移的重要環(huán)節(jié),它的激活受到一系列基因表達變化的調(diào)控。其中,長鏈非編碼RNA(lncRNA)、微小RNA(miRNA)及環(huán)狀RNA(circRNA)等多種非編碼RNA(ncRNA)可通過轉(zhuǎn)錄和表觀遺傳等多水平調(diào)控腫瘤相關(guān)基因的表達。研究表明,ncRNA可通過多種途徑對Snail超家族(Snail,Slug)、堿性螺旋-環(huán)-螺旋蛋白家族(Twist1)和E盒結(jié)合鋅指蛋白家族(Zeb1,Zeb2)等EMT相關(guān)轉(zhuǎn)錄因子的表達進行調(diào)控,也可調(diào)控轉(zhuǎn)化生長因子β(TGF-β)、表皮細胞生長因子(EGF)和腫瘤壞死因子(TNF)的表達,從而參與到前列腺癌的EMT進程中[4-5]。本文通過綜述3類ncRNA的相關(guān)研究,總結(jié)并探討其調(diào)控前列腺癌EMT的作用機制,以期深刻認識EMT在前列腺癌中的分子機制,同時為獲得前列腺癌新的治療靶點提供依據(jù)。
1miRNA與前列腺癌EMT
1.1miR-200家族與前列腺癌EMT 作為與惡性腫瘤EMT高度相關(guān)的基因系列家族,miR-200家族(miR-200a/b/c、miR-141和miR-429)被廣泛研究,目前認為其主要靶向調(diào)控Zeb家族參與EMT進程[6]。近年來,miR-200家族調(diào)控前列腺癌EMT的機制也取得了一定的突破。
研究表明,miR-200-3c可通過靶向調(diào)控Zeb2抑制前列腺癌細胞的侵襲和遷移,從而上調(diào)E-cadherin的表達,抑制EMT進程[7]。此外,轉(zhuǎn)錄因子Zeb1和Slug可直接相互作用于vimentin啟動子中的E-box序列,miR-200c可對二者進行轉(zhuǎn)錄、抑制,從而阻礙前列腺癌的EMT進程[8]。這提示了miR-200c可逆轉(zhuǎn)前列腺癌的細胞表型從上皮向間質(zhì)的轉(zhuǎn)變,Zeb1-Slug軸的分子重編程或許可以作為轉(zhuǎn)移性前列腺癌的潛在治療靶點。基于此,ABISOYE等[9]發(fā)現(xiàn)轉(zhuǎn)錄抑制因子Kaiso可通過激活表皮細胞生長因子受體(EGFR)信號通路,促使miR-200沉默。Kaiso作為轉(zhuǎn)錄抑制物,可通過結(jié)合E-cadherin的甲基化區(qū)域參與到調(diào)控多種惡性腫瘤的EMT進程中[10]。該研究在LNCaP細胞中過表達Kaiso后,miR-200表達下調(diào),Zeb1和EGFR表達上調(diào)。經(jīng)驗證,EGFR-Kaiso信號軸是miR-200-Zeb1反饋環(huán)的關(guān)鍵環(huán)節(jié),可加速前列腺癌的EMT進程。由此看來,Zeb1/Zeb2作為miR-200家族的直接靶標,或以更為復雜的機制調(diào)控前列腺癌的EMT進程。另外,上皮可塑性相關(guān)基因的選擇性剪接作為miR-200調(diào)控EMT的新機制被初次報道[11]。RNA結(jié)合蛋白QKI-5可指導間質(zhì)相關(guān)基因的剪切變化,尤其是發(fā)生EMT時,可改變與肌動蛋白細胞骨架變化相關(guān)的基因。該蛋白可在EMT進程中直接結(jié)合并調(diào)控數(shù)百個可變剪接靶標,發(fā)揮多效作用,例如調(diào)控上皮與間質(zhì)狀態(tài)之間的可塑性,以促進細胞的遷移和侵襲[11]。研究表明,miR-200和miR-375可通過抑制QKI-5的翻譯,對EMT相關(guān)的選擇性剪接變化進行廣泛的約束,從而抑制前列腺癌的EMT進程[12]。上皮可塑性相關(guān)基因與EMT緊密相關(guān),以此為出發(fā)點或能深入探究miRNA調(diào)控前列腺癌EMT的復雜機制。
1.2其他miRNA與前列腺癌EMT
1.2.1促癌miRNA與前列腺癌EMT 除miR-200家族外,其他miRNA在前列腺癌EMT中的調(diào)控也有重要意義。ZHANG等[13]研究發(fā)現(xiàn),miR-410-3p可作用于磷酸酶及張力蛋白同源基因PTEN來調(diào)控AKT/mTOR信號通路,從而加速前列腺癌EMT的進程。PTEN作為強大的腫瘤抑制因子,可負向調(diào)控PI3K/AKT信號通路,其表達的缺失可促進不同癌細胞的增殖,并減少凋亡。miR-498也被證實可通過結(jié)合PTEN的3′-UTR調(diào)節(jié)AKT信號通路,從而促進前列腺癌細胞的增殖、侵襲和EMT進程[14]。腫瘤的惡性增殖和轉(zhuǎn)移嚴重影響前列腺癌患者的生活質(zhì)量和生存時間,一些失調(diào)的miRNA是器官轉(zhuǎn)移的關(guān)鍵介質(zhì)。研究表明,miR-141-3p可通過激活核因子(NF)-κB信號通路促進前列腺癌的骨轉(zhuǎn)移,上調(diào)PC3細胞的miR-141-3p后,棒狀或長紡錘形的間充質(zhì)表型轉(zhuǎn)化為明顯的鵝卵石樣或短紡錘形的上皮輪廓,表明EMT進程受到抑制。而NF-κB途徑在腫瘤中具有核心作用,可促進腫瘤的發(fā)生與轉(zhuǎn)移[15]。miR-210-3p可通過靶向抑制NF-κB信號通路的負調(diào)節(jié)劑來維持NF-κB信號的持續(xù)激活,從而誘導前列腺癌EMT和骨轉(zhuǎn)移的發(fā)生[16]。由此看來,腫瘤信號通路的調(diào)控在前列腺癌EMT中依然占據(jù)重要地位,但要將高效的靶點進行臨床轉(zhuǎn)化,仍需大量數(shù)據(jù)驗證出特異的信號途徑。另外,LO等[17]研究發(fā)現(xiàn)γ干擾素(IFN-γ)可誘導前列腺癌的體外細胞侵襲和體內(nèi)肺轉(zhuǎn)移,其具體機制可能是IFN-γ誘導的四肽重復序列5復合體降解部分前體miRNA(pre-miRNA),包括pre-miR-363、pre-miR-101和pre-miR-128,通過阻斷pre-miRNA對EMT相關(guān)轉(zhuǎn)錄因子的靶向調(diào)控,從而促進遠端轉(zhuǎn)移和EMT。這一結(jié)論與LIU等[18]研究INF-γ通過抑制miRNA調(diào)控前列腺癌EMT的結(jié)果一致。因此,從相關(guān)抑制劑或阻斷劑的方向進行探索,或許能更全面地探討其機制,并為有效抑制劑的開發(fā)提供依據(jù)。
1.2.2抑癌miRNA與前列腺癌EMT 腫瘤miRNA表達譜分析的主要挑戰(zhàn)是細胞亞群和腫瘤組織的異質(zhì)性。因此,ZONI等[19]分析了前列腺癌上皮祖細胞亞群中miRNA的表達,確定miR-25在祖細胞亞群中低表達,而在前列腺癌細胞系中高表達,該研究表明,miR-25可通過與αv/α6-整合蛋白直接相互作用影響EMT相關(guān)細胞骨架變化,從而減少前列腺癌的體外遷移和體內(nèi)轉(zhuǎn)移,miR-25作為腫瘤抑制因子,是前列腺癌的關(guān)鍵調(diào)節(jié)劑。不僅腫瘤轉(zhuǎn)移與EMT相關(guān)(Ⅲ型EMT),胚胎生長發(fā)育(Ⅰ型EMT)和組織再生(Ⅱ型EMT)等也與其緊密相關(guān)。SOX基因家族與生長發(fā)育存在密切關(guān)系,該家族的異常表達可導致多種惡性腫瘤。研究表明,部分miRNA可通過調(diào)控SOX家族影響前列腺癌的EMT[20],其中,miR-139-5p通過靶向SOX5,下調(diào)Twist1、N-cadherin和vimentin的表達,從而抑制前列腺癌EMT的進程。另一項研究則基于生物信息學工具和熒光素酶報告基因檢測確定SOX4作為EMT的一種關(guān)鍵調(diào)節(jié)劑,miR-132、miR-212可通過直接靶向SOX4破壞EMT,抑制前列腺癌的惡化與轉(zhuǎn)移[21]。miR-19a-3p也可通過抑制SOX4下調(diào)N-cadherin、α-平滑肌肌動蛋白,以及與腫瘤浸潤轉(zhuǎn)移相關(guān)的基質(zhì)金屬蛋白酶2、金屬蛋白酶9,從而抑制前列腺癌的EMT進程[22]。同樣,通過靶向調(diào)控SOX家族延緩前列腺癌EMT的miRNA還包括miR-140、miR-653等。這些結(jié)果提示腫瘤抑制因子和生長發(fā)育相關(guān)基因可能是miRNA調(diào)控前列腺癌EMT的連接橋梁,且與胚胎生長發(fā)育和組織再生相關(guān)的基因?qū)Β笮虴MT的機制研究也有較大的探索價值。
盡管目前miRNA調(diào)控前列腺癌EMT的機制研究缺乏足夠的深入性和統(tǒng)一性,但從零散的研究中發(fā)現(xiàn),EMT相關(guān)因子和腫瘤相關(guān)基因是探索此機制的主要方向。以此為基礎(chǔ)展開研究得到的分子機制線索,為前列腺癌miRNA靶點的發(fā)掘提供了依據(jù)。見圖1。
2lncRNA與前列腺癌EMT
2.1與競爭性內(nèi)源RNA(ceRNA)機制相關(guān)的lncRNA lncRNA具有一級序列信息,可以通過堿基互補與核酸分子相互作用,也可以通過其二級結(jié)構(gòu)與蛋白質(zhì)、核酸分子及RNA-蛋白質(zhì)復合物相互作用,此種基因共表達或基因間相互調(diào)控的模式是研究lncRNA在癌癥中發(fā)揮生物學功能的重要方法。miRNA可以通過結(jié)合mRNA導致基因沉默,而lncRNA作為ceRNA可以競爭性地結(jié)合miRNA來調(diào)節(jié)基因表達,從而影響miRNA導致的基因沉默。lncRNA通過此種ceRNA機制調(diào)控前列腺癌的EMT進程。研究表明,lncRNA MALAT1可作為ceRNA,與冠狀蛋白1C競爭miR-1-3p的結(jié)合位點,通過抑制miR-1-3p的表達誘導冠狀蛋白1C上調(diào),下調(diào)N-cadherin、vimentin、Snail和Slug的表達水平,從而促進前列腺癌的侵襲、遷移和EMT進程[5]。基于ceRNA機制證實了lncRNA在前列腺癌EMT調(diào)控中占據(jù)重要地位,關(guān)鍵是ceRNA機制將與前列腺癌EMT相關(guān)的lncRNA與miRNA聯(lián)系起來,為揭開lncRNA調(diào)控功能帶來更多可靠的證據(jù)。見表1。
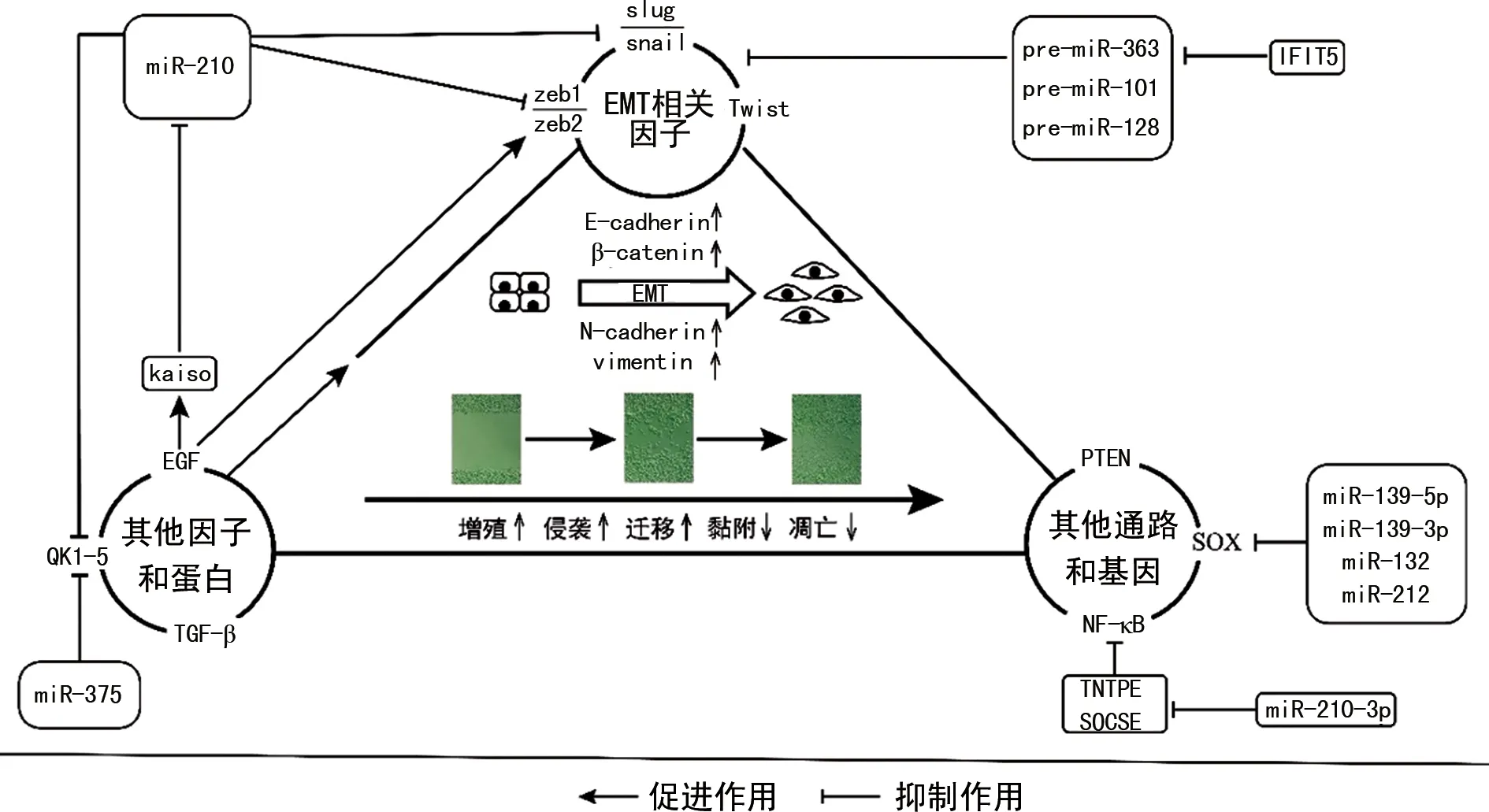
圖1 miRNA調(diào)控前列腺癌EMT的分子機制

表1 lncRNA作為ceRNA調(diào)控前列腺癌EMT的分子機制
2.2與其他機制相關(guān)的lncRNA 部分lncRNA可通過直接作用在前列腺癌的EMT中發(fā)揮調(diào)控作用。前列腺癌抗原3(PCA3)是首個用于前列腺癌診斷的lncRNA[30]。研究發(fā)現(xiàn)下調(diào)LNCaP細胞的PCA3后,E-cadherin、緊密連接蛋白3、緊密連接蛋白4和細胞角蛋白8的表達上調(diào),而Snail、Slug、Twist及vimentin的表達下調(diào)[30]。PCA3的下調(diào)與部分EMT標志物的表達逆轉(zhuǎn)有關(guān),因此,針對PCA3開發(fā)有效抑制劑或許可以為前列腺癌轉(zhuǎn)移的阻斷帶來新的轉(zhuǎn)機。XIAO等[31]發(fā)現(xiàn)lncRNA H19可以充當細胞黏附分子的轉(zhuǎn)錄抑制劑,沉默PC3細胞的lncRNA H19后,E-cadherin、整合素β3、整合素β4上調(diào),細胞運動性和侵襲性減弱,提示lncRNA H19可通過調(diào)控E-cadherin、整合素β3、整合素β4控制前列腺癌的EMT進展。同樣,lncRNA PCAT-1、lncRNA VIM-AS1和lncRNA 01638等也通過直接影響EMT相關(guān)蛋白標記物的作用方式來調(diào)控前列腺癌的侵襲、轉(zhuǎn)移。而另一些lncRNA則通過調(diào)控癌癥信號通路等參與EMT進程。LI等[32]證明lncRNA PlncRNA-1可通過TGF-β1途徑調(diào)節(jié)前列腺癌的細胞周期和EMT進程。TGF-β1信號通路是穩(wěn)定細胞生長動態(tài)平衡的重要通路,細胞致瘤后可通過激活TGF-β1獲得遷移能力并促進EMT進程。位于TGF-β1下游的lncRNA ATB是前列腺癌患者無復發(fā)生存的獨立影響因素,其表達水平可因TGF-β1的過表達而上調(diào)。研究表明,lncRNA ATB可通過細胞外調(diào)劑蛋白激酶和PI3K/AKT信號通路刺激Zeb1和Zeb217的表達,從而促進前列腺癌的EMT進程[33]。因此,lncRNA ATB有成為預測前列腺癌患者預后新指標的潛力,而TGF-β1作為部分lncRNA調(diào)控EMT的核心指標,在lncRNA靶點相關(guān)阻斷劑的研究中也極具價值。此外,PAN等[34]證明lncRNA MNX1-AS1可通過調(diào)控增殖細胞核抗原和磷酸化組蛋白H3影響DU145細胞中EMT標記蛋白的表達水平,從而抑制其EMT進程。這提示了在lncRNA與EMT相關(guān)蛋白直接作用的背后,其他潛在的作用因子和調(diào)控機制有待探究。
綜上所述,目前的研究多集中于ceRNA機制,或局限于已知的轉(zhuǎn)化相關(guān)因子和信號通路。但lncRNA是參與前列腺癌EMT調(diào)控中涉及基因蛋白互作最多的ncRNA,在前列腺癌高效靶點的發(fā)掘及臨床轉(zhuǎn)化中極具潛力,后繼仍需更多深入的研究將其中的復雜機制闡述清楚。
3circRNA與前列腺癌EMT
circRNA是沒有5′端或3′尾巴的獨特共價閉合環(huán)狀RNA分子,能以較強的穩(wěn)定性在哺乳動物細胞中廣泛表達[35]。在膀胱癌、乳腺癌和肝癌等癌癥中表達失調(diào)的circRNA,可通過包含ceRNA在內(nèi)的多種機制影響腫瘤的發(fā)生、發(fā)展。但其在前列腺癌中的調(diào)控作用還處于初步探索階段,對前列腺癌EMT的分子機制更是知之甚少。
YAN等[36]在IFN-γ誘導的PC3細胞中以高通量測序篩選了差異表達的circRNA,其中,800多種circRNA經(jīng)京都基因與基因組百科全書富集分析后均富集于與EMT相關(guān)的信號通路中,表明這些circRNA可能調(diào)控前列腺癌的EMT進程。研究表明,IFN-γ處理組的E-cadherin表達水平下調(diào),Twist1表達水平上調(diào),構(gòu)建的circRNA-miRNA-mRNA網(wǎng)絡提示,circ0001165可通過miR-187-3p調(diào)節(jié)TNF以誘導前列腺癌細胞中EMT的發(fā)生,circ0001085則通過miR-196b-5p間接調(diào)節(jié)PI3K/AKT和TGF-β信號通路,進而調(diào)控EMT進程[36]。然而,這些數(shù)據(jù)分析提供的機制線索需要加以驗證。生物信息學分析提示,在前列腺癌組織中上調(diào)的circ0005276是X連鎖凋亡蛋白抑制劑(XIAP)的宿主基因,研究表明circ0005276通過與RNA結(jié)合蛋白相互作用激活XIAP的轉(zhuǎn)錄,從而促進前列腺癌細胞的的增殖和EMT進程[37]。作為后起之秀,circRNA同樣可作為ceRNA以“miRNA海綿”參與促進或抑制前列腺癌的EMT進程。JIN等[38]證實,沉默前列腺癌中高表達的circZNF609,PC3細胞的vimentin、蛋白水解酶3、蛋白水解酶9和基質(zhì)金屬蛋白酶9下調(diào)。circZNF609可通過上調(diào)miR-186-5p,負向調(diào)控Yes相關(guān)蛋白1通路和單磷酸腺苷活化蛋白激酶信號途徑,從而抑制前列腺癌的細胞遷移和侵襲。另外,YANG等[39]研究發(fā)現(xiàn),過表達前列腺癌細胞中的circSMAD2可致miR-9水平下調(diào),E-cadherin水平上調(diào),vimentin水平下調(diào),表明EMT進程受阻。結(jié)果顯示,circSMAD2可通過下調(diào)miR-9抑制前列腺癌的EMT進程[39]。在前列腺癌中低表達的circAMOTL1L則可充當miR-193a-5p的海綿,通過弱化原鈣黏蛋白超家族中的Pcdha基因簇抑制miR-193a-5p,下調(diào)E-cadherin和β-catenin,從而促進前列腺癌的EMT進程[40]。同樣在前列腺癌中低表達的circITCH與前列腺特異性抗原、腫瘤分期和Gleason評分等高度相關(guān),過表達該基因可抑制前列腺癌的惡性表型轉(zhuǎn)化,circITCH可通過充當miR-17-5p的海綿,上調(diào)HOXB13基因的表達,從而促進前列腺癌的惡性進展[41]。無論是促癌或抑癌基因,這些circRNA的初步研究結(jié)果均有指示意義,為circRNA的深入探究做了鋪墊。
盡管circRNA在前列腺癌EMT中有調(diào)控作用,但具體機制和調(diào)控方式仍不清楚。circRNA作為結(jié)構(gòu)穩(wěn)定性最強的ncRNA,其在細胞中的差異表達被認為與腫瘤的惡性侵襲有密切關(guān)系,miRNA和lncRNA在前列腺癌EMT中的調(diào)控機制或許可以為起步較晚的circRNA提供一定線索,甚至發(fā)現(xiàn)更多關(guān)于這3種ncRNA共同調(diào)控前列腺癌上皮向間充質(zhì)轉(zhuǎn)化的潛在聯(lián)系。
4 總結(jié)與展望
EMT是一個多途徑且多基因參與的生物學過程,在前列腺癌的惡化轉(zhuǎn)移中極為關(guān)鍵。因ceRNA模式而緊密聯(lián)系起來的ncRNA,在前列腺癌EMT中構(gòu)成龐大的調(diào)節(jié)網(wǎng)絡,與其他潛在機制一同為前列腺癌EMT的深層探究提供了全新、全面的視角。盡管對ncRNA調(diào)控前列腺癌EMT的研究有所收獲,但其具體機制仍需更多可靠的數(shù)據(jù)。且安全有效的癌基因傳遞系統(tǒng)和有效腫瘤抑制劑的開發(fā)也亟需解決,以此才能促進靶點的臨床轉(zhuǎn)化。相信隨著高通量測序技術(shù)和生物信息學的日益進步,高效的ncRNA分子靶標將被成功運用于臨床,攻克前列腺癌惡性轉(zhuǎn)移的難題。

